欧盟草药药品注册管理现状与中药欧盟注册策略
瞿礼萍 ,王 梅 ,邹文俊 *
1.成都中医药大学 西南特色中药资源国家重点实验室,四川 成都 610037
2.成都中医药大学药学院,四川 成都 610037
3.莱顿大学生物学研究所 中药与天然药物研究中心,荷兰 莱顿 2300 RA
4.荷兰SU生物医药有限公司,荷兰 莱顿 2333 BE
中医药是我国具有原创性优势和巨大发展潜力的战略性产业,也是有望以我国为主导取得创新突破、对世界科技和医学发展产生重大影响的领域。自国家“九五”攻关计划以来,中医药的国际化发展受到高度重视和支持,中药进入国际市场成为中医药行业的重要任务。欧盟是全球最大的经济体,也是对传统药物接受度较高的西方地区。中药、植物药等传统药物在欧盟被称为草药药品(herbal medicinal product,HMP),1965年欧盟第1部药品法令65/65/EEC已将HMP纳入药品范畴,2004年《欧盟传统草药指令》(2004/24/EC)的颁布,更是以立法形式明确了传统草药的药品地位。无论经济实力、消费观念,还是监管环境,欧盟都是西方最成熟的植物药市场,开展欧盟注册、推动中药进入欧盟药品市场则是中药国际化和发展中药产业的重要路径[1-2]。目前,距离2004/24/EC颁布已经17年,其规定的7年过渡期早已结束并在欧盟各成员国全面实施10年时间,欧盟已形成系统的HMP注册管理制度,批准了超过2500件HMP上市申请[3],我国虽有地奥心血康胶囊、丹参胶囊、板蓝根颗粒、豨莶草片和愈风宁心片5个单方产品在欧盟成员国成功获批[4-7],但均为传统HMP身份和成员国注册途径,要实现中药进入欧盟主流药品市场尚有距离。本研究拟系统分析欧盟HMP注册管理制度及其实施情况,探索未来开展中药欧盟注册的策略与思路,为国内中药企业及政府相关部门提供参考。
1 欧盟HMP注册管理制度
1.1 注册管理法规体系
1.1.1 法令与有关指南 法令与相关指南构成了欧盟HMP注册管理的法规框架体系。2001/83/EC是欧盟监管人用药品注册、生产、销售、广告及包装标签等的综合性法令,也是监管HMP的核心,其余还包括对该法令进行修订或补充的3部法令。其中,2004/27/EC主要修订了人用药品研发、药物警戒等方面[8];2003/63/EC主要修订了附录1药品申请文件的要求,并结合HMP特殊性对相应申报资料做出了规定[9];2004/24/EC专门对HMP注册有关内容进行修订,提出传统应用HMP的注册类别并实行简化注册[10]。在指南方面,欧盟围绕HMP质量、非临床评价、临床评价及特定安全性问题制定了系列文件,包括计划书(concept paper,CP)、意见书(reflection paper,RP)、技术指南(guideline,G)、问与答(questions and answers,Q&A)和公开声明(public statement,PS)5种类型。CP是经初步调研后提出的实施建议、构想和设计,成熟度最低。RP是针对具体问题提出的体会、意见或建议,成熟度较CP更高。G是成熟度最高的指南文件,CP和RP经讨论协商后可转变为G。Q&A是针对某一主题以问答形式展示审评中的常见问题,是供申请者或公众快速查阅相关问题的文件。PS主要针对药物警戒相关问题,用以警示公众用药安全。统计截至2021年7月欧洲药品局(European Medicine Agency,EMA)网站公布信息(表1)显示,欧盟已发布各类有关指南文件41个,以PS、RP和G居多,提示其指南文件已趋于成熟,对法令形成了有效补充。从涉及的内容看,以HMP质量和特定安全性问题居多,且大多为2004/24/EC实施初期发布,并在近几年进行了相应修订。
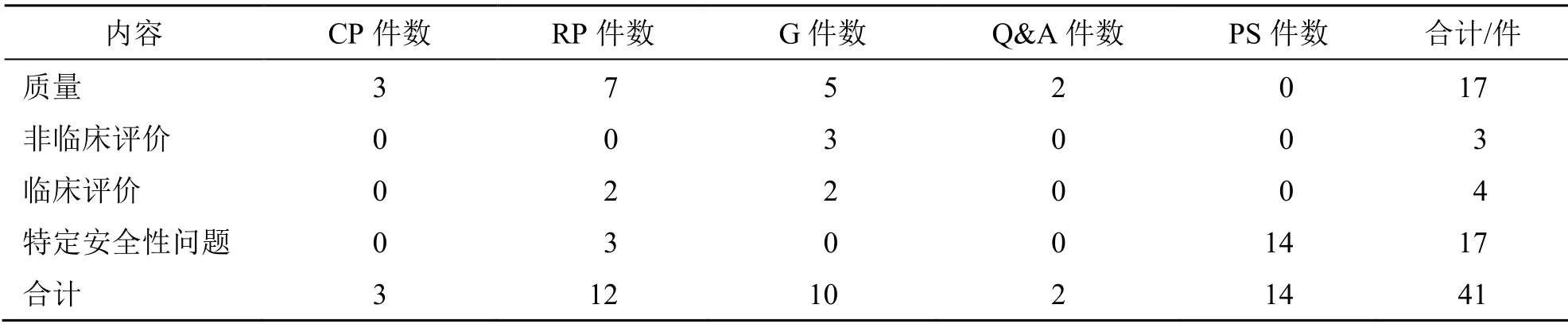
表1 欧盟发布的HMP有关指南文件数量Table 1 Number of scientific guidelines for HMP issued by European Union
1.1.2 欧盟草药专论与准入目录 欧盟草药专论(European Union monograph,EUM)和准入目录(list entries,LE)也是欧盟HMP注册法规体系的重要组成,二者均经由EMA下设的HMP委员会(Committee on Herbal Medicinal Products,HMPC)评价制定。EUM是依据2001/83/EC和2004/24/EC的规定,评价特定草药已有的安全性与有效性相关文献资料而制定,是由HMPC发布的类指南文件,内容结构与产品特性摘要类似。LE是在EUM基础上进一步评价安全性资料(尤其遗传毒性)后制定,最终由欧盟委员会发布的法定文件。二者代表了欧盟层面对草药安全与有效性的科学评价结论,构成了各成员国药品主管机构(national competent authority,NCA)审批相关HMP注册申请中的审评基础和重要依据,可替代相应的安全性、有效性研究资料或传统应用证据,且欧盟规定通常情况下NCA需遵循EUM的内容,LE更具有法律强制效力。本课题组前期已撰文系统分析二者的概念、分类、在HMP各注册程序中的作用等问题[11-15]。截至2021年7月,HMPC已制定发布166个EUM,由欧盟委员会发布13个LE[16]。EUM和LE与前述法令和指南共同构成了欧盟HMP的注册管理法规体系,且随着欧盟评价草药数量的增多,其在节约HMP研发与审评资源以及促进欧盟范围内HMP领域技术的协调统一,日益发挥着至关重要的作用。
1.2 上市途径
如图1所示,欧盟药品注册上市途径包括集中程序、分散程序、互认可程序及成员国程序。其中,集中程序由EMA负责审评,针对整个欧盟市场,主要适用于治疗肿瘤、神经退行性疾病、艾滋病、糖尿病、免疫相关疾病等疾病领域或用作孤儿药的HMP。另3类程序均由各成员国NCA负责审评,对适应症未作限定。分散程序和互认可程序为欧盟互认可原则下的2类上市途径,分散程序为未曾获得欧盟任一成员国批准的HMP同时将申请递交至多个成员国,互认可程序是HMP在某一成员国获批后向其他成员国提出申请的情形。它们均以率先启动审评的国家作为参考成员国(reference member state,RMS)进行技术评价并撰写评估报告,其余受理申请的国家作为有关成员国(concerned member state,CMS),不再单独审评,主要核实RMS提供的评估报告;除发生严重威胁公众健康的事件外,CMS应认可RMS的审批决定。HMP通过分散程序和互认可程序可在欧盟多个成员国上市销售。成员国程序则是针对单一成员国提出申请,最终只能在1个国家上市。分散程序和互认可程序相对于成员国程序,避免了不同成员国对同一药品的重复审评,既节约审评资源、提高注册效率,也促进了技术协调统一,是对集中程序与成员国程序的有效补充。值得注意的是,2004/24/EC第16d(1)条明确规定分散程序和互认可程序只适用于已建立相应草药EUM或LE的HMP。
1.3 注册类别
根据2001/83/EC和2004/24/EC,欧盟HMP注册类别包括新型HMP、固有应用(well-established medicinal use,WEU)HMP和传统应用(traditional medicinal use,TU)HMP这3类,见图1。新型HMP主要针对无人用经验的全新产品,等同于新药,须完成欧盟通用技术文件模块3~5中的产品理化、生物或微生物、药理、毒理和临床试验等所有研究,进行完整申请。WEU HMP适用于在欧盟应用超过10年、具有明确的定量使用数据和能充分反映草药安全与有效性科学文献的产品,这又被称为文献申请,可采用相应科学文献替代模块4、5的非临床和临床试验研究报告,如公开发表的对照试验研究、队列或纵贯性研究、观察性研究、病理对照研究及包括WHO专论、德国E委员会专论、欧洲植物疗法科学合作组织专论在内的规范人用资料集等[17];若上述文献资料无法达到最低要求,则需另行补充研究数据,则为混合申请。TU HMP是2004/24/EC针对具有长期人用历史但无法满足WEU规定的HMP而设定,无需提供科学文献逐项支撑模块4、5中非临床和临床研究中的每个研究项目资料,只需采用文献、专家证据和安全性综述与报告证明产品具有充分的传统应用及安全性,即为简化注册。但与此同时,欧盟对TU HMP亦有严格限定条件,如无需医师诊断和干预,剂型只能为口服、外用或吸入制剂,须有充分传统应用资料证明产品在特定条件下使用无害、且在药品申请日之前已有30年以上药用历史(含在欧盟药用超过15年)等。可见,除新型HMP外,WEU和TU HMP均具有人用经验,欧盟依据其人用证据的科学性程度,对申报技术要求做出不同程度的减免。前述EUM实际上是基于这2类HMP已有的文献资料进行科学评价后予以制定,亦分为WEU和TU EUM 2类,LE则仅针对TU HMP。

图1 欧盟HMP的上市途径与注册类别Fig.1 Market access and category of registration for HMP in European Union
2 欧盟HMP注册审评审批现状
2004/24/EC对TU HMP注册类别的补充,标志着欧盟HMP注册管理制度的完善,对规范欧盟HMP监管和贸易流通有着积极促进作用。本部分依据EMA网站最新数据[3],统计分析2004/24/EC实施(2004年4月30日)至2016年12月31日欧盟HMP注册审批相关信息。
2.1 审评审批概况
2004/24/EC实施后,欧盟于2009、2010和2016年先后批准了3个新型HMP,分别为茶多酚软膏、大麻口腔黏膜喷剂和桦树皮胶。统计TU HMP和WEU HMP的审评审批情况,在TU HMP方面,欧盟各成员国合计受理2730件申请,有1719件获批,另有240件不予批准、197件为撤回、574件处于审评中;以“批准件数/(批准件数+不批准件数+撤回件数)”计算批准率,为79.73%;在WEU HMP方面,欧盟各国合计受理1428件申请,批准了862件,另有64件不予批准、181件为撤回、321件处于审评中,同前述TU HMP计算平均批准率为76.62%,其中,批准的WEU HMP申请中有3件涉及的产品在获批3年内未在市场销售或连续撤市3年,其上市许可依据欧盟“日落条款”[18]已失效,未计入表2中;其余还包括64件不予批准、181件撤回和321件处于审评中的申请。从获批的历年趋势看,如表2所示,WEU HMP相对较为稳定,2008年前维持在约50件/年,其后稍有上升,基本保持在70~100件/年;而TU HMP作为2004年提出的新注册类别,在2008年以前的批准量为个位数,随着实施2004/24/EC的成员国增多,其后逐步增加,尤其2004/24/EC规定的全面实施过渡期于2011年结束,该年度批准量达374件,至2014年后逐步恢复至120~140件/年的水平。
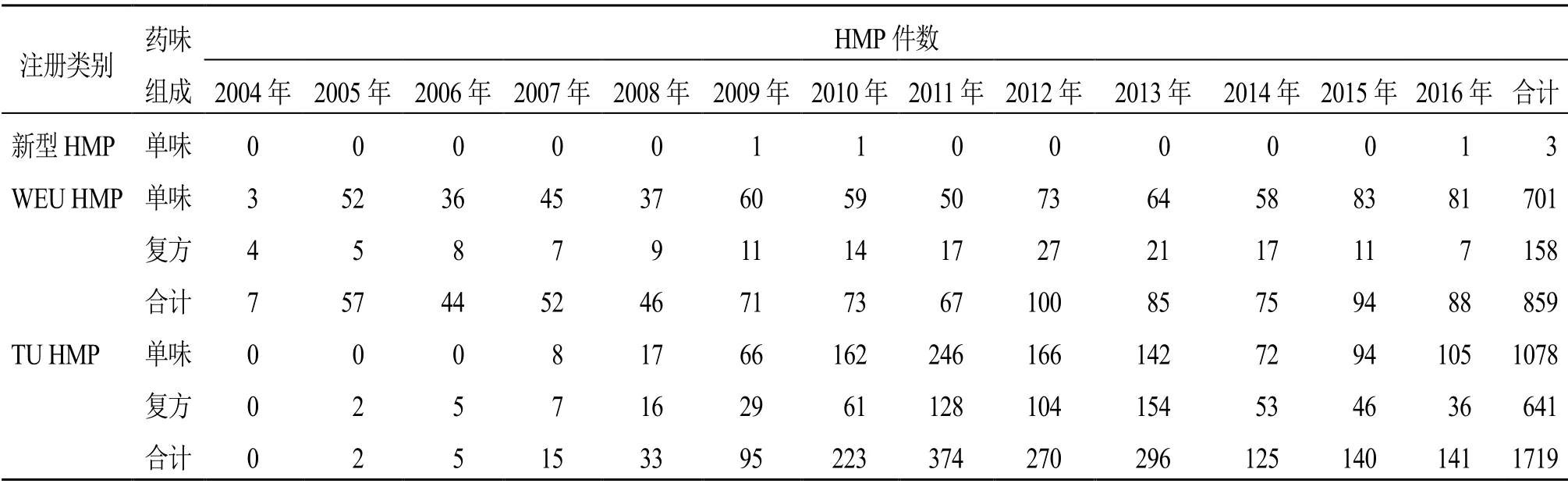
表2 欧盟及各成员国批准的各类HMP数量[3]Table 2 Number of HMP approved by European Union and its member states[3]
2.2 各成员国审评审批情况
欧盟批准的3个新型HMP中,Episalvan是以集中程序途径在整个欧盟市场获得上市许可,由EMA审评。茶多酚软膏和大麻口腔黏膜喷剂均以互认可程序途径上市,前者首先在德国提出申请并获批上市,以德国为RMS,其后提出上市申请的CMS包括奥地利、法国、比利时、意大利、西班牙等22个成员国。大麻口腔黏膜喷剂的RMS为荷兰,CMS包括奥地利、比利时、丹麦、芬兰、法国等17个成员国。
截至2021年7月,欧盟TU HMP和WEU HMP均通过成员国程序或互认可程序、分散程序申请,由NCA负责审评。分析二者在各成员国的受理和批准情况,见表3。在TU HMP方面,其申请主要分布在德国、英国、波兰和奥地利,分别为513、450、315、224件,合计占总受理数的55.02%,其后为法国(171件,6.26%)、西班牙(162件,5.93%)、匈牙利(115件,4.21%)、瑞典(87件,3.19%)、爱尔兰(85件,3.11%)和荷兰(80件,2.93%)。在WEU HMP方面,受理申请的成员国分布集中度更高,大量申请集中在德国,受理申请数为447件,占总受理数33.01%,其余各成员国均不足100件,占比多在5%及以下。进一步计算各成员国的批准率发现,在TU HMP受理件数排名前10位的成员国中,批准率普遍较高,有7个国家高于TU HMP的平均批准率(79.73%),以匈牙利最易获批,其完成审评的65件申请全部获批,批准率为100%;奥地利、爱尔兰、瑞典、法国已完成审评的申请中,也无不予批准的TU HMP申请,仅涉及部分企业撤回的情形;西班牙、德国是审批相对严格的成员国,不予批准率分别为34.84%、23.45%,远高于其余国家。在WEU HMP方面,受理件数排名前10位中有5个国家的批准率高于平均水平(76.62%);其中奥地利、罗马尼亚、斯洛文尼亚的批准率均为100.00%,瑞典、法国完成审评的WEU HMP申请中亦无不予批准的情形,仅涉及少数企业撤回申请;德国的批准率与欧盟平均水平相似,为76.05%;立陶宛、克罗地亚和捷克共和国的不予批准率相对较高。

表3 受理TU HMP和WEU HMP件数排名前10位的欧盟成员国[3]Table 3 Top 10 European Union’s member states in application number of TU HMP and WEU HMP[3]
2.3 已获批HMP的特点
2.3.1 药味组成 从药味组成看,欧盟批准的3个新型HMP均为来自单一药味的单方产品,茶多酚软膏是从绿茶水提物中进一步精制的儿茶素类成分(质量分数>80%),大麻口腔黏膜喷剂是大麻的液化二氧化碳提取物,主要活性成分为δ-9-四氢大麻酚和大麻二醇,桦树皮胶是桦树皮的正庚烷提取物。TU HMP和WEU HMP则均涉及由2味或以上药味组成的复方,以TU HMP中的复方产品相对更多,涉及641件,占获批TU HMP申请总体的37.30%,WEU HMP为158件,占获批WEU HMP申请的18.39%。如表4所示,统计欧盟公布的630件复方TU HMP和WEU HMP的药味数,结果提示这2类申请所涉及HMP的药味组成均以2~4味居多,合计分别占78.26%、65.80%;但复方TU HMP中仍有111件(17.62%)申请的药味组成为5~9味,有18件申请的组成超过10味;欧盟公布的155件复方WEU HMP中亦有47件(30.32%)申请的为5~9味药组成,有4件申请的药味组成超过10味。其他是指包括维生素或矿物质的复方HMP,TU HMP和WEU HMP的占比分别为1.27%、1.29%。

表4 欧盟成员国批准复方WEU和TU HMP的药味数[3]Table 4 Number of component in compound HMPs approved by European Union’s member states[3]
2.3.2 治疗领域 欧盟批准的3个新型HMP中,茶多酚软膏用于尖锐湿疣,大麻口腔黏膜喷剂用于多发性硬化症引起的痉挛,桦树皮胶用于局部深度创伤,如烧伤或手术植皮等。同时,本部分依据EMA网站检索项中设置的治疗领域情况,分析已获批TU HMP和WEU HMP的适应症(部分申请涉及多个),统计其治疗领域出现的频次并计算占比,见表5。TU HMP涉及的治疗领域以感冒与咳嗽、心理应激及情感障碍、胃肠疾病、尿路及妇科疾病和睡眠障碍居多,且申请件数的分布较为平衡,占TU HMP总申请数的9.84%~18.45%;其余相继为疼痛及炎症、口腔和咽部疾病、皮肤疾病和小伤口、静脉微循环障碍、疲劳和虚弱等。WEU HMP的治疗领域集中度相对更高,虽然也以感冒与咳嗽居首位,但占比约达25.31%,其后仅有尿路及妇科疾病、心理应激及情感障碍的占比约10%左右,其余领域占比均为个位数,分别为便秘、睡眠障碍、静脉微循环障碍、疼痛及炎症等。此外,尚有分别约7.15%、22.22%获批TU HMP与WEU HMP申请的治疗领域为“其他”,这主要指未在EMA网站检索项中设置的领域,包括心血管疾病、改善肝功能、脑供血不足等非自我药疗范畴。可见,TU HMP仍有少数产品获批用于需医师诊断或干预的疾病,但主要为经医师排除严重情况的轻微病症或辅助治疗,如欧益母草的适应症为“经医师排除严重情况,用于缓解神经性心脏疾病的心悸症状”,这类心血管疾病经医师排除严重情况后,患者经初次诊疗后一定时期内日常用药亦可基本实现自我药疗。由于欧盟未对WEU HMP的适应症进行限定,由表5可见其申请中涉及的“其他”治疗领域占比明显高于TU HMP。
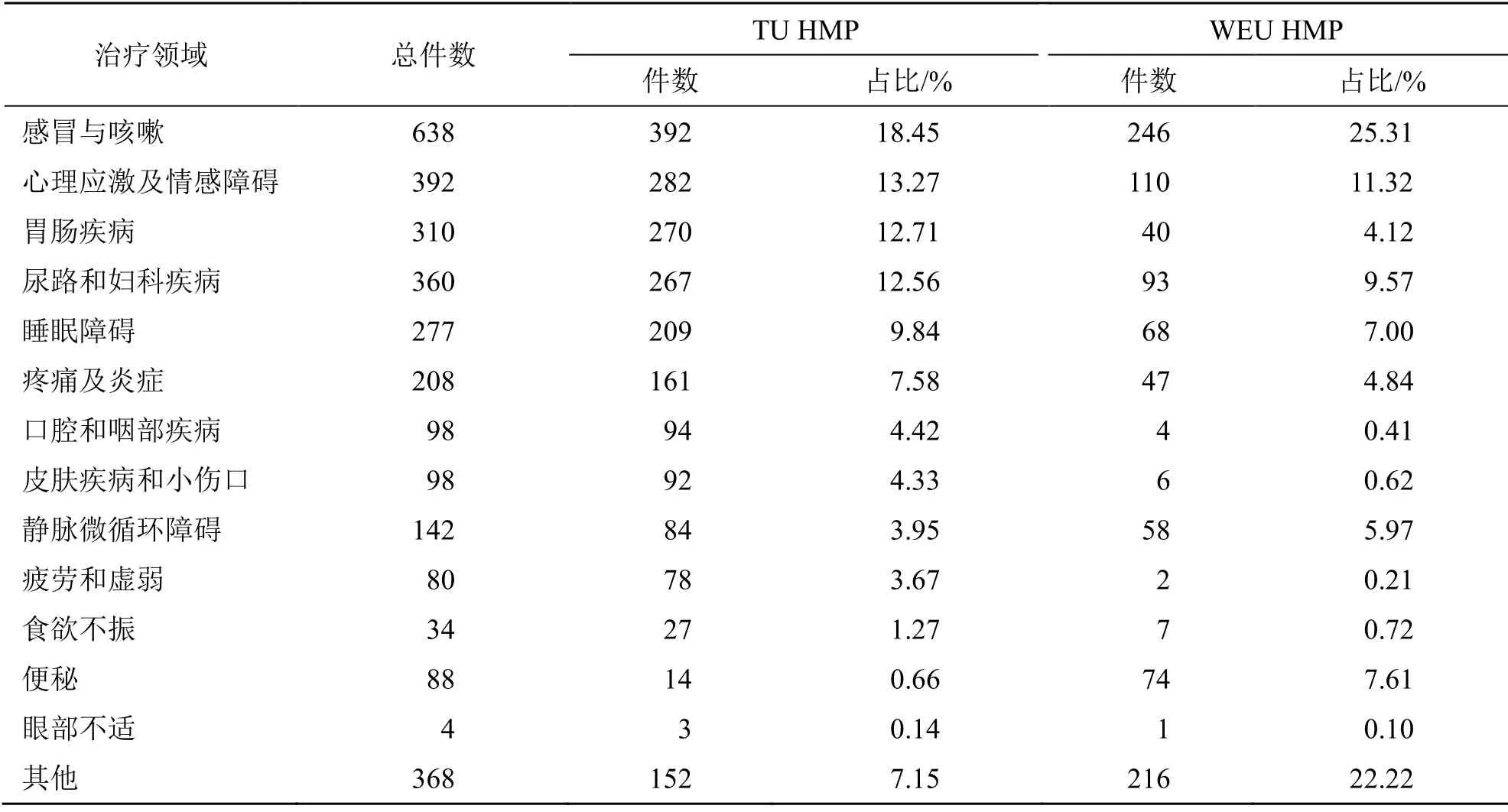
表5 欧盟批准TU HMP和WEU HMP的治疗领域[3]Table 5 Therapeutic area of TU HMPs and WEU HMPs approved by European Union[3]
2.3.3 所涉及草药的EUM评价制定 本部分分析欧盟各成员国批准的1066件单方TU HMP和694件单方WEU HMP申请所涉及草药的EUM评价制定情况(表6),提示EUM与欧盟HMP注册审批具有极强的关联性。其中,在1066件单方TU HMP申请中,合计涉及162味草药,有113味已经完成EUM的评价,其中的108味草药制定EUM,另5味草药经评价不符合欧盟对TU HMP的要求而发布PS;在694件单方WEU HMP申请中,共涉及61味草药,其中有47味已完成EUM评价,分别发布了45个EUM和2个PS。进一步分析已制定TU EUM和WEU EUM的草药,分别约24.07%(26味)和22.22%(10味)的草药只有1件TU或WEU HMP注册申请,其余大部分已制定EUM的草药均涉及2件及以上,提示EUM已在欧盟HMP注册实际中得到相当程度的应用,这与Peschel[19]对2004—2012年欧盟各成员国批准的HMP分析结果一致。可见,EUM对于申报企业和监管当局均具有重要价值。此外,尚有少数发布PS的草药亦有相关HMP申请获批,如HMPC虽然发布了欧槲寄生PS,但仍有12件TU HMP和8件WEU HMP申请获得批准,这也是欧盟药品监管集中与分权并存特点的体现。
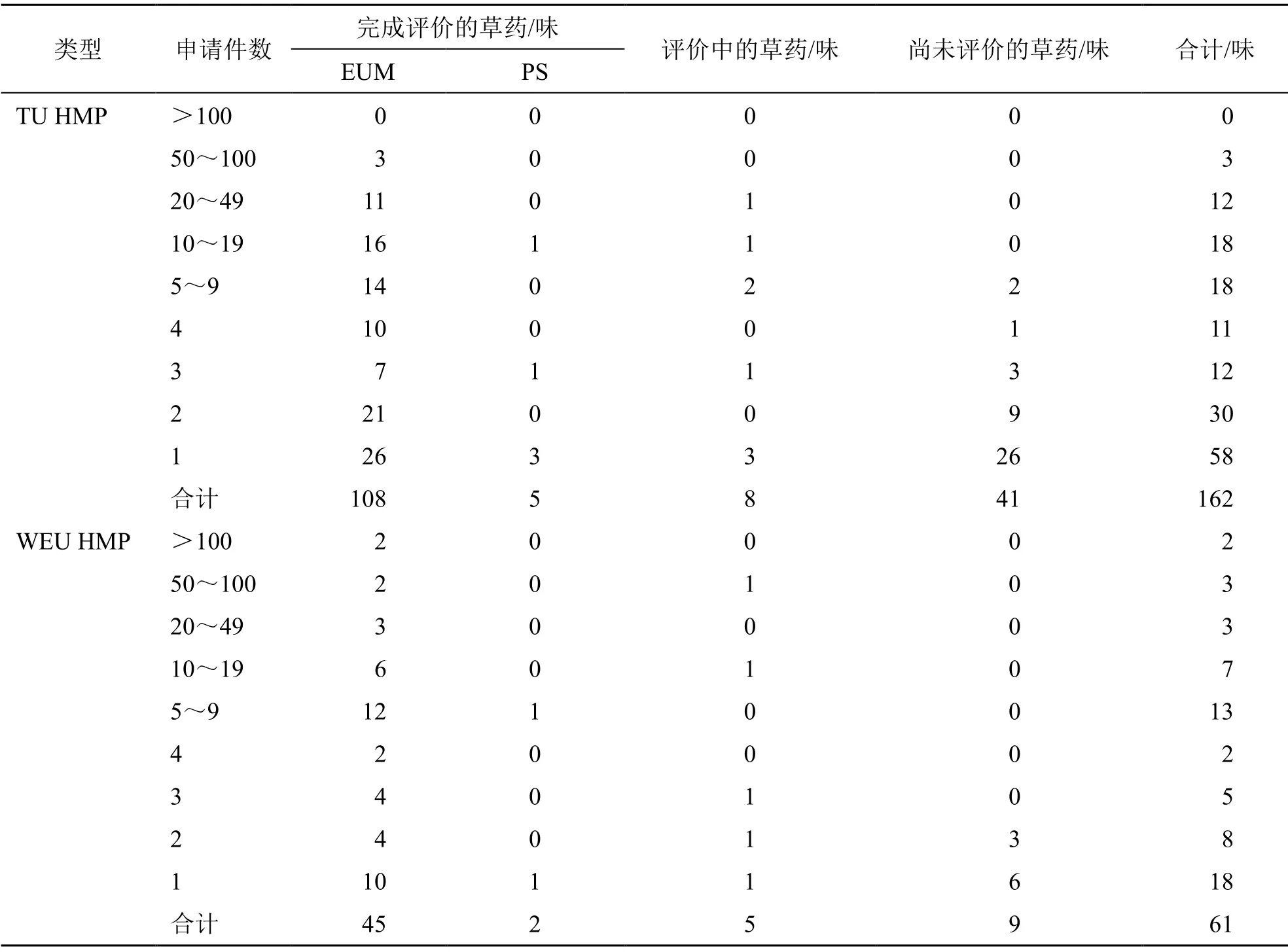
表6 欧盟批准单方HMP申请所涉及草药的EUM评价数量[3]Table 6 Number of EUM evaluations of medicinal herbs involved in mono-HMPs application approved by European Union[3]
3 中药欧盟注册的思路与策略
3.1 注册类别与上市途径多元化发展
自国家“九五”以来,国内多家企业相继启动中药欧盟注册工作。虽然亦有少数产品在欧盟成员国获批上市,但均以TU HMP身份通过成员国程序途径在欧盟各成员国进行注册,适应症被限制为自我药疗范围,上市后仅能进入单一欧盟成员国,注册效率低,市场受益有限。欧盟HMP有3种注册类别,根据前述分析,欧盟获批的HMP虽然以TU HMP获批申请(1719件)最多,平均批准率为79.73%,但亦有大量的WEU HMP(862件)取得上市许可,且其平均批准率为76.62%,与TU HMP较为接近,另有3个新型HMP获批。反观我国中药新药上市申请的平均批准率,本课题组前期统计2007—2019年数据结果仅为15%[20]。尽管中药在欧盟注册的难度大于欧盟本土HMP,这依然提示了中药欧盟注册类别多样化的可行性。与此同时,本研究发现欧盟获批HMP的上市途径也是多样的,除了成员国程序,亦有相当产品通过互认可程序、分散程序甚至集中程序形式进入欧盟多个成员国甚至整个欧盟药品市场。因而,中药不应局限于仅以TU HMP在单一欧盟成员国开展注册,国内企业应加强对欧盟WEU HMP和新型HMP相关技术要求的关注,根据企业自身情况和产品特点的不同,逐步探索形成中药欧盟市场准入的多元注册模式,有效提高注册效率和欧盟药品市场份额。
3.2 不同类别HMP注册的欧盟成员国选择有所差异
欧盟HMP上市途径中仅有集中程序由EMA直接负责审评,其余均由各成员国NCA负责。同时,仅有适应症属于肿瘤、神经退行性疾病、糖尿病等领域的HMP方可通过集中程序上市,绝大部分只能以分散程序、互认可程序或成员国程序上市销售。因而,大多情况下中药欧盟注册会涉及注册成员国的选择。已有的研究[2,21]从对HMP身份的认可度、技术要求门槛、市场规模及已成功注册中药产品的国别等角度考虑,建议中药欧盟注册优先选择比利时、德国、法国、荷兰、英国等,并尽可能避免希腊、爱尔兰、意大利、卢森堡等。本研究分析结果提示,不同注册类别的HMP其在各成员国的受理与批准情况有所差异。WEU HMP申请分布的成员国高度集中在德国,涉及447件,占欧盟受理总数的33.01%,其后的奥地利、克罗地亚、捷克共和国等远低于德国,均不足80件;但从批准率看,以奥地利、罗马尼亚、斯洛文尼亚最高,达100.00%,瑞典、法国紧随其后,分别为88.46%、86.21%,德国批准率与欧盟的平均水平接近,为76.05%。结合各国植物药市场规模情况,德国、奥地利、法国、罗马尼亚、瑞典等均是WEU HMP注册国家的较好选择,波兰虽然批准率略低于欧盟平均水平,但其市场相对较大,也是值得考虑的国家。TU HMP申请的成员国分布集中度低于WEU HMP,且在申请件数排名前10位成员国的批准率普遍较高。德国、英国、波兰和奥地利是受理TU HMP申请最多的4个国家,批准率亦极高,分别达100.00%、99.52%、98.00%、92.68%;法国、西班牙、匈牙利的批准率亦高于欧盟平均水平。需说明的是,TU HMP是2004/24/EC提出的新注册类别,由于该法令设置了7年过渡期,因而欧盟各成员国依据各国经济、植物药市场特点和正式实施法令的时间和进度不同,实施早、推进快的国家其受理量更多。结合TU HMP整体批准率较高,德国、英国、波兰、奥地利、法国、西班牙、匈牙利、爱尔兰、荷兰、瑞典等均是TU HMP理想的注册国家。
3.3 加强研究中药EUM并在欧盟注册中加以利用
EUM、LE与产品注册审批并行是欧盟HMP注册管理的典型特点之一,对促进技术协调、节约审评资源和提高注册审批效率有着积极地促进作用[22]。EUM和LE不仅代表HMPC对特定草药的科学评价结论,而且欧盟更从法律法规层面赋予二者在NCA审批中的重要价值与法定地位。它们在成员国程序、分散程序、互认可程序上市途径中,可直接作为企业申请资料或NCA审评参考依据;在互认可程序、分散程序中更是不可或缺的前提,只有已评价制定EUM的草药才能通过这2种途径申请上市。从“2.3.3”项的分析也可看出,EUM在欧盟成员国HMP的审批实践中已经得到相当程度的认可与应用。可见,EUM对我国中药欧盟注册的价值与意义重大。对于国内中药企业而言,注册已制定EUM中药的相关产品在某种程度上也是中药欧盟注册的“捷径”,可进一步简化中药作为TU HMP和WEU HMP的上市审批过程。但遗憾的是,欧盟已经完成EUM评价的中药是有限的,目前仅有贯叶金丝桃、亚麻子、干姜、姜黄、甘草、小茴香、菊苣、没药、蒲公英、葫芦巴10味中药完成EUM的评价制定。为充分运用EUM与中药欧盟注册的关联机制,国内产业界、学术界和相关政府机构还应整合资源,将开展欧盟注册的中药产品与EUM的评价制定有机结合起来,确立重点中药目录,有针对性地开展科学研究,提供相应的安全性、有效性科学证据,并加强与欧盟的合作交流,促进更多中药EUM的评价与制定,积极探索中药EUM与产品注册有机关联的中药欧盟注册模式。
利益冲突所有作者均声明不存在利益冲突

