基于纳米技术研究葶苈子炭治疗急性肺损伤的物质基础及其机制
赵玉升,李伟洋,曹天佑,陈玉民,白 雪,张 盈,吴 同,屈会化,赵 琰*
1.北京中医药大学中医学院,北京 100029
2.漯河医学高等专科学校,河南 漯河 462002
3.北京中医药大学中药学院,北京 100029
4.北京中医药大学中医药研究院,北京 100029
葶苈子系十字花科播娘蒿属植物播娘蒿Descurainia sophia(L.) Webb.ex Prantl.或独行菜Lepidium apetalumWilld.的干燥成熟种子。性辛、苦,大寒。归肺、膀胱经,具有泻肺平喘、利水消肿之功效[1]。《伤寒杂病论》中更是将葶苈子用于治疗肺痈、结胸、支饮等肺系疾病。
碳量子点是一类新兴的以碳为骨架的纳米材料,具有光稳定性好、毒性小、生物相容性好、水分散性好等优点[2-3]。由于这些优势,碳量子点在生物成像[4]、药物传递[5]、纳米医学[6]等多个领域引起了广泛关注。值得注意的是,由于碳量子点具有显著的优势,其相关应用开发为发现有效控制或治疗某些疾病的新一代药物提供了许多策略。碳量子点的相关生物活性如止血[7]、抗炎[8]、抗菌[9]和抗肿瘤[10]等已经得到广泛研究,引起了国内外科学家的广泛关注,以期研究碳量子点的其他医药和生物医学应用。
本研究从纳米材料学角度出发,发现葶苈子经过高温炮制后产生了一种新的物质,将其命名为葶苈子炭纳米类成分(Descurainiae Semen Carbonisatumnano-components,DSC-NCs),利用低分辨透射电镜(TEM)、高分辨透射电镜(HR-TEM)和X射线衍射仪(XRD)对DSC-NCs的微观结构进行表征,进一步利用HPLC排除小分子存在的干扰性,利用紫外光谱、荧光光谱、傅里叶变换红外光谱(FTIR)、X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)等方法来获取DSC-NCs的化学基团信息。经过分析发现该成分符合纳米材料中碳量子点的基本特征,且有报道表明碳量子点治疗急性肺损伤(acute lung injury,ALI)具有广泛的应用前景。因此,本研究利用脂多糖诱导大鼠ALI,探究DSCNCs对ALI的保护作用及其保护机制,以期为临床治疗ALI提供新的药物和策略。
1 仪器与材料
1.1 仪器
PXR-9马弗炉,北京中科澳博科技股份有限公司;JEN-1230高分辨透射电子显微镜,日本电子株式会社;F-4500荧光分光光度计,日本Hitachi公司;D8-Advanced X射线衍射仪,德国Bruker AXS公司;CECIL紫外分光光度计,英国Cambridge公司;Agilent 1260系列高效液相色谱仪,美国Agilent Technologies公司;TecnaiG220透射电子显微镜(TEM),美国FEI公司;JEN-1230傅立叶转换红外光谱仪和Escalab 250Xi X射线光电子能谱分析仪,美国Thermo公司。
1.2 药品和试剂
葶苈子,产地河北,批号200723002,经北京中医药大学赵琰教授鉴定,为十字花科播娘蒿属植物播娘蒿D.sophia(L.) Webb.ex Prantl.的干燥成熟种子,采购于北京仟草中药饮片有限公司;地塞米松,规格0.75 mg/片,批号H33020822,购于浙江仙琚制药股份有限公司;脂多糖与10%组织固定液购于北京拜尔迪生物技术有限公司;相对分子质量(Mw)1000透析膜购于北京瑞达恒辉科技发展有限公司;白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒、IL-1β ELISA试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒均购于武汉云克隆科技股份有限公司;考马斯亮蓝蛋白定量试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛试剂盒等均购买于南京建成生物工程研究所;乙醇和其他分析级化学试剂均购于北京化学试剂公司;双蒸水与蒸馏水购买于北京拜尔迪生物技术有限公司,去离子水由北京中医药大学科研逸夫楼提供。
1.3 动物和细胞
SPF级SD雄性大鼠48只,体质量(200.0±10.0)g,质量合格证编号为110324201102996362。实验动物均购于北京金牧阳实验动物养殖有限责任公司。实验环境为北京中医药大学西校区动物房屏障系统,保持室温(24.0±1.0)℃,相对湿度55%~65%,12 h明暗交替,通风良好,饲养期间内自由进水、进食,实验前12 h小鼠禁食不禁水。本实验相关动物实验遵循北京中医药大学有关实验动物管理和使用的规定,均符合3R原则。人肺泡腺癌基底上皮A549细胞购自国家实验细胞资源共享平台。
2 方法与结果
2.1 DSC-NCs的制备
称取葶苈子干燥药材480 g,放于坩埚中,铝箔纸密封并加盖于马弗炉中烧制。马弗炉程序升温:第1阶段5 min升温至70 ℃,保温25 min;第2阶段25 min升温至350 ℃,保温1 h。将烧制好的葶苈子炭置于中药粉碎机中粉碎。称取炭粉末100 g,加入1800 mL去离子水中煎煮3次,温度为100 ℃,时间为1 h。然后使用0.22 μm微孔滤膜将煎煮液进行滤过,合并3次滤液,浓缩并选用Mw1000的透析膜透析7 d,烘干后获取粉末20 mg,于4 ℃保存,留置待用。
2.2 HPLC分析
利用HPLC比较所获得的DSC-NCs和葶苈子生药在成分上的区别。称取葶苈子生药2 g,加入40 mL甲醇超声处理30 min,获得甲醇提取液。将上述制备的DSC-NCs用水稀释至2 g/mL(按炭药量计算),获得DSC-NCs稀释液。所有样品使用0.22 μm微孔滤膜滤过后再进样。
色谱条件[11]:高效液相色谱仪采用四元泵-二极管阵列检测器,自动进样器;色谱柱为Reliasil-C18柱(250 mm×4.6 mm,5 μm);流动相为1%磷酸水溶液-乙腈,等度洗脱程序:0~12 min,10%乙腈;12~18 min,10%~14%乙腈;18~30 min,14%~19%乙腈;30~35 min,19%乙腈;35~40 min,19%~25%乙腈;40~50 min,25%乙腈;进样量10.0 μL;体积流量为1 mL/min;检测波长设定为330 nm;柱温30 ℃。
经过高温炭化、煎煮、滤过、浓缩、透析后获得DSC-NCs溶液,利用HPLC比较350 ℃下制备的DSC-NCs溶液和葶苈子生药乙醇提取液的成分差异。如图1所示,葶苈子乙醇提取液中可以观察到一系列峰,说明含有苷类化合物等小分子化合物。而与之形成鲜明对比的是,经过透析后的DSC-NCs溶液中观察不到小分子的存在,说明DSC-NCs溶液在经过透析过程后的小分子成分已经不存在了。经过HPLC的观察对比,在一定程度上排除了小分子化合物的干扰。
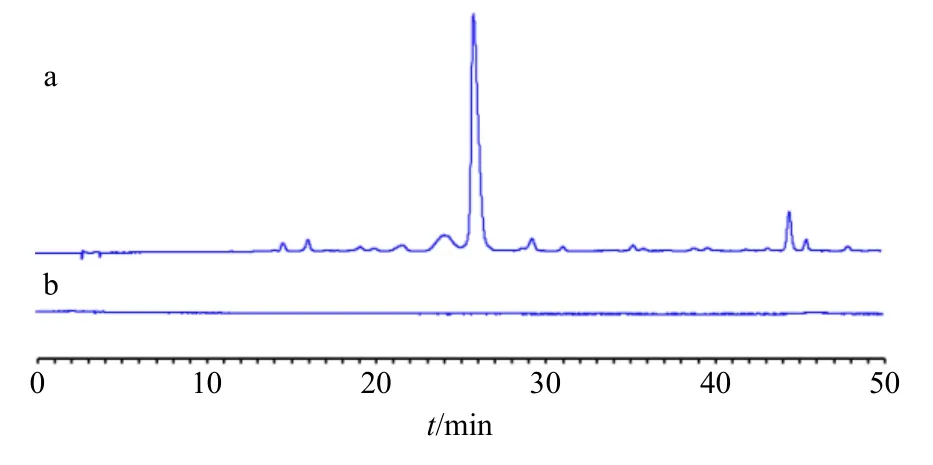
图1 葶苈子 (a) 和DSC-NCs (b) 的HPLC图Fig.1 HPLC profile of Descurainiae Semen (a) and DSCNCs (b)
2.3 DSC-NCs的表征
利用TEM、HR-TEM和XRD来获取DSC-NCs的形貌大小、粒径分布和晶格间距等微观结构信息;利用紫外光谱和荧光光谱来获取DSC-NCs的光学特征信息;利用FTIR来获取DSC-NCs表面的官能团信息;利用XPS来分析DSC-NCs中所含有元素及其可能连接方式。
图2-a为DSC-NCs低分辨电镜表征结果,可以看出,DSC-NCs外观形貌近球形,用Image J软件对200个颗粒进行统计分析,结果为该纳米类成分的粒径分布在2.5~6.5 nm,符合正态分布。图2-c为DSC-NCs的高分辨透射电镜表征结果,DSC-NCs晶格分布明显,晶格间距为0.224 nm。利用XRD进一步分析DSC-NCs内部原子在空间分布的状态,从图2-d中可以观察到1个典型的非晶体衍射峰,这与自下而上法倾向于产生含无定形碳核的纳米类成分有关[15]。

图2 DSC-NCs的表征组图Fig.2 Characterization of DSC-NCs
DSC-NCs的紫外光谱如图2-e所示,DSC-NCs在260~280 nm处可以观察到有一处微弱的吸收峰,这可能是由于含有杂原子的不饱和基团引起的n-π*跃迁所导致[16]。DSC-NCs的荧光光谱分析结果如图2-f所示,DSC-NCs的最大激发波长为388 nm,最大发射波长为453 nm。
DSC-NCs红外光谱结果如图2-g所示,在3426、2922、1634、1034 cm-1处出现了特征峰,其中3426 cm-1的吸收峰提示可能存在-O-H键,2922 cm-1处的吸收峰提示为-CH2-的伸缩振动峰,这是亚甲基的特征峰,1634 cm-1的强吸收峰为-C=O键的伸缩振动峰,1384 cm-1的强而尖锐的吸收峰提示可能为-OH的面内弯曲振动峰,1034 cm-1处的吸收峰提示可能含有-C-O-C-键。这表明经过炭化产生的DSC-NCs表面存在羟基、羧基和氨基等功能基团[17]。
通过XPS对DSC-NCs的元素组成和基团连接方式进行了表征。具体测定结果如图3所示,图3-a中284.85、399.99、531.98 eV的位置有明显的峰,表明DSC-NCs主要由C(72.84%)、O(22.3%)元素和少量的N(4.86%)元素共同组成,从图中峰值可以看出,C和O的元素含量最多,高达95.14%。在DSC-NCs高分辨XPS图谱中,图3-b C1s谱带中,显示出284.71、285.77、288.23 eV 3个峰,与之相对应的键分别是C-N、C=O、C-O。在图3-c的N1s谱带中,显示出399.62、400.32 eV 2个峰,与之相对应的键分别是C-N、N-H。在图3-d的O1s谱带中,显示出531.51、532.85 eV 2个峰,与之相对应的键分别是C-O、C=O[18]。

图3 利用XPS分析技术对DSC-NCs的表面基团和元素组成信息进行分析Fig.3 Surface composition and elemental analysis of DSC-NCs by XPS
从以上图谱特征数据的结果来看,分析解读了DSC-NCs的主要元素组成和含量,得知其配位情况,证实了DSC-NCs除了C、O元素外,还被N与其他元素少量掺杂,并且推测有多种官能集团共同存在于DSC-NCs的表面。
2.4 荧光量子产率(fluorescence quantum yield,FQY)测定
FQY也称荧光量子效率,它是表示一种物质荧光特性的重要参数[12]。本实验中测定的结果为DSCNCs的相对FQY,参比物质选择硫酸奎宁。荧光光谱扫描时激发波长与发射波长的狭缝宽度皆为10 nm。根据公式FQYNCs=FQYRINCsARηNCs2/(IRANCsηR2)对DSC-NCs的FQY进行计算,公式中I为发射光谱下的峰面积,A为365 nm时的吸光度值,η为溶剂的折射率,下标NCs和R代表DSC-NCs和参照物。为了使重吸收效应最小化,AR和ANCs的吸光度值应该保证在0.05以下[13]。以硫酸奎宁作为标准物进行DSC-NCs的荧光量子产率测,最终计算得出DSC-NCs的荧光量子产率为17.31%。
2.5 CCK-8实验
2.5.1 实验设计 安全性是其生物应用过程中需要考虑的问题之一,本实验以人肺癌A549细胞为研究对象,利用CCK-8实验来评价DSC-NCs对A549细胞的毒性大小[14]。将培养好的A549细胞悬液稀释至1×105个/mL,置于96孔板上。在四周边缘缓慢加入PBS缓冲液(100 µL/mL),将其放入CO2细胞培养箱进行孵育,条件设置为5% CO2、37 ℃,时间为24 h。之后弃去上清液,在对照组加入McCoy’s 5A培养基,在给药组依次加入已配制好的8种不同质量浓度(1000.00、500.00、250.00、125.00、62.50、31.25、15.63、7.81 μg/mL)的DSC-NCs溶液,每孔100 µL,再次放入CO2培养箱孵育24 h。取出上述96孔细胞培养板,加入CCK-8试剂(10µL/孔),继而放入CO2培养箱,4 h后取出。将其放于酶标仪中进行检测,波长450 nm,记录吸光度(A)值,计算细胞存活率。
细胞存活率=(Ae-Ab)/(Ac-Ab)
Ae为给药组的吸光度,Ac为对照组吸光度,Ab为空白组吸光度
2.5.2 统计学分析 实验数据采用SPSS 25.0统计软件分析,结果以表示。统计学处理采用方差分析。单因素 ANOVA分析方法用于实验数据服从正态分布,同时方差齐。组间差异则运用LSD方法统计。
2.5.3 实验结果 结果如表1所示,当DSC-NCs的质量浓度为500.00 μg/mL和7.81 μg/mL时,其细胞存活率和对照组近似。当DSC-NCs的质量浓度大于500.00 μg/mL时,细胞存活率降低,说明DSCNCs在给药质量浓度高于500.00 μg/mL对A549细胞存在一定的毒性。当DSC-NCs的质量浓度在7.81~500.00 μg/mL,对A549细胞具有一定的促进增殖作用,而质量浓度在7.81~125.00 μg/mL,随着DSC-NCs质量浓度的升高,增殖作用逐渐增强,质量浓度在125.00 μg/mL时,增殖作用达到最强,其后在125.00~500.00 μg/mL,随着质量浓度的升高,增殖作用反而逐渐降低。以上实验结果为今后DSC-NCs在临床上的应用剂量提供了一定的参考。
表1 不同质量浓度的DSC-NCs对A549细胞存活率的影响 ( , n = 6)Table 1 Effect of different concentrations of DSC-NCs on viability of A549 cells ( , n = 6)
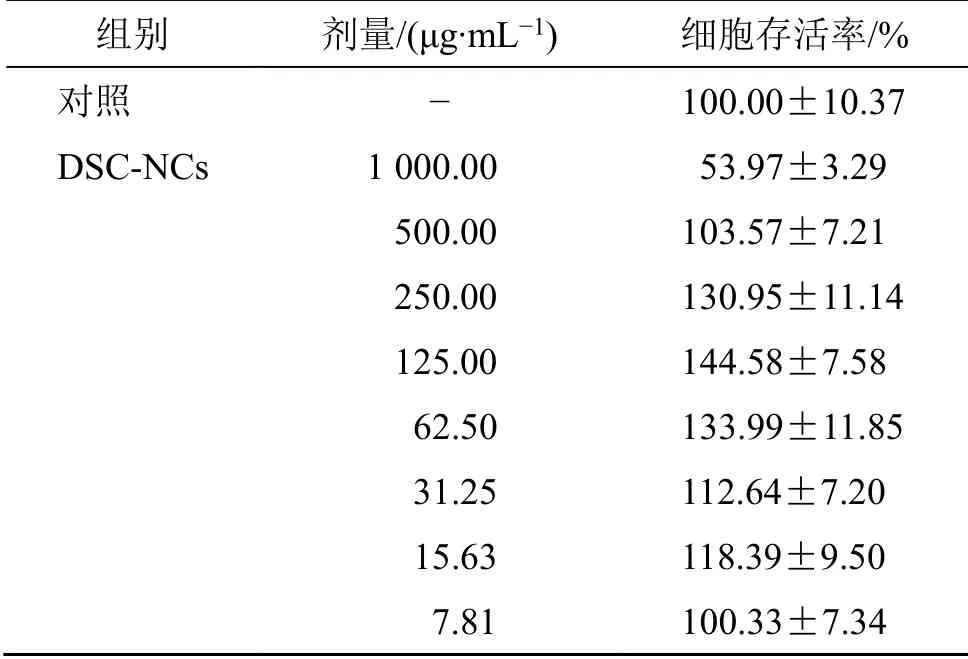
表1 不同质量浓度的DSC-NCs对A549细胞存活率的影响 ( , n = 6)Table 1 Effect of different concentrations of DSC-NCs on viability of A549 cells ( , n = 6)
组别 剂量/(μg·mL-1) 细胞存活率/%对照 - 100.00±10.37 DSC-NCs 1 000.00 53.97±3.29 500.00 103.57±7.21 250.00 130.95±11.14 125.00 144.58±7.58 62.50 133.99±11.85 31.25 112.64±7.20 15.63 118.39±9.50 7.81 100.33±7.34
2.6 DSC-NCs对脂多糖致大鼠ALI的作用研究
2.6.1 实验分组、给药和造模 将48只SD大鼠,随机分为6组,每组8只,分别为对照组、模型组、阳性对照组(地塞米松,5 mg/kg)和DSC-NCs高剂量组(3.33 mg/kg)、中剂量组(1.67 mg/kg)、低剂量组(0.84 mg/kg)。适应饲养环境后,DSC-NCs高、中、低剂量组连续10 d ip给药,其他组均ip相同体积的生理盐水。阳性对照组在造模前1 h ip地塞米松溶液,1 h后,除对照组ip等体积生理盐水外,其余各组均ip制备的脂多糖溶液(5 mg/kg)进行造模。
2.6.2 病理切片观察 造模8 h后,用4%水合氯醛(0.40 g/kg)麻醉大鼠后进行解剖,将大鼠左肺组织取出置于10%组织固定液中固定48 h以上,脱水,石蜡包埋,切片,苏木精和伊红(H&E)染色。比较对照组,模型组,地塞米松组和DSC-NCs高、中、低剂量组肺部的形态学变化。各组肺组织的病理形态结果如图4所示,图4-a显示对照组的肺组织结构正常,肺泡的形态完整,肺间质结构清晰,肺泡内无炎性细胞浸润;与对照组比较,模型组的肺组织结构破坏较为严重,明显可见肺泡壁增厚、肺间质充血,肺泡腔内有大量炎症细胞浸润(图4-b);与模型组比较,地塞米松组中肺泡形态较为完整,肺泡腔及肺间质炎性细胞浸润状态较模型组明显减轻(图4-c);与模型组比较,给予不同剂量的DSC-NCs治疗后,肺组织破坏程度、炎性细胞浸润和充血程度得到有效的缓解和不同程度的改善(图4-d~f),其中高剂量组的效果最为明显,具有一定的量效关系。
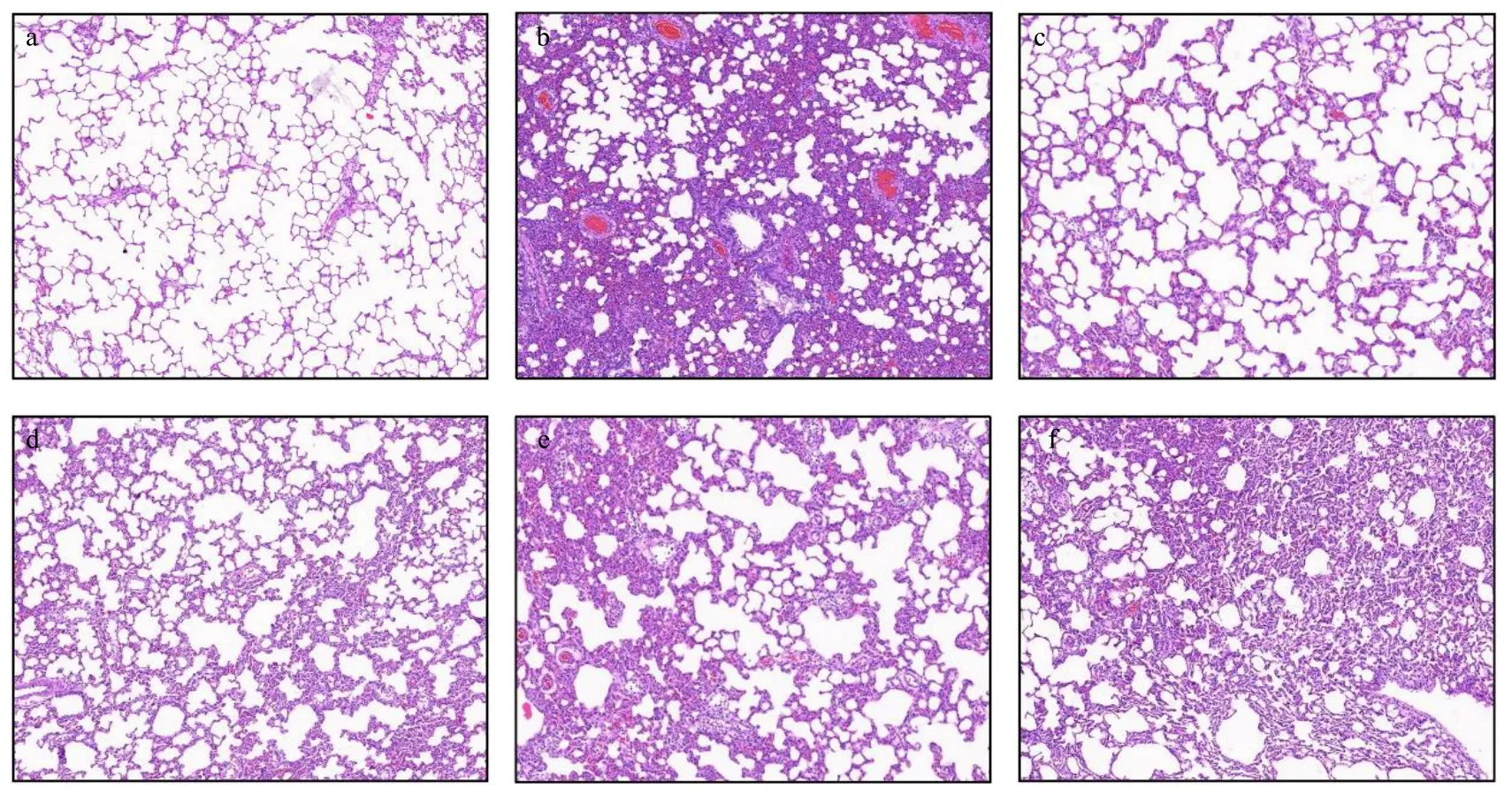
图4 DSC-NCs对LPS致大鼠ALI肺组织病理改变的影响 (×50)Fig.4 Effect of DSC-NCs on pathological changes of lung tissue in rats with ALI induced by LPS (× 50)
2.6.3 血清中细胞因子水平 造模8 h后,用4%水合氯醛(0.40 g/kg)麻醉大鼠。使用采血针和真空采血管,经腹主动脉采集大鼠血液。将采集好的大鼠血液置于室温环境下,静置60 min,然后放入高速冰冻离心机中以3000 r/min的转速离心15 min,获取上清液,于-80 ℃保存,留置待用。按照试剂盒的指导说明进行操作,分别测定血清中IL-6、IL-1β和TNF-α的水平。IL-6、IL-1β和TNF-α是急性炎症的重要炎症因子,各组大鼠血清中IL-1β的含量比较如表2所示,与对照组比较,模型组血清中IL-1β水平明显升高(P<0.01)。与模型组相比较,地塞米松组和DSC-NCs高、中、低剂量组均可以明显降低大鼠血清中IL-1β的水平,差异具有统计学意义(P<0.01)。其中DSC-NCs高剂量组低于地塞米松组,说明DSC-NCs高剂量组的治疗作用较强于阳性药。而随着DSC-NCs的剂量降低,血清中IL-1β水平升高,存在明显量效差异。DSC-NCs对大鼠血清中IL-6的含量与IL-1β类似,与对照组相比,模型组血清中IL-6水平显著升高(P<0.01)。与模型组相比,地塞米松组和DSC-NCs高、中、低剂量组均能明显降低血清中IL-6水平(P<0.01),其中以地塞米松组和DSC-NCs高剂量组的治疗效果较优。
表2 DSC-NCs对LPS致大鼠ALI血清中IL-1β、IL-6和TNF-α的影响 ( , n = 8)Table 2 Effect of DSC-NCs on IL-1β, IL-6 and TNF-α in serum of rats with acute lung injury induced by LPS (,n = 8)
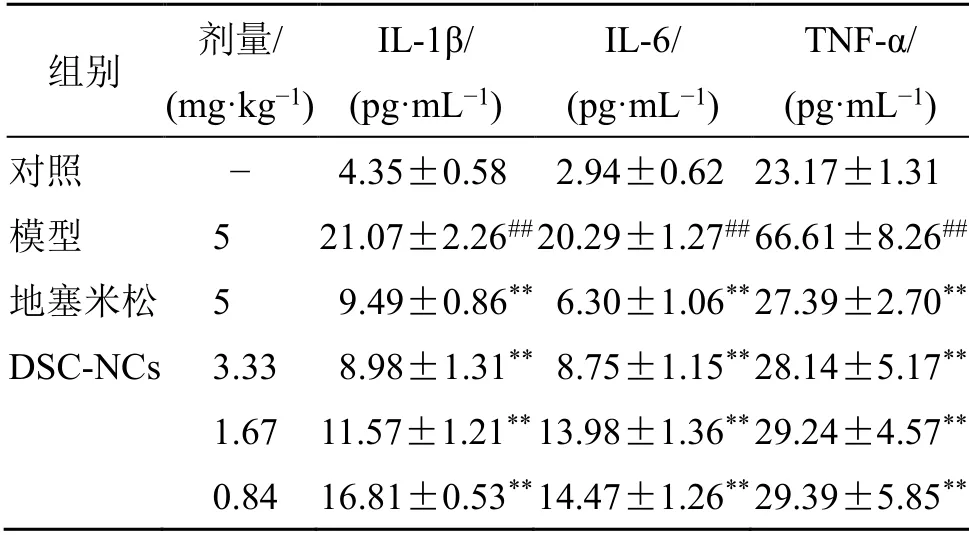
表2 DSC-NCs对LPS致大鼠ALI血清中IL-1β、IL-6和TNF-α的影响 ( , n = 8)Table 2 Effect of DSC-NCs on IL-1β, IL-6 and TNF-α in serum of rats with acute lung injury induced by LPS (,n = 8)
与对照组比较:##P<0.01;与模型组比较:**P<0.01##P < 0.01 vs control group; **P < 0.01 vs model group
组别 剂量/(mg·kg-1)IL-1β/(pg·mL-1)IL-6/(pg·mL-1)TNF-α/(pg·mL-1)对照 - 4.35±0.58 2.94±0.62 23.17±1.31模型 5 21.07±2.26## 20.29±1.27## 66.61±8.26##地塞米松 5 9.49±0.86** 6.30±1.06** 27.39±2.70**DSC-NCs 3.33 8.98±1.31** 8.75±1.15** 28.14±5.17**1.67 11.57±1.21** 13.98±1.36** 29.24±4.57**0.84 16.81±0.53** 14.47±1.26** 29.39±5.85**
各组大鼠血清中TNF-α的含量比较如表2所示,与对照组相比,模型组血清中TNF-α水平明显升高,具有显著的差异性(P<0.01)。与模型组相比,地塞米松组和DSC-NCs高、中、低剂量组均能明显降低大鼠血清TNF-α水平(P<0.01),4者之间的差异并不明显。
综上所述,DSC-NCs高、中、低剂量组均能明显降低大鼠血清中的TNF-α、IL-6、IL-1β的水平,表明DSC-NCs能够抑制炎症细胞因子的分泌,而起到减轻肺损伤的作用。
2.6.4 抗氧化水平 取出小鼠的右肺,用滤纸将分离出的肺组织水分吸干,取一部分后使用电子天平进行精确称定,将称好的肺组织放入10 mL EP管中,按照质量体积比为1∶9加入生理盐水制备成10%的组织匀浆,然后加入研磨球,使用冷冻混合球磨仪进行研磨,最后使用高速冷冻离心机(3000 r/min,10 min)进行离心,获取肺组织匀浆上清液,按照试剂盒的说明,测定SOD活性和丙二醛的水平。
氧化应激是ALI炎症发生发展的重要机制之一,通过进一步评估SOD活性和丙二醛的水平来表征氧化还原状态的变化。各组肺组织中SOD活性比较如表3所示,与对照组相比,模型组中SOD的活性明显降低(P<0.01),说明脂多糖诱导的ALI大鼠的肺组织发生了严重的氧化损伤。与模型组相比,地塞米松组和DSC-NCs高剂量组均能明显升高肺组织中SOD的活性(P<0.01),明显提高了机体的抗氧化能力,DSC-NCs中剂量组也能提高肺组织中SOD的活性,差异具有统计学意义(P<0.05),而DSC-NCs低剂量组与模型组比较没有明显差异。
各组肺组织中的丙二醛水平比较如表3所示,与对照组相比,模型组肺组织中丙二醛含量明显升高,说明肺组织受损严重。与模型组相比,地塞米松组和DSC-NCs高、中、低剂量组肺组织中丙二醛的含量均明显降低,差异具有统计学意义(P<0.01)。以上实验结果表明,DSC-NCs能够通过提高抗氧化能力和降低氧自由基的产生来减轻过度氧化应激对肺脏的损伤作用。
表3 DSC-NCs对LPS致大鼠ALI肺组织中SOD活性和MDA水平的影响 ( , n = 8)Table 3 Effect of DSC-NCs on SOD activity and level of MDA in lung tissue of rats with ALI induced by LPS ( ,n = 8)

表3 DSC-NCs对LPS致大鼠ALI肺组织中SOD活性和MDA水平的影响 ( , n = 8)Table 3 Effect of DSC-NCs on SOD activity and level of MDA in lung tissue of rats with ALI induced by LPS ( ,n = 8)
与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01##P < 0.01 vs control group; *P < 0.05 **P < 0.01 vs model group
组别 剂量/(mg·kg-1) SOD/(U·mg-1) MDA/(nmol·mg-1)对照 - 149.33±18.32 3.83±0.14模型 5 71.98±9.15## 6.39±0.12##地塞米松 5 139.33±11.61** 4.59±0.27**DSC-NCs 3.33 128.83±9.37** 4.81±0.75**1.67 95.21±11.72* 4.95±0.61**0.84 85.16±29.71 5.17±0.63**
3 讨论
本实验通过一系列成熟的制备工艺来获取葶苈子炭化物纯化后的透析液,经TEM、HR-TEM、荧光光谱、FTIR、XPS等仪器鉴定并命名为DSC-NCs。DSC-NCs外观形貌近球形,分散度良好,粒径大小均一,主要集中在2.5~6.5 nm,晶格间距为0.224 nm。XPS分析显示DSC-NCs中含有C、O、N等元素,其中C、O元素占主导地位,结合红外光谱可以发现葶苈子炭纳米类成分表面官能团丰富,含有大量的羟基、羧基等基团。
经过HPLC的观察对比,经过透析后的DSCNCs溶液中观察不到小分子的存在,在一定程度上排除了小分子化合物的干扰。此外,本实验利用CCK-8法测定了DSC-NCs的安全性范围在500 μg/mL以内,生物安全性高。
ALI是一系列炎症反应和继发性弥漫性肺实质损伤,涉及多种炎症介质和效应细胞,其发病原因多样,其中由脂多糖引起的占大多数,可引起炎症反应和氧化应激导致肺损伤,是用于评价药物对ALI作用的经典模型[19]。从本实验的肺组织切片来看,模型大鼠在给予不同剂量的DSC-NCs治疗后,肺组织破坏程度和炎性细胞浸润状态得到有效的缓解和不同程度的改善,说明DSC-NCs具有治疗ALI的作用。
在ALI的形成过程中涉及到多方面的作用结果,单核-巨噬细胞和嗜中性粒细胞在受到外界刺激后聚集到肺泡腔,产生大量细胞因子,传递炎症信号,通过级联放大反应促进炎症的发展,导致肺部损伤[20]。TNF-α是最早参与ALI发病过程的炎症因子,主要是由LPS刺激肺泡-巨噬细胞后生成,除了直接破坏内皮细胞,还能刺激邻近细胞释放更多的炎症因子,进而介导中性粒细胞和巨噬细胞的招募[21]。此外,TNF-α还能诱导免疫细胞转移、增加血管通透性以及影响肺水肿的形成,导致低氧血症,从而进一步加重肺损伤。IL-1β是固有免疫和炎性反应的主要调节因子,诱导中性粒细胞迅速聚集到肺部,引起炎症介质释放,加重炎症损伤,因此IL-1β的表达水平也是反映ALI严重程度的经典指标[22]。IL-6主要来源于单核-巨噬细胞,其能促进炎症发展,影响巨噬细胞的生长和分化,大量的IL-6还会促进血管活性物质和中性粒细胞的释放,脂多糖作用于机体后,能够检测到IL-6的水平有所升高,是检测ALI的指标之一[23]。本实验研究结果显示,DSC-NCs高、中、低剂量组均能明显降低大鼠血清中的TNF-α、IL-1β、IL-6的水平,表明DSC- NCs能够在一定程度上抑制炎症细胞因子的分泌,从而起到减轻肺损伤的作用。
大量研究[24]表明,氧化应激损伤是ALI发病的重要机制,能够使细胞内活性氧显著增加,引发脂质过氧化,就会不断大量形成新的自由基,造成肺组织损伤。SOD是一种重要的抗氧化酶,对机体的氧化和抗氧化系统平衡起重要作用,其活性高低反映了机体抗氧化能力的大小[25]。过量的活性氧会诱导脂质过氧化,从而产生丙二醛,因而能够作为反映脂质过氧化严重程度的标志物[26]。相关研究[27]表明葶苈子生药能有效改善ALI引起的肺淤血、肺水肿以及炎细胞浸润程度,其机制可能与发挥药效的小分子物质能够调节水通道蛋白5的含量有关;本实验证明了从葶苈子炭中提取分离的DSC-NCs也能有效缓解ALI大鼠肺泡腔及肺间质中的炎性细胞浸润程度,改善肺水肿,尤其以高剂量组的作用更显著,其机制可能与升高SOD的活性、减少丙二醛的含量有关,能够通过提高抗氧化能力和降低氧自由基的产生来减轻过度氧化应激对肺脏的损伤作用。但本实验尚未从相关信号通路的水平上去研究DSC-NCs发挥药效的内在机制,仍是今后重点研究的方向之一。因此,本实验中DSC-NCs的发现及其治疗脂多糖致ALI的证明,不仅为葶苈子炭的活性成分提供了一个新的研究方向,也为DSC-NCs作为一种治疗ALI的新型药物研发奠定了坚实的实验基础。
本实验利用高温热解法成功从葶苈子炭中提取分离出新型纳米类成分DSC-NCs。在脂多糖致大鼠ALI模型中,表面携带丰富基团的DSC-NCs起到了明显的保护作用,其发挥作用的机制初步证明是与减少IL-6、IL-1β和TNF-α等炎症细胞因子水平有关,也可以在一定程度上减少肺部的炎症,增强机体的抗氧化活性。本研究为DSC-NCs在临床抗肺炎中的应用提供了重要依据,为DSC-NCs的研发奠定了实验基础。
利益冲突所有作者均声明不存在利益冲突

