二氧化硅染尘小鼠肺纤维化相关炎症和氧化应激因子的响应及关键基因表达
吕达,杨慧楠,刘春城,b,王乐,赵宏宇,b,蔡禄,b
内蒙古科技大学 a.生命科学与技术学院 b.内蒙古自治区功能基因组生物信息学重点实验室,内蒙古 包头 014010
尘肺病是因为患者长期接触生产性粉尘,呼吸系统的清除和防御机制受到损害,进而引起肺组织纤维化[1]。目前尘肺病发病机制尚未解释清楚,所以一旦确诊,临床上没有根治的方法[2]。
有研究表明,尘肺病发病与炎症反应等免疫响应具有密切的关系[3]。二氧化硅(SiO2)进入肺部首先作用于上皮细胞和内皮细胞等,促使这些细胞释放炎症介质,引起血小板聚集,促进血管扩张和增加血管渗透性,使炎症细胞聚集到损伤部位[4]。在尘肺病发病初期和发病末期均有巨噬细胞诱发炎症反应。巨噬细胞能够合成并且释放肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6 等炎症因子。随着炎症的发展,肺泡上皮细胞和巨噬细胞释放促纤维化和转化生长因子-β(transforming growth factor-β,TGF-β)。TGF-β具有多种功能,通过刺激成纤维细胞以及肌成纤维细胞分泌胶原等细胞外基质以及调控蛋白多糖的表达参与尘肺病的发病过程[5]。
氧化应激反应在纤维化发生发展阶段扮演了非常重要的角色[6]。人类肺组织相较于其他器官暴露于更高浓度的氧环境中,更容易受到氧化应激的损伤。当体内活性氧(reactive oxygen species,ROS)产生过多或抗氧化能力不足时,过量的ROS 存在于组织或细胞内,可以诱发氧化应激,将导致肺组织的损伤。Matsuzawa 等[7]通过检测血清氧化应激标志物,得出了纤维化进展过程中存在氧化/抗氧化失衡的结论。氧化应激可以通过刺激相关基因表达来调节细胞生长、增殖和死亡,进而促进肺纤维化。
肺组织中胶原纤维的生成与聚集是尘肺病的标志[8]。细胞外基质的沉积和纤维灶的形成是肺纤维化的标志性特征。I型胶原和α-平滑肌动蛋白(α-smooth muscle actin,α-SMA)是肺内细胞外基质中的重要成分和特征性标志物。纤维灶主要是由活化的肌成纤维细胞组成,肌成纤维细胞能够合成胶原、α-SMA 等细胞外基质的主要成分。有研究人员通过对间质性肺炎活检分析发现,上皮细胞死亡后,肺泡表面基底膜脱落,在成纤维细胞和肌成纤维细胞等间充质细胞中会大量合成新的细胞外基质,从而加速肺部纤维化[9]。
目前,同时从炎症反应、氧化应激反应以及胶原沉积三个方面综合研究粉尘颗粒导致肺纤维化的工作较少,而这对于理解尘肺病的致病机理具有重要的意义。鉴于此,本研究拟对染尘后的小鼠进行为期56 d 的实验,在此期间对不同染尘时间的小鼠样本进行病理学研究,同时测定炎症因子、氧化应激因子以及胶原形成相关的基因mRNA 的表达量,为尘肺病的发病机制研究提供一定的依据。
1 对象与方法
1.1 实验动物
SPF 级C57BL/6 小鼠购自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010;动物饲养温度控制在25℃左右,空气湿度50%~60%,光照时间昼夜交替各12 h;适应饲养7 d 后进行实验,动物实验经内蒙古科技大学实验动物管理委员会审查批准,审批号为NMGKJDX-2017-03。
1.2 仪器与试剂
1.2.1 主要仪器Nanodrop 2000 紫外分光光度计(Thermo Fisher 科技公司,美国),Eclipse Ti-U 荧光倒置显微镜(尼康株式会社,日本),Synergy HT 多功能酶标仪(美国伯腾仪器有限公司,美国),实时荧光定量 PCR 仪(Bio-Rad 公司,美国)。
1.2.2 主要试剂TNF-α、TGF-β、成纤维生长因子(fibroblast growth factor,FGF)、超氧化物歧化酶(superoxide dismutase,SOD)、ROS、丙二醛(malondialdehyde,MDA)的酶免试剂盒(江苏南京晶美生物科技有限公司,中国);苏木素-伊红染色(haematoxylin-eosin,HE)染色试剂盒、Masson 染色试剂盒、羟脯氨酸(北京索莱宝有限公司,中国);直径1~5 μm 的SiO2粉末(Sigma公司,美国);总RNA 提取试剂(RNAiso Plus)、反转录试剂盒(Prime ScpriptTMRT reagent Kit with gDNA Eraser)、实时荧光定量PCR试剂盒(TB GreenTMPremix EX TaqTMⅡ,TaKaRa 公司,日本);Col1a2基因和α-SMA基因扩增引物(苏州金维智公司,中国),其他试剂(分析纯,国药集团,中国)。
1.3 实验方法
1.3.1 构建小鼠模型根据前期实验结果设定染尘剂量。将35只SPF级C57BL/6小鼠(雄性、体重约20~25 g、8~10 周)随机分成空白对照组(5 只)、生理盐水对照组(10只)、20 g·L-1SiO2染尘组(10 只)、60 g·L-1SiO2染尘组(10 只)共4 组。采用非气管暴露法构建小鼠模型,每只小鼠灌注SiO2的量为50 mg·kg-1和150 mg·kg-1(以小鼠体重计),用无菌的生理盐水配制20 g·L-1和60 g·L-1的SiO2悬浊液,按照小鼠体重灌注不同体积的SiO2悬浊液[8-9]。分别于第0天和第14天进行二次灌注。
1.3.2 样本采集空白对照组全部在第28天处死,其余各组小鼠分别于第28 天和第56 天处死。用剪刀镊子剪开胸腔,分离出肺组织,然后用生理盐水将肺组织冲洗干净,滤纸拭干。将左肺叶剪下浸泡在4%(体积分数,后同)的多聚甲醛溶液。
1.3.3 HE 与Masson 染色将小鼠肺组织浸泡在4%的多聚甲醛固定液中24 h 后进行脱水、石蜡包埋、切片操作,然后按照索莱宝HE 染色和Masson 染色步骤进行染色操作,将染好色的切片放到光学显微镜下观察,拍照记录并比较不同样本间的差异。
1.3.4 肺组织TGF-β、TNF-α、FGF测定采用ELISA法测定,TGF-β 和FGF 的检出限为0.337 5 ng·g-1,TNF-α 的检出限为0.27 ng·g-1。首先将肺组织切成小块,加入适量pH为7.4的磷酸盐缓冲液。用匀浆器将样本研磨充分,3 000 r·min-1(离心半径10 cm)离心20 min,收集上清液待测。检测过程按照试剂盒标准步骤进行,结果以每克湿肺组织中含上述因子的质量分数(后称含量)表示。
1.3.5 血清中SOD、ROS、MDA测定采用ELISA测定血清中SOD、ROS、MDA,SOD 检出限为0.105 μg·L-1,ROS检出限为0.3 U·L-1,MDA 的检出限为0.03 μmol·L-1。小鼠眼球取血,室温血液自然凝固20 min,2 500 r·min-1(离心半径10 cm)离心20 min,收集到的上清液即为血清。检测过程按照试剂盒标准步骤进行。
1.3.6 羟脯氨酸含量检测称取约20 mg 肺组织于消解管中,按照200 μL∶20 mg(盐酸:肺组织)的比例加入6 mol·L-1盐酸,煮沸3 h后16 000 r·min-1(离心半径10 cm)离心20 min,然后用10 mol·L-1的氢氧化钠溶液中和至pH值为7,加蒸馏水定容至400 μL,用分光光度计在560 nm波长下测得光密度(D)值代入标准曲线中计算每克湿肺组织含羟脯氨酸的质量分数(后称含量)。
1.3.7 Col1a2 基因和α-SMA 基因表达检测将小鼠肺组织用液氮研磨充分加入1 mL TaKaRa 公司的RNAiso Plus,然后按照总RNA 提取试剂的说明书步骤进行RNA 提取,分光光度计检测所得到的总RNA 浓度和纯度,再按反转录试剂盒步骤将RNA 反转录为cDNA链,以cDNA 链作为模板链,GAPDH基因为内参基因进行扩增。扩增反应程序设定为:95℃ 30 s;95℃ 5 s,57℃ 34 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。以基因GAPDH为内参,以生理盐水对照组为基准,通过处理组目的基因与内参基因的Ct差值(∆Ct处理)减去对照组目的基因与内参基因的Ct差值(∆Ct对照),得出∆∆Ct,然后以2-∆∆Ct值计算目的基因mRNA表达相对量。引物序列见表1。

表1 RT-PCR 分析的引物序列Table 1 RT-PCR primer sequences
1.4 统计学分析
采用SPSS 19.0 进行分析,使用±s描述,组间差异采用单因素方差分析和LSD检验。检验水准α=0.05。
2 结果
2.1 小鼠肺组织形态学变化
光镜下观察HE 染色的切片结果(图1):生理盐水对照组组织结构完整,肺泡间隔均匀,无间质纤维组织增生。20 g·L-1和60 g·L-1两组小鼠染尘第28 天时,肺部结构被破坏,肺间质和肺泡内有大量的细胞浸润;当染尘到第56 天时,小鼠肺部炎性细胞有所减少,血管壁增厚,形成明显的纤维结节。
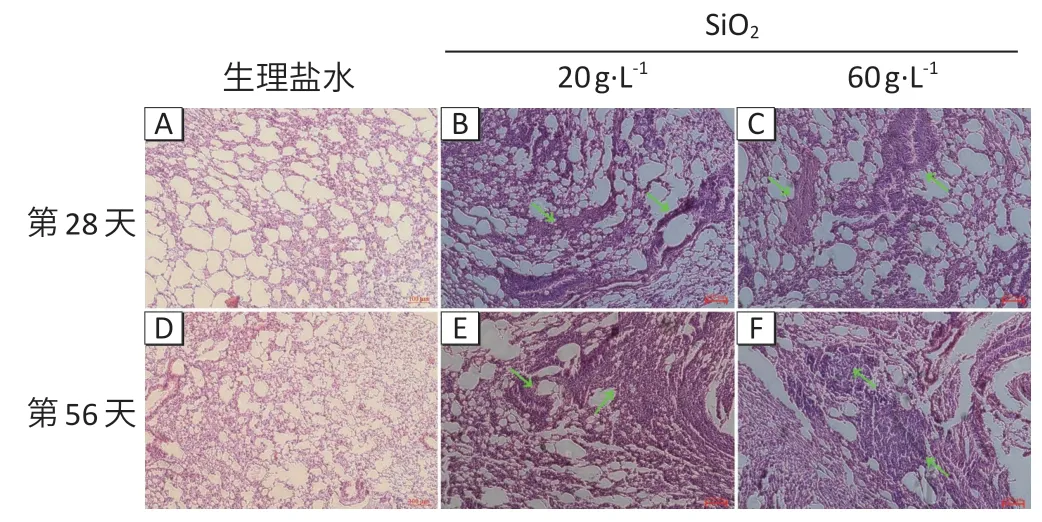
图1 小鼠肺组织HE染色结果Figure 1 HE staining results of lung tissues of mice
2.2 肺组织中炎症因子水平的变化
炎症因子检测结果显示(图2):空白对照组小鼠肺组织中,TGF-β、FGF 和TNF-α 含量分别是1.09、3.63、3.13 ng·g-1,与空白对照组相比,生理盐水组小鼠在第28 天和第56 天时肺组织中3 种炎症因子的含量均无明显变化(P>0.05);20 g·L-1和60 g·L-1染尘组小鼠在染尘至第56 天时,TGF-β、FGF、TNF-α 含量分别是3.42、3.62 ng·g-1,15.20、19.78 ng·g-1和9.02、11.30 ng·g-1,较生理盐水组均有增高,差异有统计学意义(P<0.01)。
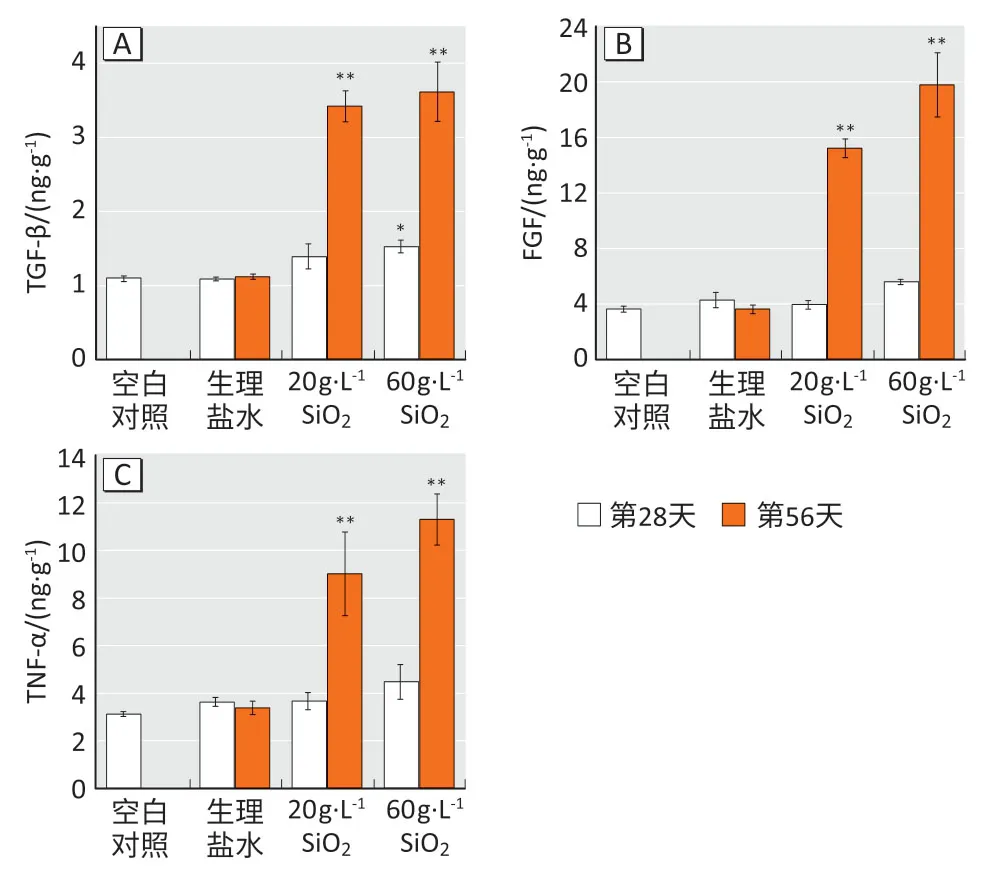
图2 小鼠肺组织炎症因子检测结果Figure 2 Inflammatory factor levels in lung tissues of mice
2.3 血清中氧化应激水平指标的变化
氧化应激因子检测结果显示(图3):空白对照组小鼠血清中,MDA、ROS 和SOD 的水平分别是0.19 μmol·L-1、7 U·L-1和0.58 μg·L-1;与空白对照组相比,在第28、56天时生理盐水组小鼠血清中上述3种因子水平均无明显变化(P>0.05);20 g·L-1染尘组小鼠在染尘第28、56天时,MDA浓度为0.23、0.26 μmol·L-1,ROS水平均为11、11 U·L-1,SOD质量浓度为0.43、0.44 μg·L-1;60 g·L-1染尘组小鼠在染尘第28、56 天时,MDA 浓度为0.28、0.34 μmol·L-1,ROS 水平为13、14 U·L-1,SOD 质量浓度为0.38、0.36 μg·L-1;在染尘第28、56 天时,两个染尘组小鼠血清中MDA、ROS 水平增加,SOD 水平下降,与生理盐水组相比差异均有统计学意义(P<0.05)。
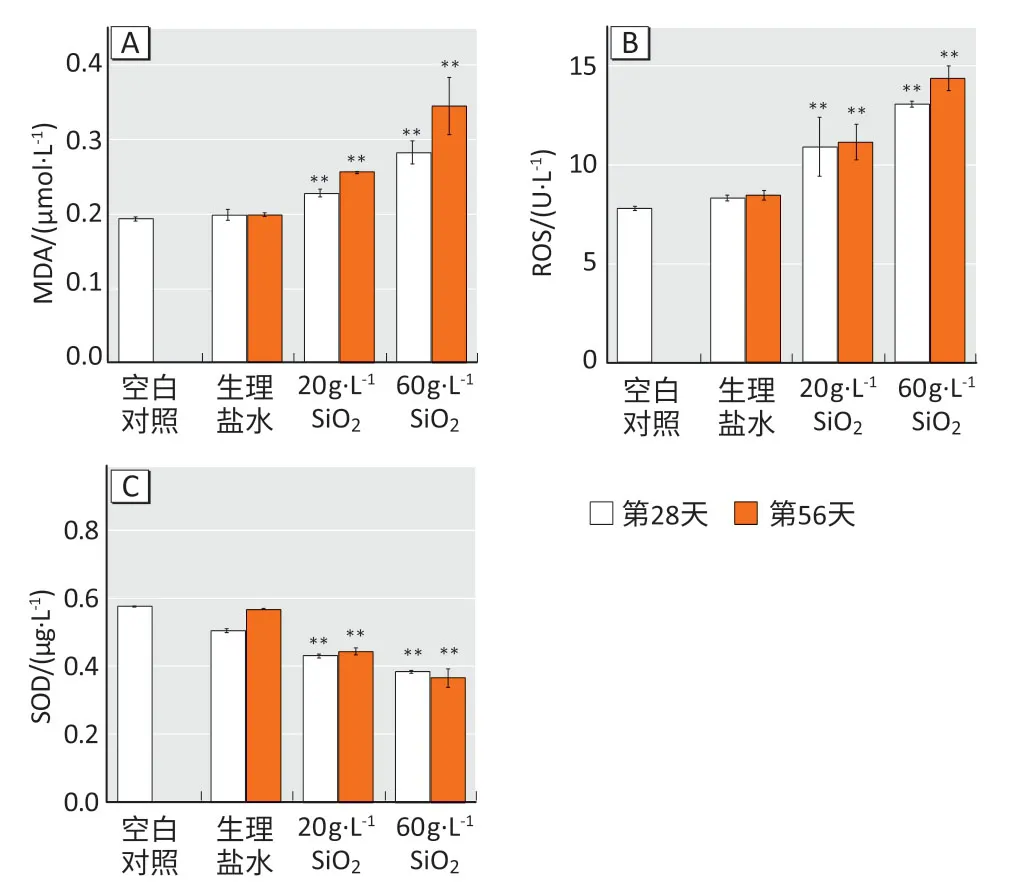
图3 小鼠血清中氧化应激因子检测结果Figure 3 Oxidative stress factor levels in serum of mice
2.4 肺组织中胶原含量的变化
如图4所示:在第28、56 天时,生理盐水组小鼠肺组织羟脯氨酸含量均为0.15 mg·g-1,与空白对照组(0.12 mg·g-1)相比无差异(P>0.05);在染尘第28、56 天时,20 g·L-1染尘组小鼠,羟脯氨酸含量为0.25、0.28 mg·g-1;60 g·L-1染尘组为0.32、0.43 mg·g-1,较生理盐水对照组增加,差异有统计学意义(P<0.05)。如图5所示:Masson 染色可将胶原纤维染成蓝色,肌纤维染成红色,随着纤维化进程加重,胶原纤维累积;生理盐水组有少量蓝色,SiO2染尘组明显比生理盐水组蓝色范围更加广阔。通过检测基因表达量可知(图6):相较于生理盐水组,60 g·L-1染尘组小鼠在第28 天时,Col1a2和α-SMA基因表达量分别上升至1.62倍和2.05倍;在第56天时,上升至3.08倍和3.34倍。

图4 小鼠肺组织中羟脯氨酸含量检测结果Figure 4 Hydroxyproline levels in lung tissues of mice
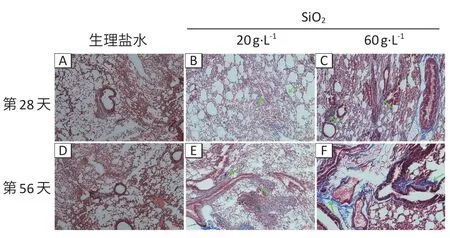
图5 小鼠肺组织Masson染色结果Figure 5 Masson staining results of lung tissues of mice
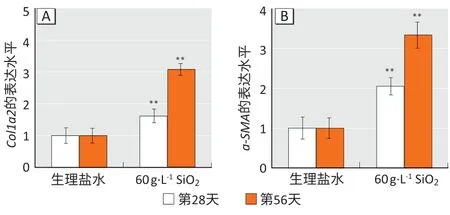
图6 肺组织中Col1a2(A)和α-SMA(B)基因mRNA表达水平Figure 6 mRNA expression levels of Col1a2 (A) and α-SMA (B)in lung tissues of mice
3 讨论
本研究的结果表明,在小鼠染尘后肺组织出现了纤维化的特征。染尘组小鼠肺组织中出现了血管壁增厚现象,肺部形成了纤维结节;随着染尘时间的延长,炎症因子和氧化应激因子的含量出现不同程度的增加;羟脯氨酸含量的增加表明肺组织中积累过量SiO2后可导致肺部胶原纤维增多;α-SMA和Col1a2基因表达水平明显升高,Masson 染色显示染尘组的小鼠肺组织中染蓝区域增多,同样说明肺组织中出现了胶原纤维增多的现象。以上结果可以看出,小鼠肺内SiO2染尘可导致肺组织出现纤维化的症状。
本实验研究结果显示,小鼠染尘进行到第56 天时,TGF-β、TNF-α、FGF 含量均随着SiO2浓度增加而增加,说明SiO2在小鼠肺部沉积能够引发明显的炎症反应;而染尘至第28 天时,仅有高浓度染尘组小鼠TGF-β 略有升高。有研究显示尘肺病患者在病理学上的最初表现为肺泡炎症,此时大量炎性细胞向肺内浸润活化,释放多种具有生物活性的细胞因子[10];也有研究将尘肺病的发展过程分为正常期、炎症期、进展期和纤维化期四个时期[11]。在本实验小鼠染尘至第28 天时可能正处于纤维化的诱发阶段,故而出现上述结果。从实验结果可判断染尘至第56 天时小鼠肺组织局部已经形成了纤维化,3 种细胞因子的含量均增加,说明这3 种因子在纤维化的形成过程中可能都发挥了重要的功能。有研究人员同样发现在SiO2染尘大鼠肺纤维化进程中TGF-β、TNF-α、FGF 等细胞因子水平明显增加[3]。这些结果均表明,炎症反应在尘肺病发生发展过程具有非常重要的作用,免疫响应分泌的炎症因子对后续肺纤维化可能起到了重要的促进效应。
除了炎症反应之外,氧化应激反应也参与了肺纤维化的过程[12]。本实验研究结果表明,当SiO2在肺部累积刺激肺组织产生氧化应激因子,ROS随着纤维化进程最高提升至近2倍;小鼠染尘后MDA提高到1.78倍,SOD 含量最多降低了38%。正常的肺稳态需要细胞内外氧化物和抗氧化物的平衡,自由基在尘肺病患者肺部积累引起自由基对机体长期、反复的损害,促进肺纤维化的形成[13]。有研究表明,小鼠血清中MDA 含量的升高加重了氧自由基对机体的损害;而SOD 水平随着染尘时间延长而降低,意味着小鼠肺组织纤维化程度加深,体内清除氧自由基能力减弱[14]。也是学者发现随着慢性阻塞性肺疾病患者病情的加重,机体中出现了氧化应激反应[15]。这些结果表明机体氧化应激失衡与肺纤维化的发生发展有着密切的关系。
本实验同时从Masson 染色、羟脯氨酸含量变化和α-SMA和Col1a2基因表达水平的角度表明了SiO2的刺激会促使肺组织中胶原累积导致肺纤维化。肺纤维化组织中胶原蛋白、弹性蛋白和纤维连接蛋白等成分的聚集会促使胶原纤维的形成[16]。也有研究表明,通过非气管暴露法灌注博来霉素可导致大鼠α-SMA的表达水平和胶原含量明显升高[14]。
本研究发现,随着染尘时间的延长,炎症反应更剧烈,氧化应激反应持续增强,胶原累积量逐渐增多,这些因素异常升高对肺纤维化的进程起到了促进作用。从这三个角度出发研究SiO2致肺纤维化的生物学效应,可为尘肺病致病机理的理解和后期治疗提供一定的参考价值。

