2种不同诱导方法体外诱导人多潜能干细胞分化成大脑基底内侧神经节隆起区神经前体细胞的差异
韩肖华,陈潞婷,2,李娟,李丹萍,陈红
许多神经系统疾病尤其是神经退行性疾病与不同类型的神经元损伤、减少、死亡有关。如阿尔茨海默病的认知功能障碍与基底前脑的胆碱能神经元有关[1]。随着细胞分化技术的发展,人多潜能干细胞包括人胚胎干细胞和人诱导多潜能干细胞已可以在体外被诱导分化为不同类型的特定神经元和胶质细胞,为神经系统疾病细胞移植治疗提供很好的细胞来源[2]。
内侧神经节隆起(medial ganglionic eminence,MGE)是胚胎发育时期腹侧前脑的一个结构,主要标志物为NKX2.1。研究发现敲除NKX2.1基因可造成基底前脑的CHAT神经元减少,进而导致海马θ节律的改变及学习记忆的严重缺失[3]。CHAT神经元是与认知功能息息相关的一类神经元,在体外分化主要来源于NKX2.1表达的MGE神经前体细胞[4]。目前,MGE的体外分化主要可得到的神经元类型为GABA神经元和CHAT神经元,可以作为治疗和改善学习记忆障碍相关疾病的细胞源。
本研究将对拟胚体(Embryo,EB)悬浮培养法和单层贴壁培养法这2种分化培养方案进行对比研究,以期更经济、有效地诱导人多潜能干细胞分化获得可供移植治疗的MGE区神经前体细胞。
1 材料与方法
1.1 主要试剂与材料
人胚胎干细胞系(H9,P25-55)由华中科技大学同济医学院附属同济医院康复医学科干细胞研究中心提供(美国威斯康星大学麦迪逊分校张素春教授实验室惠赠)。DMEM-F12培养基,N2、B27添加剂,Dispase,Accutase购自Gibco公司;bFGF购自R&D公司;DMH1,SB431542,SAG购自Selleck公司;XAV939购自Stemgent公司;BDNF,GDNF,IGF-1购自Peprotech公司;cAMP,PLO,Triton-X100购自Sigma-Aldrich公司;Laminin购自Invitrogen公司。驴血清购自武汉飞羿科技公司;Rabbit anti-NKX2.1一抗(1∶200~1∶500)购自Abcam公司;驴抗兔Alexa Fluor488(1∶500)购自Proteintech公司;DAPI购自Boster公司。
1.2 方法
1.2.1 人多潜能干细胞单层贴壁诱导法培养分化 复苏后的H9细胞于37℃,CO2培养箱培养。当细胞克隆长到整个孔的80%左右进行传代。加入含有SB431542(2μM),DMH1(2μM),XAV939(2μM)几种小分子的神经分化培养液进行重悬,按照1∶2或1∶3进行传代接种至MEF贴壁6孔板中进行细胞分化。隔天换液,直至分化第7天。在此过程中,当分化的细胞逐渐出现神经管状结构,并开始出现神经上皮细胞典型的玫瑰花环状后,加入含不同浓度的SAG(0.1μM、0.5μM、1μM、2μM、3μM)小分子诱导剂的神经分化培养液继续分化。隔天换液,直至分化第14天,当几乎所有的细胞团已经形成明显的玫瑰花环状结构后,加入含B27和SAG小分子的神经分化培养液进行重悬,接种到T25培养瓶中,移入37℃,CO2培养箱继续培养。第2天若可以观察到神经球的出现,则隔天换液,直至第20天。然后将神经球接种到PLO/Laminin包被过的24孔板中的玻片上,然后加入含有BDNF、GDNF、cAMP、IGF-1及SAG和B27等小分子添加物的神经元培养液,隔3天换液,之后观察神经球逐渐发出神经纤维,进而逐渐成熟为神经元。
1.2.2 人多潜能干细胞EB悬浮法培养分化 复苏后的H9细胞,于37℃,CO2培养箱培养。当细胞克隆长到整个孔的80%左右进行传代。消化下来的细胞转移至T25培养瓶中继续培养,至第2天即可观察到EB球的形成,每天换液至第4天。更换神经分化培养液,隔天换液至第7天。第7天将T25培养瓶中所有的EB球均匀铺在6孔板里,5~8 h后,可以看到大部分EB球均已贴壁。隔天换液,至第10天。此过程中观察到细胞团出现了神经管的形状,继而开始出现玫瑰花环状结构。再将培养基更换成含0.5μM SAG的神经分化培养液,隔天换液,至第16天,在此阶段可观察到大部分细胞团出现明显玫瑰花环状结构。再加入含B27和SAG小分子的神经分化培养液进行重悬,接种T25培养瓶中,移入37℃,CO2培养箱继续培养。次日即观察到有神经球的形成,隔天换液至第24天。后续分化方法同单层培养法。
1.2.3 细胞免疫荧光染色及计数 用4%多聚甲醛室温固定20 min,0.2%Triton-X100+10%驴血清室温下孵育1 h。加入Rabbit anti-NKX2.1(1∶200~1∶500)一抗在4℃下孵育,过夜。吸弃一抗工作液,加入驴抗兔Alexa Fluor488(1∶500)二抗室温下孵育45 min,注意避光操作。加入DAPI核染10 min。甘油封片,奥林巴斯荧光显微镜下观察,选用200×或400×倍镜下的视野拍照,用ImageJ软件进行免疫荧光染色细胞计数。每组至少3张细胞玻片,每张玻片随机选取5个视野,每组数据至少有3次独立重复数据。
1.3 统计学处理
采用SPSS 18.0软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用单因素方差分析,多组间两两对比采用LSD或Dunnett T3检验,P<0.05为差异有统计学意义。
2 结果
2.1 2种诱导方案不同分化阶段的神经细胞形态
在单层贴壁培养法中,分化早期加入TGF-β、BMP和WNT通路抑制剂SB431542、DMH1、XAV939等小分子促使人多潜能干细胞向神经外胚层发育,在分化第4天时可以观察到神经管的出现,在第7天时慢慢出现玫瑰花环状的形态。此时再加入SAG小分子促使细胞向腹侧发育,在第14天几乎所有的细胞团都呈现出典型的玫瑰花环状结构。将贴壁细胞悬浮成神经球的状态,促进细胞的维持诱导发育。在21天神经球贴壁后加入神经营养因子促进神经细胞成熟,贴壁后可以观察到神经细胞逐渐成熟,见图1。

图1 人多潜能干细胞单层诱导法分化
在EB培养法中,在第7天贴壁后,逐渐开始出现神经管的形态。在第10天加入SAG小分子,至第16天时观察到大部分的细胞团呈现出玫瑰花环状结构。之后在第25天时将贴壁细胞悬浮成神经球状态,在神经营养因子作用下逐渐分化为神经元,见图2。
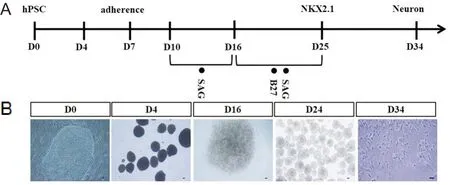
图2 人多潜能干细胞EB诱导法分化
2.2 不同浓度的SAG对MGE神经前体细胞的影响
本研究在单层贴壁培养法中采用了不同浓度的SAG进行诱导分化,获得MGE前体细胞进行免疫荧光染色,见图3A。NKX2.1阳性表达细胞计数结果显示,当SAG浓度为0μM、0.1μM、0.5μM、1μM、2μM和3μM时,NKX2.1阳性细胞率分别为0%、(48.3±11.5)%、(78.6±2.7)%、(77.6±4.0)%、(69.0±7.5)%和(67.7±7.9)%;SAG浓度为0.5μM和1μM时诱导分化获得的MGE神经前体细胞纯度显著高于其他浓度组(与0.1μMSAG相比,P<0.001;与2μM和3μM相比,P<0.05),但2个浓度组间差异无统计学意义,见图3B。当SAG浓度为0.5μM时,在EB悬浮培养法中NKX2.1的阳性细胞率为(74.8±6.5)%,与单层贴壁培养法差异无统计学意义(P>0.05),见图3。

图3 在不同SAG浓度下MGE前体细胞标志物NKX2.1的表达
3 讨论
根据研究者的目的的不同,人多潜能干细胞分化的培养可以向不同方向进行,包括不同胚层、不同部位、不同区域和不同种类的各个类型细胞。体外分化可以探讨疾病的发病机理[5],也可以得到需要的细胞类型用于细胞移植治疗[6,7]。本研究主要采用不同小分子的联合诱导将人多潜能干细胞向神经外胚层、前脑神经上皮细胞、腹侧前脑的MGE区进行分化,进而可分化为特定的神经元类型,以备后续的细胞移植治疗。
在采用单层贴壁培养法分化MGE细胞过程中,DMH1、SB431542、XAV939分别是BMP、TGF-β、WNT通路的抑制剂。Chambers S.M团队[8]研究显示:单独使用Noggin与SB431542,人胚胎干细胞向神经上皮细胞分化效率低于10%,但当两者联合使用时,分化效率可以达到80%。Noggin作为肽类小分子,作用不稳定,本实验室将BMP通道抑制剂换成了DMH1,并且发现DMH1(2μM)联合SB431542(2μM)使用可以将分化效率提高到95%[9]。为了促使神经上皮细胞向前脑方向分化,我们加入了WNT通路的抑制剂XAV939。关于腹侧化诱导,SHH通路激动剂SAG和Purmorphamine[4,10]这2种小分子化合物报道使用较多。在本实验研究中我们主要采用了SAG这种几乎不产生毒性作用且腹侧化强度较高的小分子。一些研究也使用SAG这种小分子进行诱导分化[11,12],但几乎没有研究明确指出MGE分化时适宜的SAG浓度,所以在不同的研究中研究者采用的浓度差别很大。因此,在实验中我们首先探索了SAG浓度对获得MGE神经前体细胞纯度的影响,本研究在其他研究的基础上对几种不同浓度的SAG(0.1μM、0.5μM、1μM、2μM、3μM)进行探索,发现采用0.5μM和1.0μM浓度SAG的对得到高纯度的MGE神经前体细胞较为适宜,浓度过大或过小均会抑制MGE的分化效率,且为了节约试剂成本,我们在后面的分化中均采用0.5μM的SAG浓度。
随后,我们在0.5μM的SAG浓度下对2种不同方案进行比较。在单层培养法中NKX2.1的阳性表达率为(78.6±2.7)%,在EB培养法中阳性表达率为(74.8±6.5)%(P>0.05),提示采用浓度为0.5μM的SAG,2种分化方案获得的MGE神经前体细胞的纯度没有显著差异。EB诱导法分化神经细胞在早期的研究中应用较广[13],但其分化成熟周期比单层诱导法要长[14],且单层诱导法细胞分化的模式化更加稳定,所以现在越来越多的研究倾向这种能够缩短分化周期且分化状态较为稳定的培养方法。在我们的研究中也发现采用单层诱导法观察到神经球和神经元的时间点均要早于采用EB诱导法分化。有研究主张在很早期加入腹侧化的信号通路SHH激动剂,这样在神经上皮诱导阶段就可以促进腹侧的模式化,但SHH通路因子对前脑发育抑制性作用较强[15],如果过早加入SHH激动剂,可能会对头尾侧的模式化发育影响较大,所以SHH激动剂加入的时间也是有争议的,部分研究建议在分化的6~18 d加入SHH激动剂是比较合适的[16]。在我们的研究中,我们开始加入SAG的时间是第7天,获得了较好的分化结果。
综上所述,本研究探索了人多潜能干细胞分化培养MGE神经前体细胞的SAG的适宜浓度为0.5μM,获得MGE神经前体细胞纯度可以高达到70%~80%左右。单层贴壁法和EB悬浮法对最终得到MGE神经前体细胞的纯度影响没有差异,但单层法比EB法能够更加快速得到目的细胞。因此本研究提示:采用单层诱导法,0.5μM的SAG可能是人多潜能干细胞分化培养MGE神经前体细胞的更优化方案,为后续的细胞移植治疗退行性神经疾病奠定了基础。

