lncRNA TTN-AS1通过靶向miR-204-3p调控胃癌细胞迁移、侵袭及上皮-间质转化
赵晶,李蒙,叶成,戴金峰,范一宏
浙江中医药大学附属第一医院 消化科,浙江 杭州 310006
我国胃癌发病率逐年上升,且由于胃癌早期临床症状不明显导致大部分患者确诊时已处于中晚 期[1]。长链非编码RNA(long chain non-coding RNA, lncRNA)在胃癌中异常表达并可能发挥癌基因或抑癌基因作用[2-4]。lncRNA肌联蛋白反义RNA 1(lncRNA titin antisense RNA 1, lncRNA TTNAS1)可促进胃癌的发展[5],但TTN-AS1在胃癌发生及转移过程中的作用机制尚未完全阐明。靶基因预测显示微小RNA-204-3p(miR-204-3p)与TTN-AS1存在结合位点,研究表明miR-204-3p通过调节乳酸脱氢酶介导的糖酵解抑制膀胱癌细胞的增殖[6]。 但TTN-AS1与miR-204-3p在胃癌发生及转移过程中的作用机制尚未可知。因此,本研究主要探讨TTN-AS1对胃癌细胞迁移、侵袭及上皮-间质转化(epithelial-mesenchymal transition, EMT)的影响及其与miR-204-3p的关系,旨在探究TTN-AS1在胃癌中的作用机制。
1 材料和方法
1.1 材料
1.1.1 临床标本:收集2018年1月至2019年10月于浙江中医药大学附属第一医院接受胃癌根治术治疗的30例癌组织标本及其相应癌旁组织标本(距离病灶组织>5 cm处),置于液氮中保存,均经病理诊断为胃癌,其中男20例,女10例,年龄52~68(56.4±10.0)岁;TNM分期I期7例,II期5例,III期18例;排除患有其他恶性肿瘤、自身免疫系统疾病以及肝、肾等重要脏器功能障碍的患者。每位患者均知情同意,本研究经本院伦理委员会批准。
1.1.2 细胞和试剂:人胃癌细胞AGS购自南京科佰生物公司;Lipofectamine2000购自上海润成生物科技有限公司;si-NC、si-TTN-AS1、miR-NC、miR-204-3p mimics、anti-miR-NC、anti-miR-204-3p购自广州锐博生物公司;TRIzol试剂购自广州国奥生物公司;反转录、qRT-PCR试剂购自美国Thermo Fisher公司;Transwell小室购自上海宇进生物公司;Matrigel基质胶购自上海浩然生物公司;兔抗人MMP-2、MMP-9、Vimentin、E-cadherin抗体购自美国Santa Cruz公司。
1.2 方法
1.2.1 实验分组:AGS细胞常规培养后以每孔5× 103个接种于96孔板,分别将si-NC、si-TTN-AS1、miR-NC、miR-204-3p mimics、si-TTN-AS1与anti-miR-NC、si-TTN-AS1与anti-miR-204-3p转染至AGS细胞,标记为si-NC组、si-TTN-AS1组、miR-NC组、miR-204-3p组、si-TTN-AS1+anti-miR-NC组、si-TTNAS1+anti-miR-204-3p组。
1.2.2 qRT-PCR检测TTN-AS1、miR-204-3p的表达:采用TRIzol法提取癌旁组织、胃癌组织及各组转染48 h的AGS细胞中总RNA,将总RNA反转录合成cDNA(严格按照试剂盒说明书进行操作),以cDNA为模板,在美国ABI StepOnePlus实时荧光定量PCR仪中进行qRT-PCR反应(严格按照试剂盒说明书进行操作),检测TTN-AS1相对于内参GAPDH、miR-204-3p相对于内参U6的表达量。
1.2.3 Transwell实验检测细胞迁移与侵袭:取各组转染48 h的AGS细胞,制备每mL无血清培养液含1×104个细胞的悬液,加200 μL至上室,将含有10%胎牛血清的培养液加600 μL至下室,继续培养24 h,固定20 min(多聚甲醛)并染色15 min(0.1%结晶 紫),应用显微镜测量迁移细胞数。预先将Matrigel基质胶40 μL加至上室,保持5 h,后续操作同细胞迁移步骤。
1.2.4 双荧光素酶报告基因检测TTN-AS1与miR-204-3p的靶向关系:miR-NC、miR-204-3p mimics与WT-TTN-AS1、MUT-TTN-AS1共转染至AGS细胞,继续培养24 h后收集AGS并检测荧光素酶活性。
1.2.5 蛋白质印迹法(Western blot)检测蛋白表达:以400 μL RIPA裂解液提取转染48 h的AGS细胞总蛋白,吸取蛋白样品40 μg进行SDS-PAGE电泳反应,转膜、封闭后分别于4 ℃孵育一抗稀释液(兔抗人MMP-2、MMP-9、Vimentin、E-cadherin抗体;均为1:1 000)24 h、于室温孵育二抗稀释液(HRP标记的山羊抗兔二抗;1:2 000)1 h,在ECL中显影,采用ImageJ软件分析各条带相对于内参GAPDH的灰度值之比。
1.3 统计学处理方法 采用SPSS21.0统计学软件进行数据分析。计量资料均符合正态分布,以±s表示,两组间比较采用独立样本t检验,多组间比较采 用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织中lncRNA TTN-AS1和miR-204-3p表达 胃癌组织中TTN-AS1的表达水平比癌旁组织增加约2.90倍(P<0.05),miR-204-3p的表达水平比癌旁组织减少约0.57倍(P<0.05),见表1。
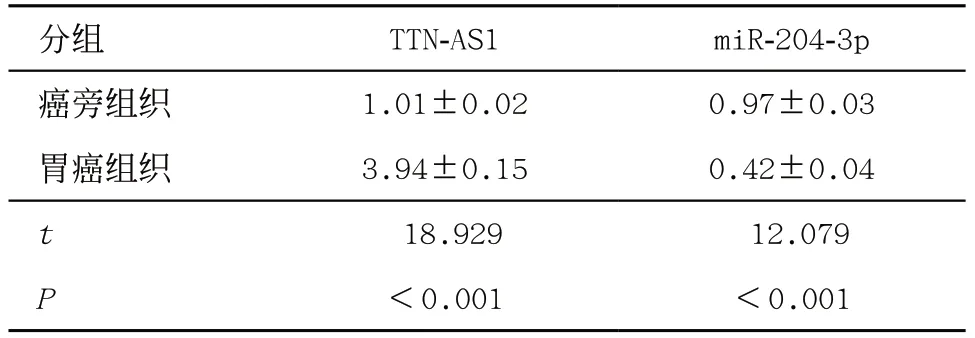
表1 lncRNA TTN-AS1和miR-204-3p在胃癌组织中的表达(± s,n=30)
2.2 抑制lncRNA TTN-AS1表达对胃癌AGS细胞迁移、侵袭的影响 si-TTN-AS1组胃癌AGS细胞迁移及侵袭细胞数均比si-NC组大幅减少(P<0.05),MMP-2、MMP-9蛋白水平和TTN-AS1的表达水平也比si-NC组降低(P<0.05),见图1、表2。
表2 抑制lncRNA TTN-AS1表达对胃癌AGS细胞迁移、侵袭的影响(±s,每组n=9)
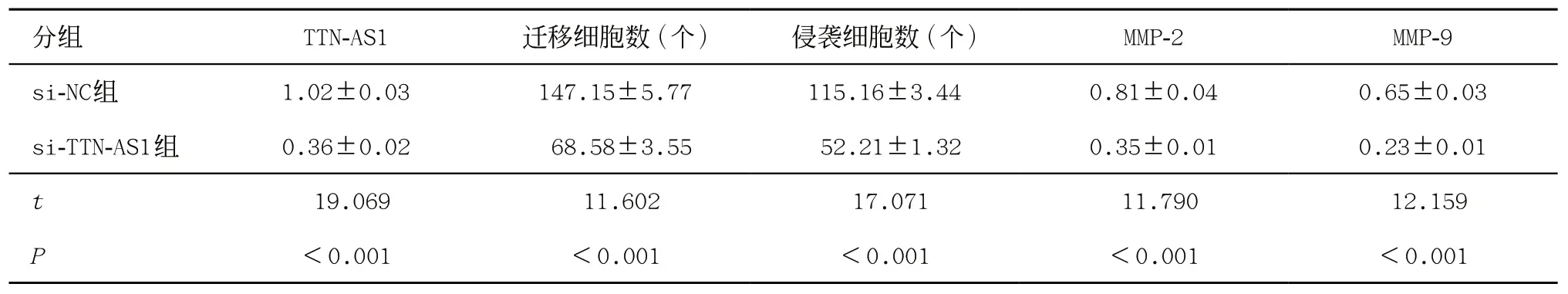
表2 抑制lncRNA TTN-AS1表达对胃癌AGS细胞迁移、侵袭的影响(±s,每组n=9)
分组 TTN-AS1 迁移细胞数(个) 侵袭细胞数(个) MMP-2 MMP-9 si-NC组 1.02±0.03 147.15±5.77 115.16±3.44 0.81±0.04 0.65±0.03 si-TTN-AS1组 0.36±0.02 68.58±3.55 52.21±1.32 0.35±0.01 0.23±0.01 t 19.069 11.602 17.071 11.790 12.159 P<0.001 <0.001 <0.001 <0.001 <0.001
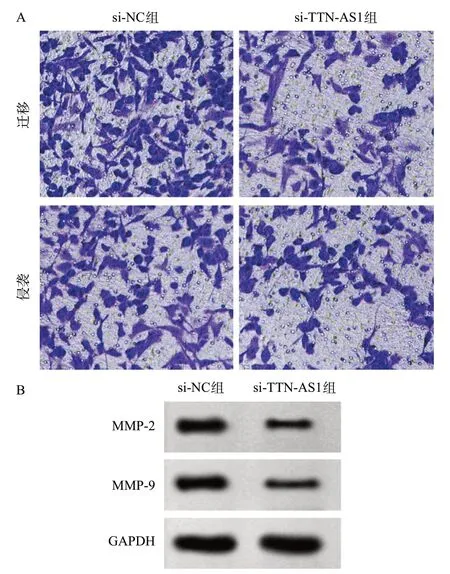
图1 抑制lncRNA TTN-AS1表达对胃癌AGS细胞迁移、侵袭的影响
2.3 抑制lncRNA TTN-AS1表达对胃癌AGS细胞EMT的影响 与si-NC组比,si-TTN-AS1组E-cadherin蛋白水平升高(P<0.05),Vimentin蛋白水平降低(P<0.05),见表3。
表3 抑制lncRNA TTN-AS1表达对胃癌AGS细胞EMT相关蛋白表达的影响(±s,每组n=9)
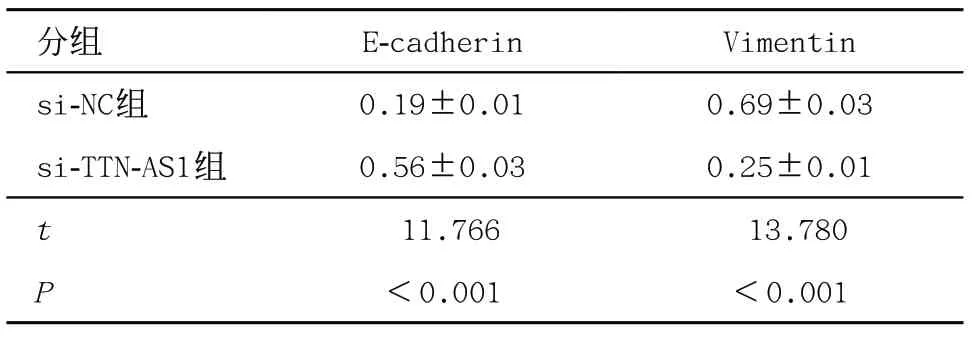
表3 抑制lncRNA TTN-AS1表达对胃癌AGS细胞EMT相关蛋白表达的影响(±s,每组n=9)
分组 E-cadherin Vimentin si-NC组 0.19±0.01 0.69±0.03 si-TTN-AS1组 0.56±0.03 0.25±0.01 t 11.766 13.780 P<0.001 <0.001
2.4 lncRNA TTN-AS1靶向调控miR-204-3p的表达LncBase Predicted v.2软件对TTN-AS1和miR-204-3p的结合位点进行预测,见图2。miR-204-3p组与miR-NC组比WT-TTN-AS1载体的荧光素酶活性较低 (P<0.05),见表4。TTN-AS1可负向调控miR-204-3p的表达,见表5。
表4 双荧光素酶报告实验(±s,每组n=9)
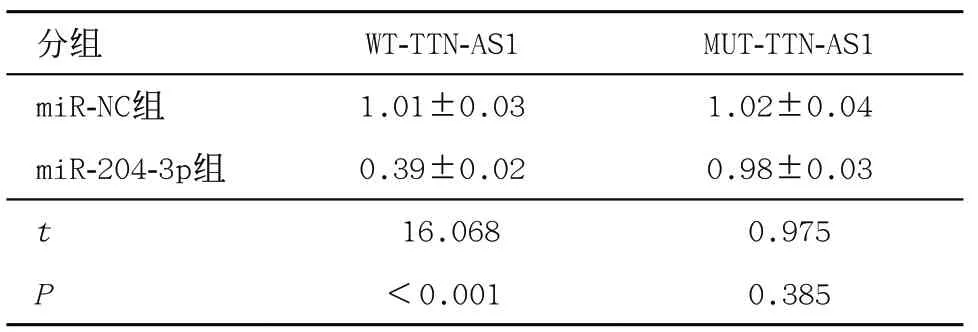
表4 双荧光素酶报告实验(±s,每组n=9)
分组 WT-TTN-AS1 MUT-TTN-AS1 miR-NC组 1.01±0.03 1.02±0.04 miR-204-3p组 0.39±0.02 0.98±0.03 t 16.068 0.975 P<0.001 0.385
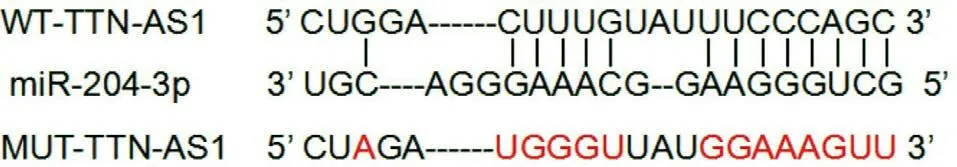
图2 TTN-AS1与miR-204-3p存在互补序列
表5 lncRNA TTN-AS1调控miR-204-3p表达(±s,每组n=9)

表5 lncRNA TTN-AS1调控miR-204-3p表达(±s,每组n=9)
与pcDNA组比:aP<0.05;与si-NC组比:bP<0.05
分组 miR-204-3p pcDNA组 1.01±0.05 pcDNA-TTN-AS1组 0.33±0.02a si-NC组 0.97±0.04 si-TTN-AS1组 3.05±0.19b F 133.404 P<0.001
2.5 过表达miR-204-3p对胃癌AGS细胞迁移、侵袭的影响 miR-204-3p组胃癌AGS细胞的迁移、侵袭细胞数及MMP-2、MMP-9蛋白水平均低于miR-NC组(P<0.05),miR-204-3p表达水平高于miR-NC组(P<0.05),见图3和表6。
表6 过表达miR-204-3p对胃癌AGS细胞迁移、侵袭的影响(±s,每组n=9)
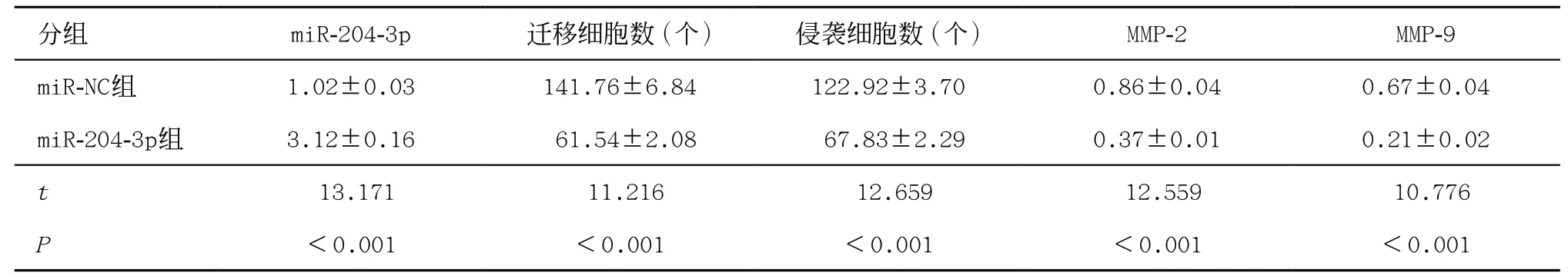
表6 过表达miR-204-3p对胃癌AGS细胞迁移、侵袭的影响(±s,每组n=9)
分组 miR-204-3p 迁移细胞数(个) 侵袭细胞数(个) MMP-2 MMP-9 miR-NC组 1.02±0.03 141.76±6.84 122.92±3.70 0.86±0.04 0.67±0.04 miR-204-3p组 3.12±0.16 61.54±2.08 67.83±2.29 0.37±0.01 0.21±0.02 t 13.171 11.216 12.659 12.559 10.776 P<0.001 <0.001 <0.001 <0.001 <0.001
2.6 过表达miR-204-3p对胃癌AGS细胞EMT的影响 miR-204-3p组E-cadherin蛋白水平与miR-NC组比有所增加(P<0.05),Vimentin蛋白水平与miR-NC组比大幅减少(P<0.05),见表7。
表7 过表达miR-204-3p对胃癌AGS细胞EMT相关蛋白表达的影响(±s,每组n=9)
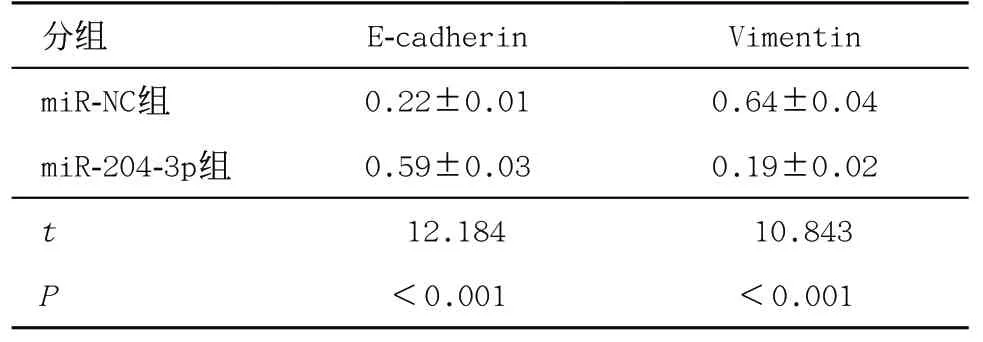
表7 过表达miR-204-3p对胃癌AGS细胞EMT相关蛋白表达的影响(±s,每组n=9)
分组 E-cadherin Vimentin miR-NC组 0.22±0.01 0.64±0.04 miR-204-3p组 0.59±0.03 0.19±0.02 t 12.184 10.843 P<0.001 <0.001
2.7 下调miR-204-3p表达逆转了抑制lncRNA TTNAS1表达对胃癌AGS细胞迁移、侵袭和EMT的影响 与si-TTN-AS1+anti-miR-NC组比较,si-TTNAS1+anti-miR-204-3p组迁移及侵袭细胞数增多(P< 0.05),并且si-TTN-AS1+anti-miR-204-3p组比si-TTN-AS1+anti-miR-NC组增加MMP-2、MMP-9、Vimentin 蛋白水平(P<0.05),但降低E-cadherin蛋白水平和miR-204-3p表达水平(P<0.05),见图4和表8。
表8 下调miR-204-3p表达逆转了抑制lncRNA TTN-AS1表达对胃癌AGS细胞迁移、侵袭和EMT的影响(±s,每组n=9)
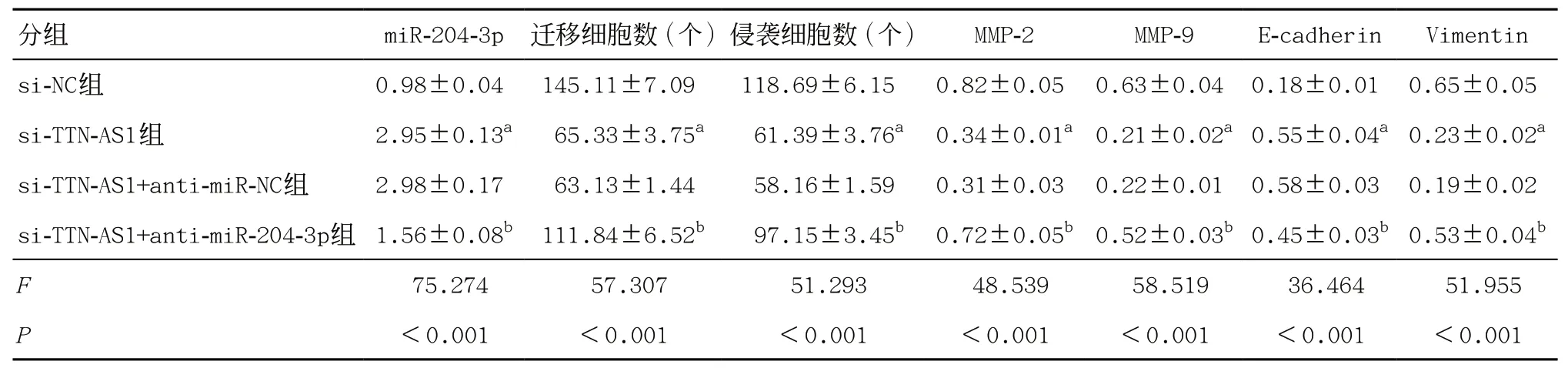
表8 下调miR-204-3p表达逆转了抑制lncRNA TTN-AS1表达对胃癌AGS细胞迁移、侵袭和EMT的影响(±s,每组n=9)
与si-NC组比:aP<0.05;与si-TTN-AS1+anti-miR-NC组比:bP<0.05
分组 miR-204-3p 迁移细胞数(个)侵袭细胞数(个) MMP-2 MMP-9 E-cadherin Vimentin si-NC组 0.98±0.04 145.11±7.09 118.69±6.15 0.82±0.05 0.63±0.04 0.18±0.01 0.65±0.05 si-TTN-AS1组 2.95±0.13a 65.33±3.75a 61.39±3.76a 0.34±0.01a0.21±0.02a0.55±0.04a0.23±0.02a si-TTN-AS1+anti-miR-NC组 2.98±0.17 63.13±1.44 58.16±1.59 0.31±0.03 0.22±0.01 0.58±0.03 0.19±0.02 si-TTN-AS1+anti-miR-204-3p组 1.56±0.08b 111.84±6.52b 97.15±3.45b 0.72±0.05b0.52±0.03b0.45±0.03b0.53±0.04b F 75.274 57.307 51.293 48.539 58.519 36.464 51.955 P<0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
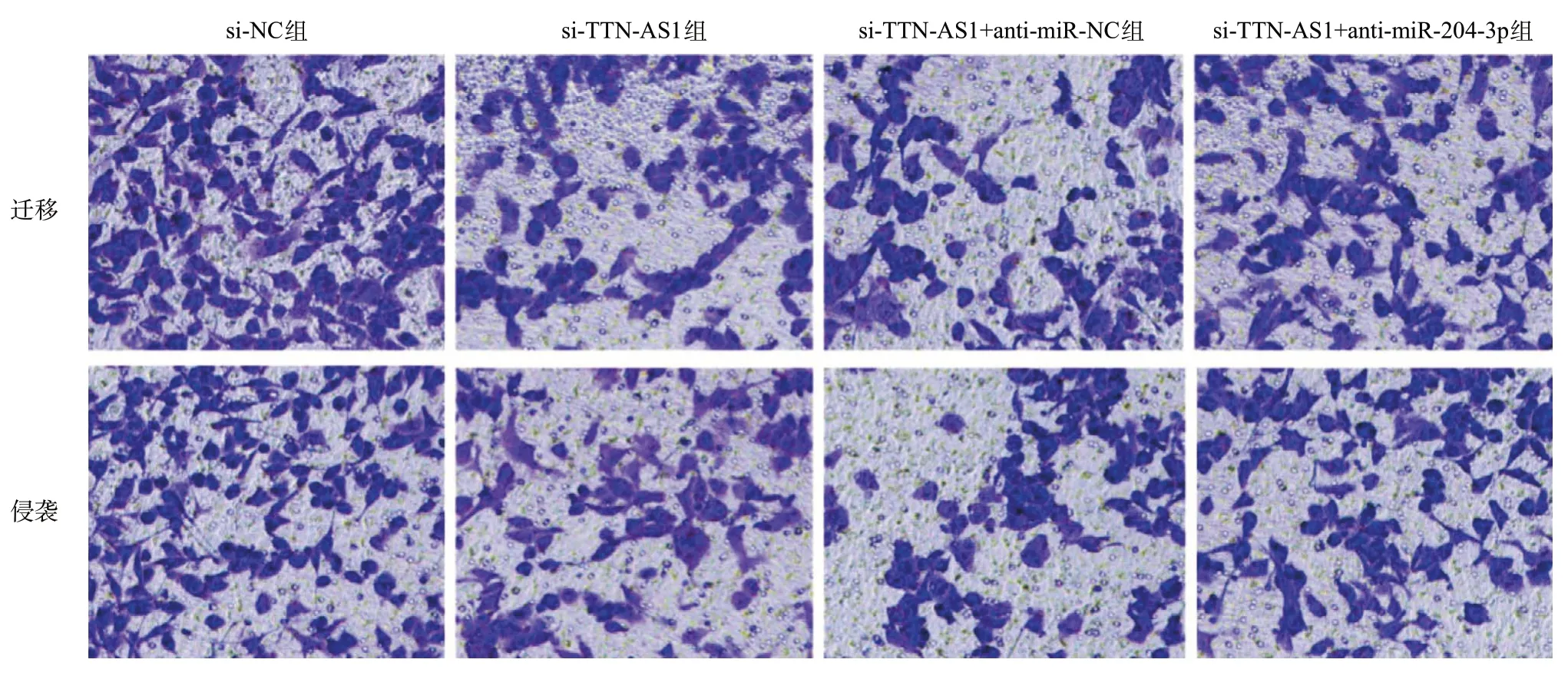
图4 下调miR-204-3p表达逆转了抑制lncRNA TTN-AS1表达对胃癌AGS细胞迁移、侵袭和EMT的影响
3 讨论
胃癌是全球最常见的恶性肿瘤之一,lncRNA可充当miRNA的竞争内源性RNA而参与胃癌发生及发展过程[7-10]。但仍有部分lncRNA在胃癌发生及发展过程中的作用机制尚未阐明。
TTN-AS1通过miR-134-5p/MBTD1轴调节骨肉瘤细胞凋亡和耐药性[11]。TTN-AS1通过调节miR-142-5p/CDK5促进肺腺癌的迁移、侵袭和EMT[12]。TTN-AS1通过调节miR-153-3p/ZNRF2轴促进甲状腺乳头状癌的发生[13]。上述研究表明TTN-AS1在肿瘤发生过程中可能发挥癌基因作用。本研究结果显示,胃癌组织中TTN-AS1呈高表达,提示TTN-AS1在胃癌发生过程中可能发挥重要调控作用。MMP-2、MMP-9可促进癌细胞转移[14]。本研究结果显示,抑制TTN-AS1的表达使迁移及侵袭能力减弱,同时MMP-2、MMP-9的表达下调,提示抑制TTN-AS1的表达对胃癌细胞迁移及侵袭起抑制作用。EMT过程中上皮细胞标志物E-cadherin表达水平降低可促进EMT,而间充质细胞标志物Vimentin表达水平降低可抑制EMT[15-16]。本研究结果显示,抑制TTN-AS1表达可明显提高Ecadherin蛋白水平及降低Vimentin蛋白水平,提示抑制TTN-AS1表达可通过抑制EMT从而减弱胃癌细胞转移能力。
本研究证实TTN-AS1可靶向结合miR-204-3p。研究表明lncRNA LINC00963通过调控miR-204-3p/FN1轴促进骨肉瘤的增殖和侵袭[17]。miR-204-3p通过靶向HMGA2抑制结肠癌细胞的增殖、迁移和侵袭[18]。沉默lncRNA LINC00514通过调控miR-204-3p/CDC23轴抑制甲状腺乳头状癌的恶性行为[19]。本研究结果显示,胃癌组织中miR-204-3p的表达水平降低,miR-204-3p过表达可通过抑制EMT从而抑制胃癌细胞迁移及侵袭,下调miR-204-3p表达可明显逆转抑制TTN-AS1表达对胃癌细胞迁移、侵袭及EMT的作用。
综上所述,TTN-AS1在胃癌中表达水平升高,而miR-204-3p的表达水平降低,抑制TTN-AS1表达可通过上调miR-204-3p的表达从而抑制胃癌细胞迁移、侵袭及EMT,其可能作为胃癌分子治疗的潜在靶点。TTN-AS1可通过调节多个miRNA影响多种肿瘤的迁移、侵袭和EMT,是否在胃癌的发病中也存在同时调节多个miRNA影响胃癌细胞的生物学行为,均需进一步探究。

