孕中期肠道菌群特征及其与妊娠期糖尿病的关系
苏尧 陈莉 徐先明
上海交通大学附属上海市第一人民医院妇产科上海交通大学医学院(上海 201600)
妊娠期糖尿病(GDM)在2015年至2016年被美国糖尿病协会更新其定义为“妊娠前无糖尿病,在妊娠中晚期诊断为糖尿病的人”,GDM 发病率在全球范围内约1%~30%[1]。肠道菌群被发现通过影响人体的代谢和免疫[2],从而在GDM 的发生发展中扮演了越发重要的角色,较为热门的学说有内毒素血症、胰岛素抵抗等。研究发现拟杆菌与OGTT 结果呈正相关,可能是GDM 的潜在监测和治疗性微生物标记[3]。拟杆菌可获取和降解植物多糖,为人体提供约15%的能量,PEDERSEN 等[4]发现口服拟杆菌菌株导致无菌小鼠体内脂肪含量快速增加,同时空腹血糖和胰岛素水平也显著升高,出现胰岛素抵抗状态。GDM 孕妇毛螺菌科和瘤胃菌科丰度明显高于正常健康孕妇[5],这两种菌与糖耐试验中1 h 血糖水平负相关,它们是能量代谢的优势菌,可分解膳食纤维产生丁酸[6]。目前降糖的研究中主要包括抑制胰岛β 细胞凋亡,促进胰岛素分泌,调节关键酶活性以及调节肠道菌群等多种途径。有研究补充含有乳酸菌的益生菌可产生类似二甲双胍的作用,可改善胰岛素抵抗和降低血糖[7]。
本研究旨在分析上海地区孕妇孕中期GDM孕妇和健康孕妇肠道菌群的差异,探讨其在GDM发病机制中的作用,以期为GDM 的预防和治疗提供新的靶点。
1 资料与方法
1.1 研究对象及分组选择2019年9月至2020年6月于上海交通大学医学院附属上海市第一人民医院南院产科建卡及规律产检的妊娠期糖耐量正常孕妇(gestational normal glucose tolerance,GNGT)22 例以及确诊患有妊娠期糖尿病的孕妇(GDM 组)20 例。
入组标准:(1)上海松江常住居民,当地普通饮食,(2)汉族,(3)单胎妊娠,(4)自然受孕,(5)孕24~28 周(OGTT 时间)。排除标准:(1)患有传染性疾病,如艾滋病、活动性肝炎、梅毒等;(2)孕前患有糖尿病或糖耐量异常;(3)有严重的应激性生活事件发生、严重焦虑、抑郁者;(4)合并高血压、慢性高血压、慢性肾炎等慢性病史者;(5)近1 个月内腹泻或合并消化道慢性病史;(6)入组前2 个月内服用抗生素;(7)合并消化道疾病或有胃肠道肿瘤、手术史。
本研究为观察性病例对照研究,已获得上海交通大学附属上海市第一人民医院伦理委员会的审核批准,所有研究对象签署知情同意书。
1.2 研究方法
1.2.1 病历信息采集通过孕妇大卡收集一般信息,包括年龄、孕前体质量、身高、孕前体质量指数(body mass index,BMI)、民族以及妊娠情况,包括OGTT 时间、孕周、孕次、产次、血压、妊娠合并症及并发症,既往病史等。
1.2.2 诊断标准BMI(kg/m2)=体质量(kg)/身高(cm)2。GDM 诊断标准参考2015年美国糖尿病协会发布更新的糖尿病医学诊治标准[1]:空腹血糖(FBG)≥5.1 mmol/L(92 mg/dL),1 h血糖(1 h PBG)≥10.0 mmol/L(180 mg/dL),2 h 血糖(2 h PBG)≥8.5 mmol/L(153 mg/dL),出现以上任一血糖值即诊断为GDM。
1.2.3 胰岛素敏感性计算公式[8](1)胰岛素抵抗指数(HOMA-IR):HOMA-IR=空腹血糖水平(FBG,mmol/L)×空腹胰岛素水平(FINS,mIU/L)/22.5;(2)胰岛素分泌指数(HOMA-IS):HOMA-IS=1/HOMAIR;(3)胰岛β 细胞功能指数(HOMA-β,%)=20×空腹胰岛素水平(FINS,mIU/L)/(空腹血糖水平(FBG,mmol/L)-3.5)。
1.2.4 粪便情况调查5 mL 伯优TM 粪便核酸保存管购自上海伯豪生物技术有限公司,入组的孕妇在行OGTT 筛查当天用保存管采集新鲜晨便,利用管盖上的取样勺随机拾取三处不同部位的粪便样本,于门诊交与研究人员置于-80 ℃冰箱保存,后续用Illumina Hiseq2500 平台检测42 例孕妇的肠道菌群构成。具体操作如下:(1)粪便DNA的提取:利用Magnetic Fecal DNA Extraction Kit 抽提粪便标本中的菌群基因组DNA。(2)DNA 样本检测:使用ExKubitdsDNA HS 分析试剂盒检测DNA 的质量,筛选符合检测标准的DNA 样本。(3)PCR 扩增:利用聚合酶链反应特异性扩增16SrRNA 的V3-V4可变区。反应采用TransGen AP221-02:Trans Start Fastpfu DNA 聚合酶,体系包括10 ng of template DNA,2 μL 引物等,总共20 μL。引物序列:上游为338F(5′-ACTCCTACGGGAGGCAGCAG-3′),下游为806R(5′-GGACTACHVGGGTWTCTAAT-3′)。得到16SrRNA 基因片段后通过2%琼脂糖凝胶电泳检测PCR产物。(4)基因测序:利用Illumina Hiseq2500 平台,通过激光扫描反应板读取模板序列聚合的核苷酸种类,对采集到的荧光信号进行建库分析,从而读取模板DNA 片段的序列。
1.2.5 肠道菌群指数分析利用Trimmomatic 软件,通过RDP classifer 贝叶斯算法聚类为OTU,然后对物种分类信息进行注释。采用Usearch 软件统计分析获得相对丰度和多样性等相关指数。
1.3 统计学分析采用SPSS 26.0 软件对数据进行统计分析,服从正态性检验的计量资料用()表示,组间比较采用独立样本t检验;偏态分布的计量资料用M(P25~P75)表示,组间比较采用Mann-WhitneyU检验。双变量相关性分析采用Pearson相关性分析。采用ROC 曲线预测肠道菌群对GDM的诊断价值。以P<0.05 为差异有统计学意义,所有检验均为双侧。
2 结果
2.1 GDM 组和GNGT 组的临床资料比较本研究中的GDM 组和GNGT 组孕妇的年龄、OGTT 孕周、孕前BMI、孕次、产次、收缩压和舒张压的组间比较,差异均无统计学意义(P>0.05),见表1。

表1 42 例孕妇的基本特征比较Tab.1 Comparison of the demographic Characteristics among 42 pregnant women M(P25,P75)
2.2 两组孕妇门水平及属水平肠道菌群的构成及相对丰度
2.2.1 门水平两组孕妇肠道菌群的相对丰度比较在门水平上,42例孕妇的孕中期肠道菌群标本中共发现22 个菌门,相对丰度前7 位的菌门构成:厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门、柔膜菌门和其他菌门,见图1。与GNGT组比较,GDM 组孕妇拟杆菌门和其他菌门的相对丰度明显升高,而放线菌门、疣微菌门和柔膜菌门的相对丰度均降低(P<0.05),厚壁菌门和变形菌门的相对丰度比较差异无统计学意义(P>0.05)。

图1 GDM 组和GNGT 组孕妇门水平肠道菌群相对丰度的分布柱状图Fig.1 Relative abundance of the intestinal flora between two groups based on phylum level
2.2.2 属水平两组孕妇肠道菌群的相对丰度比较属水平上,42 例孕妇的孕中期肠道菌群标本共发现315 个菌属,相对丰度前8 位的菌属分别是:拟杆菌属、粪杆菌属、其他菌属-A、巨单胞菌属、产粪甾醇真细菌属、Lachnoclostridium 属、Escherichiashigella 属和瘤胃菌属-UCG014,见图2。与GNGT 组比较,GDM 组孕妇拟杆菌属的平均相对丰度显著升高,而产粪甾醇真细菌属、Escherichiashigella 属和瘤胃菌属-UCG014 的相对丰度降低,以上差异均有统计学意义(P<0.05),其他四个菌属的相对丰度无统计学意义(P>0.05)。

图2 GDM 组和GNGT 组孕妇属水平肠道菌群相对丰度的分布柱状图Fig.2 Relative abundance of the intestinal flora between two groups based on genus level
2.3 两组孕妇肠道菌群的α多样性及OTUs比较见表2,GDM 组孕妇肠道菌群的OTUs、Ace 指数、Chao1 指数和Shannon 指数均显著高于GNGT 组孕妇(P<0.05),而两组的Simpson 指数比较差异无统计学意义(P>0.05)。
表2 GDM 组和GNGT 组孕妇肠道菌群多样性比较Tab.2 Comparison of the diversity of intestinal flora in two groups ±s

表2 GDM 组和GNGT 组孕妇肠道菌群多样性比较Tab.2 Comparison of the diversity of intestinal flora in two groups ±s
组别GDM 组GNGT 组t 或U 值P 值样本数(例)20 22 Ace 指数2326.53±780.72 817.03±224.48-8.339<0.05 OTUs 969.05±298.23 458.05±107.41-7.247<0.05 Chao1 指数1703.98±553.53 686.39±166.60-7.902<0.05 Shannon 指数4.48±0.72 3.91±0.67-2.630<0.05 Simpson 指数[M(P25,P75)]0.03(0.02,0.07)0.04(0.03,0.12)170.00>0.05
2.4 肠道菌群与糖代谢相关性的矩阵热图孕中期的肠道菌群中,拟杆菌门和拟杆菌属的相对丰度与OGTT1 小时胰岛素呈正相关;厚壁菌门的相对丰度与1 小时胰岛素呈负相关;放线菌门与FBG呈负相关;瘤胃菌属-UCG014 与HbA1c、1 h PBG、1 小时胰岛素和HOMA-IR 呈负相关,以上差异均有统计学意义(P<0.05),见图3。

图3 孕中期肠道菌群与糖代谢指标相关性的热图Fig.3 Heat map of the correlation between intestinal flora and glucose metabolism indicators in the second trimester
2.5 ROC 曲线分析肠道菌群对GDM 的诊断价值拟杆菌门的AUC 值为0.759(0.605~0.913),最佳cut off 值为0.277,其约登指数为0.523,敏感性为75.0%,特异性为77.3%;拟杆菌属的AUC 值为0.745(0.588~0.903),最佳cut off 值为0.250,其约登指数为0.518,敏感性为70.0%,特异性为81.8%,其他菌门和属均无统计学意义(P>0.05 或AUC <0.5),见表3、图4-5。
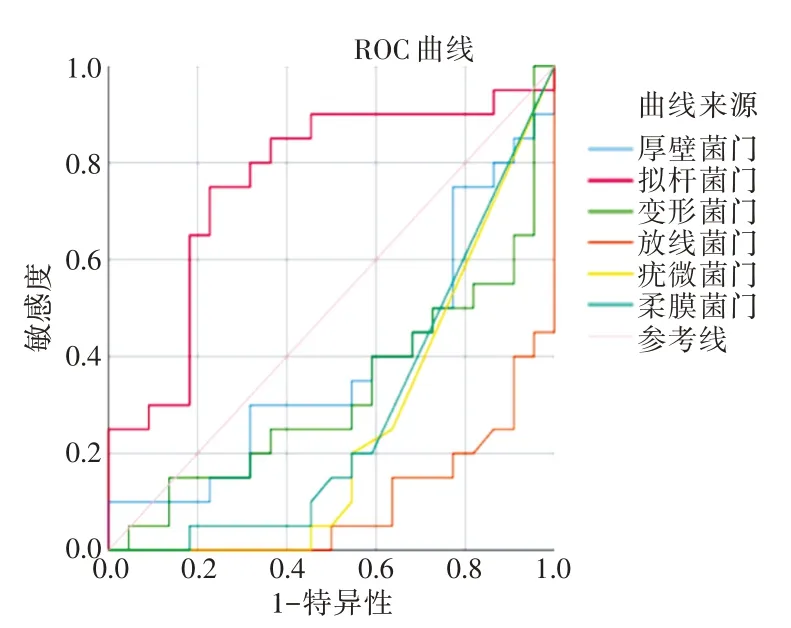
图4 ROC 曲线分析孕中期肠道菌群在门水平对GDM 的诊断价值Fig.4 ROC curve analysis of the diagnostic value of intestinal flora at the phylum level in the second trimesterfor GDM

表3 ROC 分析肠道菌群在门和属水平对GDM 的诊断价值Tab.3 ROC analysis of the diagnostic value of intestinal flora at the phylum and genera level for GDM
3 讨论

图5 ROC 曲线分析孕中期肠道菌群在属水平对GDM 的诊断价值Fig.5 ROC curve analysis of the diagnostic value of intestinal flora at the genera level in the second trimester for GDM
本研究重点探讨了孕中期肠道菌群和妊娠期糖尿病的相关性,发现GDM 组孕妇肠道菌群的α多样性显著高于GNGT 组,有研究发现,肠道菌群的α 多样性对糖代谢紊乱具有影响[9]。现有研究表明肠道菌群紊乱可通过不同的机制来诱导糖尿病的发生:(1)肠道菌群在宿主免疫系统中起着关键的作用,细菌脂多糖通过识别Toll 样受体触发促炎细胞因子和趋化因子的表达[10],从而介导肠道慢性炎症,导致胰岛素抵抗。(2)作为拟杆菌等肠道微生物的代谢产物,包括乙酸盐和丙酸盐在内的SCFA 通过G 蛋白偶联受体抑制组蛋白脱乙酰基酶[11],来调节宿主的能量获取和代谢能力,SCFA 的膳食补充可改善2 型糖尿病患者的肠道菌群紊乱和葡萄糖稳态,并通过增强产SCFA 细菌的活性正向促进SCFA 产生。
拟杆菌门作为人类肠道菌群的优势菌群,可通过不同的机制来影响糖代谢途径。CANI 等[12]研究发现感染拟杆菌的无菌小鼠出现血清中支链氨基酸水平明显增加,且诱导了胰岛素抵抗。拟杆菌(革兰氏阴性杆菌)可通过细胞壁的脂多糖成分增加肠道通透性来介导代谢性内毒素血症,从而导致肥胖和糖尿病的发生。综上所述,拟杆菌可能与妊娠期糖尿病具有一定的相关性。本研究验证了以上推论,无论是GDM 组还是GNGT 组孕妇,厚壁菌和拟杆菌所占比例都是最高的,但GDM 组的拟杆菌明显高于糖耐量正常的孕妇,且拟杆菌门和拟杆菌属均与孕妇的1 h 胰岛素呈正相关,通过ROC 曲线分析,进一步确定了拟杆菌在GDM 的诊断中的价值。
肠道菌群结构的失调,尤其拟杆菌的比例增加,可能是导致GDM 的危险因素之一。因此,改善肠道菌群有望成为防治GDM 的靶点,以下三个方面可作为参考:(1)医学营养疗法:提倡地中海饮食有助于降低机体的炎症应激和内皮功能障碍。饮食中营养成分可直接促进或抑制菌群的生长繁殖,其中的小分子物质会通过影响机体的内分泌、代谢和免疫系统对菌群产生影响[13]。有研究发现低纤维素饮食会导致菌群过度损伤肠道粘液层,促进肠腔中脂多糖、炎症因子和葡萄糖等小分子进入血液循环,最终影响代谢[14]。(2)微生态调节剂:人体内益生菌可通过调节人体肠道黏膜的屏障功能和免疫系统功能促进营养物质的吸收,保持肠道环境健康。有研究表明奶粉中添加低聚半乳糖后喂养新生儿,可检测到新生儿粪便中双歧杆菌属丰度明显增加。动物研究发现饮食中增加膳食纤维的比例后肠道中双歧杆菌、乳酸菌等对肠道炎症具有保护性作用菌群丰度增高,同时SCFA 含量增加[15]。(3)粪菌移植:粪便微生物群移植通过将健康机体的粪便菌液移植到患者体内来治疗疾病。操纵肠道菌群来促进健康很有前景,但是尚不清楚在肠道中定植的规则。不过已有研究表明通过改善饮食和生活方式或者使用益生菌干预可以改变肠道微生物群落[16]。

