miR-3619-5p靶向PFKFB3抑制结肠癌细胞的增殖、迁移和侵袭
郭银谋,王玉梅,陈贡斌,岳培茹,周威
(商丘市第一人民医院 肿瘤一科,商丘 476100)
结肠癌是常见的消化道恶性肿瘤,转移和侵袭性较强,患者确诊时多为晚期,且目前年轻人结肠癌的死亡率有升高趋势[1]。现阶段,结肠癌的分子靶向治疗给中晚期结肠癌患者的治疗提供了新的选择。结肠癌中差异表达的miRNA可能是结肠癌的诊断标志物或治疗靶点[2]。研究表明,miR-3619-5p可抑制恶性肿瘤进展,在前列腺癌[3]、乳腺癌[4]、膀胱癌[5]中表达下调。本研究通过StarBase预测发现,6磷酸果糖2激酶/果糖-2,6-二磷酸酶3(6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 3,PFKFB3)可能是miR-3619-5p的靶基因。PFKFB3已被证明在结肠癌组织中表达上调,其miRNA水平的高表达与患者恶性表型及不良预后相关[6]。但miR-3619-5p在结肠癌组织中的表达、作用及其与PFKFB3的关系目前尚未可知。因此,本研究假设miR-3619-5p通过靶向PFKFB3影响结肠癌细胞的增殖、迁移和侵袭,并对此进行验证。
1 材料与方法
1.1 材料选取2018年3月—2019年3月于河南省商丘市第一人民医院病理检查确诊为结肠癌的患者手术切除的结肠癌组织及癌旁组织(距离结肠癌组织边缘>1.5 cm)各35例,患者男性16例、女性19例,年龄(49.2±16.9)岁。所有患者术前未接受放疗和化疗,并对研究知情同意。
人结肠癌细胞株HCT116购自北京北纳创联生物技术研究院;胰蛋白酶购自Sigma-Aldrich公司;RPMI 1640培养液、FBS购自Gibco公司;Lipofectamine 2000转染试剂、RNA提取试剂TRIzol、Real-time PCR 试剂盒、反转录试剂盒购自宝生物工程(大连)有限公司;CCK-8检测试剂盒购自上海碧云天生物技术有限公司;PFKFB3过表达载体(pcDNA-PFKFB3)、PFKFB3抑制物(si-PFKFB3)、miR-3619-5p模拟物(miR-3619-5p)、miR-3619-5p抑制剂(anti-miR-3619-5p)、阴性对照(pcDNA、si-NC、miR-NC和anti-miR-NC)、PFKFB3野生型(WT-PFKFB3)和突变型(MUT-PFKFB3)双荧光素酶报告载体均购自上海吉玛制药有限公司;PFKFB3、细胞周期蛋白D1(Cyclin D1)、p21、基质金属蛋白酶2(matrix metalloprotease 2,MMP-2)、基质金属蛋白酶9(matrix metalloprotease 9,MMP-9)和GAPDH抗体购自Abcam公司;Transwell板购自Corning公司;双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自Promega公司;qRT-PCR仪购自Bio-Rad公司。
1.2 方法
1.2.1 细胞培养 将结肠癌细胞HCT116常规复苏,培养于含10 % FBS的RPMI 1640培养液中,在培养液中添加100 U/mL青霉素和100 μg/mL链霉素,置于饱和、湿润、37 ℃、5% CO2培养箱中培养。待细胞生长至对数生长期,进行消化传代。
1.2.2 miR-3619-5p和PFKFB3 mRNA表达的qRT-PCR检测 用TRIzol试剂提取结肠癌组织样本、癌旁组织和HCT116细胞的总RNA,反转录合成cDNA,再以得到的cDNA为模板,按照qRT-PCR的说明书进行反应,检测miR-3619-5p和PFKFB3 mRNA水平。运用2-ΔΔ Ct方法进行数据分析。qRT-PCR引物详见表1。
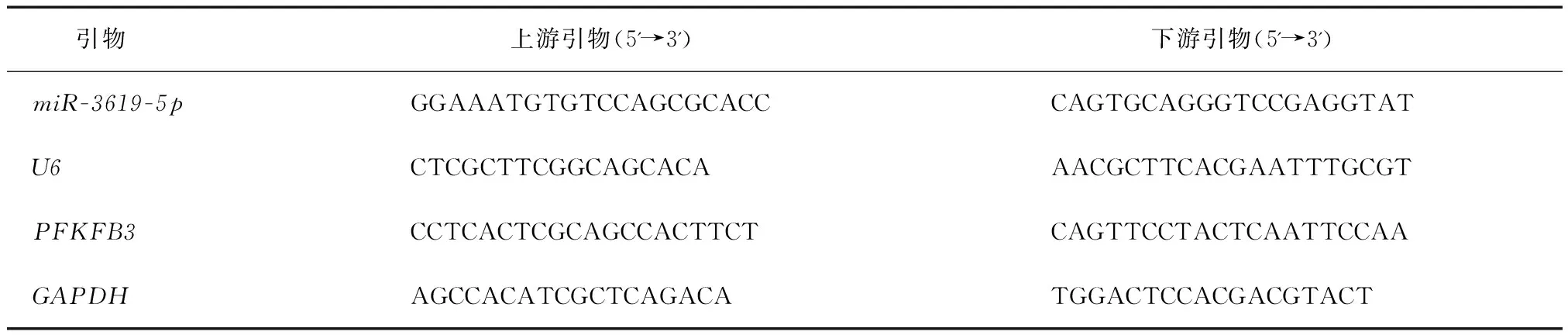
表1 qRT-PCR引物
1.2.3 细胞转染 将细胞稀释至1×l06个/mL,取100 μL接种于6孔板中,待细胞培养至融合度达70%时,根据Lipofectamine 2000转染试剂说明书转染HCT116细胞。将载体miR-NC、miR-3619-5p、si-NC、si-PFKFB3、anti-miR-NC、anti-miR-3619-5p、miR-3619-5p+pcDNA、miR-3619-5p+pcDNA-PFKFB3分别转染至HCT116细胞,分别记为miR-NC组、miR-3619-5p组、si-NC组、si-PFKFB3组、anti-miR-NC组、anti-miR-3619-5p组、miR-3619-5p+pcDNA组、miR-3619-5p+pcDNA-PFKFB3组。转染48 h收集细胞,检测miR-3619-5p和PFKFB3的表达以进行转染验证,验证成功后进行后续试验。
1.2.4 细胞增殖的CCK-8试验检测 将miR-NC组、miR-3619-5p组、si-NC组、si-PFKFB3组、miR-3619-5p+pcDNA组、miR-3619-5p+pcDNA-PFKFB3组HCT116细胞以100 μL/孔(1×104个/mL)接种于96孔板中,在37 ℃、5% CO2培养箱中培养,在培养至24、48和72 h时每孔加入10 μL CCK-8溶液,继续培养2 h,用酶标仪测定光密度[D(450 nm)]值。
1.2.5 PFKFB3、Cyclin D1、p21、MMP-2和MMP-9蛋白的Western blotting检测 收集上述“1.2.3”项分组的处于对数生长期的HCT116细胞,裂解细胞,提取细胞总蛋白。用SDS-PAGE分离蛋白样本,转PVDF膜,然后将膜置于脱脂牛奶溶液中室温封闭2 h,洗膜后分别加入稀释的一抗:PFKFB3抗体(1∶1 000)、Cyclin D1抗体(1∶2 000)、p21抗体(1∶1 500)、MMP-2抗体(1∶2 000)、MMP-9抗体(1∶1 000)和GAPDH抗体(1∶5 000),4 ℃孵育过夜。洗膜2次,加入酶标二抗,室温孵育2 h,显影,拍照。以GAPDH为内参分析蛋白的表达水平。
1.2.6 细胞迁移和侵袭的Transwell试验检测 (1)迁移试验:收集转染后的HCT116细胞,在无血清培养液中饥饿培养过夜,用无血清RPMI 1640培养液将细胞稀释至1×106个/mL,然后取100 μL加入Transwell上层小室,下层培养孔加入500 μL含10%FBS的RPMI 1640培养液。置培养箱中培养24 h,随后用棉签拭去上层小室内层未迁移的细胞,采用多聚甲醛固定迁移细胞,结晶紫染色,显微镜下取5个视野计数迁移细胞,取平均数即为迁移细胞数。(2)侵袭试验:将液化的Matrigel用低温RPMI 1640 培养液以1∶3比例稀释,取50 μL平铺入Transwell上层小室,在37 ℃固化3 h,之后的步骤同迁移试验。
1.2.7 双荧光素酶报告试验 根据上述“1.2.3”项的方法进行细胞转染,将构建好的PFKFB3野生型(WT-PFKFB3)和突变型(MUT-PFKFB3)双荧光素酶报告载体分别与miR-NC或miR-3619-5p共转染HCT116细胞,转染48 h后收集细胞,根据试剂盒说明书检测荧光素酶活性。

2 结果
2.1 miR-3619-5p和PFKFB3在结肠癌组织中的表达与癌旁组织比较,结肠癌组织中miR-3619-5p水平显著降低(P<0.05,图1A),PFKFB3 mRNA和蛋白水平显著升高(P<0.05,图1B、C)。

注:A. miR-3619-5p的表达分析;B. PFKFB3 mRNA的表达分析;C.PFKFB3蛋白的表达分析, N1、N2、N3为癌旁组织, T1、T2、T3为结肠癌组织。与癌旁组织比较,*P<0.05。图1 结肠癌组织和癌旁组织中miR-3619-5p和PFKFB3的表达
2.2 miR-3619-5p过表达对结肠癌细胞HCT116增殖、迁移和侵袭的影响过表达miR-3619-5p组的结肠癌细胞HCT116中miR-3619-5p的水平升高(P<0.05),细胞在24、48和72 h的D值均显著降低(P<0.05),迁移和侵袭细胞数减少(P<0.05),Cyclin D1、MMP-2和MMP-9蛋白表达量降低(P<0.05),p21蛋白表达量升高(P<0.05)。这说明过表达miR-3619-5p可以抑制HCT116细胞增殖、迁移和侵袭。详见图2。
2.3 抑制PFKFB3表达对结肠癌细胞HCT116增殖、迁移和侵袭的影响转染si-PFKFB3组的结肠癌细胞HCT116中PFKFB3的水平降低(P<0.05),Cyclin D1、MMP-2和MMP-9蛋白表达量降低(P<0.05),p21表达量升高(P<0.05),细胞在24、48和72 h的D值均显著降低(P<0.05),迁移、侵袭细胞数减少(P<0.05)。这说明抑制PFKFB3可以抑制HCT116细胞增殖、迁移和侵袭。详见图3。

注:A.抑制PFKFB3表达对结肠癌细胞HCT116 PFKFB3、Cyclin D1、p21、MMP-2和MMP-9蛋白表达的影响;B.抑制PFKFB3表达对结肠癌细胞HCT116增殖的影响;C.抑制PFKFB3表达对结肠癌细胞HCT116迁移和侵袭的影响(结晶紫染色,×200)。与si-NC组比较,*P<0.05。图3 抑制PFKFB3表达对结肠癌细胞HCT116增殖、迁移和侵袭的影响
2.4 miR-3619-5p靶向调控PFKFB3的表达StarBase预测结果显示,miR-3619-5p与PFKFB3序列中含有互补的位点(图4A)。双荧光素酶报告试验结果显示,与miR-NC组比较,miR-3619-5p组WT-PFKFB3的萤火虫荧光素酶相对活性显著下降(P<0.05),而MUT-PFKFB3的萤火虫荧光素酶相对活性没有明显变化(图4B)。Western blotting结果显示,上调miR-3619-5p可降低PFKFB3水平,下调miR-3619-5p可显著提高PFKFB3水平(图4C)。这说明miR-3619-5p可靶向负调控PFKFB3的表达。
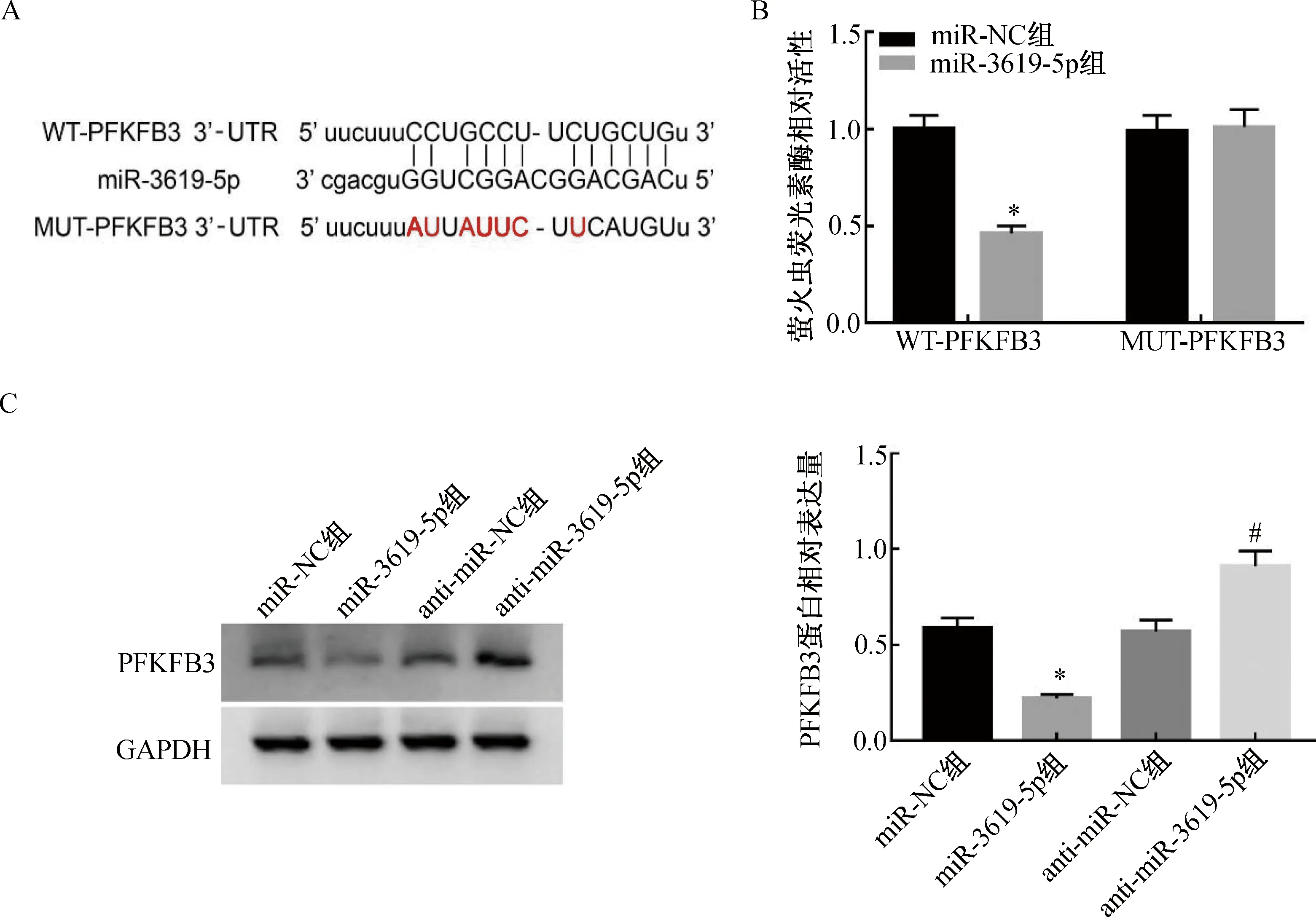
注:A. PFKFB3的3'-UTR中含有与miR-3619-5p互补的核苷酸序列;B. 双荧光素酶报告试验;C. miR-3619-5p调控PFKFB3蛋白的表达。与miR-NC组比较,*P<0.05;与anti-miR-NC组比较,#P<0.05。图4 miR-3619-5p靶向调控PFKFB3的表达
2.5 PFKFB3过表达逆转miR-3619-5p过表达对结肠癌细胞HCT116增殖、迁移和侵袭的作用为确认miR-3619-5p是否通过调控PFKFB3影响结肠癌细胞HCT116的恶性生物学行为,在上调miR-3619-5p的同时过表达PFKFB3。结果显示,与miR-3619-5p+pcDNA组比较,miR-3619-5p+pcDNA-PFKFB3组的HCT116细胞中PFKFB3的水平增加,细胞D值在24、48和72 h均升高,侵袭和迁移细胞数增加,Cyclin D1、MMP-2和MMP-9蛋白水平升高,p21蛋白水平降低(P<0.05)。这说明过表达PFKFB3可逆转miR-3619-5p过表达对HCT116细胞增殖、侵袭和迁移的影响。详见图5。
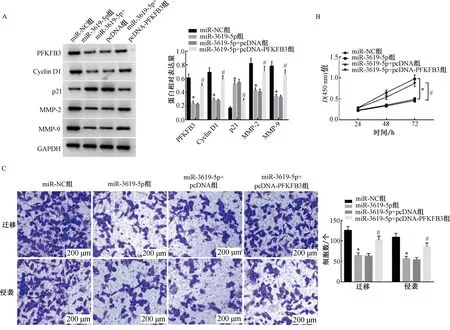
注:A.PFKFB3和细胞增殖、迁移、侵袭相关蛋白的表达;B. PFKFB3过表达逆转了miR-3619-5p过表达对结肠癌细胞HCT116增殖的作用;C.PFKFB3过表达逆转了miR-3619-5p过表达对结肠癌细胞HCT116迁移和侵袭的作用 (结晶紫染色,×200)。与miR-NC组比较,*P<0.05;与miR-3619-5p+pcDNA组比较,#P<0.05。图5 PFKFB3过表达逆转miR-3619-5p过表达对结肠癌细胞HCT116增殖、迁移和侵袭的作用
3 讨论
miRNA在多种恶性肿瘤中表达上调或下调。研究发现,在结肠癌患者血清或肿瘤组织中有多种miRNA表达异常,这可能有助于结肠癌的诊断、治疗、临床疗效评估和发现新的治疗靶点[7-8]。研究发现,miR-3619-5p在非小细胞肺癌患者血清[9]、顺铂耐药的皮肤鳞状细胞癌(cutaneous squamous-cell carcinoma,CSCC)细胞[10]中表达下调,发挥抑癌的作用,其过表达可抑制肺癌细胞的生长和侵袭,还可抑制CSCC细胞的增殖和顺铂抵抗。在甲状腺癌(thyroid carcinoma,TC)中,miR-3619-5p是LINC01410的作用靶点,LINC01410/miR-3619-5p/FOXM1正反馈环可调节TC细胞增殖和凋亡[11]。以上研究结果均说明,miR-3619-5p与恶性肿瘤的进展密切相关,但其在结肠癌中的表达和作用尚不清楚。本研究分别检测了35例结肠癌组织和癌旁组织,结果显示miR-3619-5p在结肠癌组织中低表达。并且,过表达miR-3619-5p可提高p21蛋白表达,抑制Cyclin D1、MMP-2和MMP-9蛋白表达,抑制结肠癌细胞HCT116增殖、迁移和侵袭,这说明过表达miR-3619-5p可抑制结肠癌进展。
此外,本研究通过StarBase预测发现,PFKFB3序列中含有与miR-3619-5p互补的位点,提示miR-3619-5p与PFKFB3之间可能是靶向结合关系。PFKFB3是糖酵解的重要调节因子,也是DNA双链断裂同源重组修复的关键因子。PFKFB3在癌细胞中广泛高表达,具有致癌性,与癌细胞增殖、血管侵袭、耐药和肿瘤微环境有关[12],已成为一种新的抗癌靶点[13]。研究发现,在肿瘤异种移植模型中,抑制PFKFB3可增强癌细胞对顺铂的敏感性[14]。PFKFB3在肝细胞癌[15]、肺腺癌[16]、乳腺癌[17]等恶性肿瘤中高表达,调控癌细胞的增殖、迁移、侵袭、血管生成及耐药性等。PFKFB3在结肠癌组织及结直肠腺癌组织中同样高表达,其高表达与肿瘤大小、分化程度、侵袭、转移及患者生存期有关[6,18]。本研究发现,PFKFB3在结肠癌组织中表达上调,且抑制PFKFB3可抑制结肠癌细胞HCT116增殖、迁移和侵袭。PFKFB3可以被多种miRNA调控,如miR-449c通过靶向PFKFB3抑制胃癌细胞的迁移和侵袭[19],miR-488通过靶向PFKFB3抑制前列腺癌细胞的增殖和糖酵解[20],miR-26b通过下调PFKFB3表达抑制骨肉瘤细胞的迁移和侵袭[21]。本研究双荧光素酶报告试验和Western blotting结果显示,miR-3619-5p可靶向负调控PFKFB3的表达;通过同时过表达miR-3619-5p和PFKFB3的试验发现,过表达PFKFB3可逆转miR-3619-5p过表达抑制HCT116细胞增殖、侵袭和迁移的作用,间接验证了在结肠癌细胞HCT116中miR-3619-5p对PFKFB3有负调控关系。本研究中,患者样本PFKFB3 mRNA与蛋白变化倍数一致,提示体内PFKFB3的表达调控主要是以转录调控为主。miRNA主要通过转录后水平调控蛋白表达,但是患者样本中PFKFB3在转录水平已经变化,并与蛋白变化倍数一致,这无法排除miRNA主要通过转录调控PFKFB3。因此,miR-3619-5p对PFKFB3的具体调控机制仍值得进一步探索。
综上所述,本研究显示在结肠癌组织中miR-3619-5p下调,PFKFB3上调,miR-3619-5p可靶向PFKFB3抑制HCT116细胞的增殖、迁移和侵袭。这表明miR-3619-5p和PFKFB3可能是结肠癌治疗的潜在分子靶点。

