细胞中溶酶体相关的自噬调控
周程,潘光玉,廖洪涛,谭宁
(1.桂林医学院 a.基础医学院免疫学教研室,b.研究生学院,c.生物技术学院,d.科学实验中心,广西 桂林 541000;2.广西全生命周期健康保健研究重点实验室,广西 桂林 541000)
溶酶体是自噬、内吞作用降解的场所,被认为是细胞内的“清道夫”。19世纪中期,de Duve在研究胰岛素的作用机制时,在细胞内偶然发现包含溶解活性的囊样结构,随后被命名为溶酶体[1]。由于溶酶体液泡ATP酶(vacuolar ATPases,V-ATPases)维持溶酶体的酸性环境[2],再加上管腔内大量的水解酶,形成了一个适合分解主要大分子的细胞器,包括糖类、脂质和蛋白质[3]。这些大分子一旦降解,产生的非酯化脂肪酸、单糖和氨基酸就会通过特定的通透酶运输至细胞质,然后被细胞合成代谢过程重新利用[4]。此外,除溶酶体进行的基础水平降解过程外,在饥饿和应激过程中,细胞自噬的自我分解代谢途径也与溶酶体的分解代谢功能密切相关。
随着研究的进展,新的研究发现细胞自噬的主要调节因子哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)定位于溶酶体表面[3]。这提示溶酶体不再只是一个执行简单降解功能的细胞器,也可以作为代谢信号传递的平台,可以检测并传递细胞信号,执行下游应答并产生新的应答传递,是一个动态的集成信号平台。现就溶酶体的基本情况、参与的自噬生物过程、溶酶体与自噬信号AMP活化的蛋白激酶(AMP-activated protein kinase,AMPK)和mTORC1的调控关系以及以溶酶体为靶向的抗肿瘤治疗进展予以综述,以丰富溶酶体信号网络,为肿瘤治疗提供新思路。
1 溶酶体概述
1.1溶酶体的生物发生 溶酶体是存在于真核细胞中的单层囊泡状细胞器,根据细胞类型溶酶体从不同的降解活性、腔内pH值、降解底物通道、形态等方面形成异质种群。溶酶体主要起源于细胞内的囊泡运输系统,经细胞内吞作用形成内吞小泡,摄入细胞外大分子物质并运输至早期内吞体,再通过晚期内吞体进一步形成溶酶体。
在细胞内吞过程中,细胞外和细胞质膜的分子被内化(如网格蛋白介导的内吞作用),在该过程中,富集在质膜亚结构域内的内吞底物通过内陷最终与质膜分离,释放出一个内吞小泡。内吞小泡含有特定的Rab GTP酶和可溶性N-乙基马来酰亚胺敏感因子附着蛋白受体复合体(soluble N-ethylmaleimide-sensitive factor attachment protein receptors complex,SNARE)介导其与早期内吞体融合。早期内吞体是一种小泡状结构的聚集体,其作用是对细胞内待降解的底物进行分类,回收到细胞质膜,或将内吞小泡回收至高尔基体,或输送至晚期内吞体,最终在溶酶体中降解[5]。Rab5可识别典型的早期内吞体,有助于内吞小泡和其他早期内吞体的系链和融合,使早期内吞体成熟为多泡体,然后变成晚期内吞体。其中,Rab5逐渐被同一内吞体上的Rab7a替换,这种替换不仅有助于促进早期内吞体成熟,还可诱导新的功能完整的Rab5阳性早期内吞体形成[6]。当Rab7被激活后,Rab7通过与Rab7相互作用的溶酶体蛋白和微管依赖性动力蛋白结合,并通过与卷曲螺旋结构域蛋白1和运动蛋白结合,从而调节晚期内吞体的定位。晚期内吞体接收来自内质网和高尔基网新合成的溶酶体膜蛋白和水解酶,最终转变为溶酶体[5]。
1.2溶酶体的生物功能 溶酶体富含多种水解酶,位于膜上的V-ATPases维持内腔pH值<5,因此被称为细胞的水解中心[2]。溶酶体可以储存额外的离子和代谢物,包括Ca2+、磷酸盐、ATP和Zn2+[7],作为细胞消化的主要场所,溶酶体还可通过回收和提供大量有价值的组分(如氨基酸、糖类、脂类和核酸酶)来支持细胞的功能。此外,作为细胞自噬的最终降解场所,溶酶体能够感知细胞内状态,包括营养、能量水平以及有害因素,这与mTORC1[8]密切相关。mTORC1通过抑制自噬起始复合物和转录因子EB的核移位而被激活,从而启动促生长过程和抑制自噬,并控制溶酶体和自噬基因的转录水平[9]。在饥饿信号的刺激下,mTORC1与溶酶体分离,AMPK被激活,从而诱导自噬[8]。
除细胞代谢功能外,溶酶体在免疫反应[10]和膜修复[11]过程中也发挥重要作用。在免疫过程中,溶酶体能够检测到早期感染,并有助于促进免疫反应以抵御新出现病原体的攻击。在膜修复中,溶酶体可以感应到质膜和内部膜室的损伤,从而启动膜修复或清除机制。
2 溶酶体与自噬生物过程
2.1溶酶体与自噬底物的降解 细胞自噬是一种高度保守的分解代谢过程,细胞中许多成分的清除均依靠此途径。根据底物进入溶酶体途径不同可将自噬分为3类:巨自噬、微自噬和分子伴侣介导的自噬。微自噬是通过溶酶体膜内陷的形成,将小的胞质碎片摄取到溶酶体中;分子伴侣介导的自噬则对含有赖氨酸-苯丙氨酸-谷氨酸-精氨酸-谷氨酰胺样基序的底物具有高度选择性[12];巨自噬的特征是形成双层膜结构的自噬体,然后与溶酶体融合形成自噬溶酶体,能降解和再循环被吞噬的物质[13]。在细胞自噬最后的降解阶段,自噬体内膜降解后,溶酶体酶进入自噬底物。60多种溶酶体水解酶[3]协同作用,消化核酸、脂质、细菌等各种被隔离入自噬溶酶体的物质[14]。研究表明,与自噬蛋白无明显关联的疾病中,自噬功能受损可导致溶酶体酸化作用削弱,用酸性纳米微粒、药物或哺乳动物雷帕霉素靶蛋白抑制剂处理溶酶体可以恢复自噬通量,表明酶功能正常的重要性[15]。
2.2溶酶体与自噬溶酶体形成 自噬的一个关键步骤是自噬体通过与溶酶体融合获得降解酶。自噬体通过Rab GTP酶、锚定因子和SNARE,经过内溶酶体系统不同阶段的多个融合过程,最终形成具有降解功能的自噬溶酶体[16]。其中,Rab7通过其效应因子Pleckstrin同源结构域包含蛋白家族成员1、卷曲螺旋结构域蛋白1、同型融合和蛋白质分选复合体结合微管相关蛋白1轻链3,促进溶酶体和自噬体的融合[17]。
自噬体与溶酶体融合是由突触融合蛋白17(syntaxin 17,STX17)-突触小体相关蛋白(synaptosomal-associated protein,SNAP)29-囊泡相关膜蛋白(vesicle-associated membrane protein,VAMP)7/VAMP8或STX7-SNAP29-YKT6(YKT6 v-SNARE homolog)之一直接介导[16,18]。在自噬体-溶酶体融合过程中,同型融合和蛋白质分选复合体能够直接或通过Pacer与溶酶体ADP核糖基化因子样蛋白8B(ADP-ribosylation factor like protein 8B,Arl8b)和自噬体Qa-SNARE STX17相互作用[15,19]。STX17是哺乳动物中发现的第一个自噬体SNARE。STX17定位于自噬体,VAMP7或VAMP8定位于溶酶体或晚期内吞体,通过招募胞质中含有SNAP29的两个SNARE结构域,使SNARE蛋白组装成反式SNARE复合物[20]。当干扰小RNA治疗或药物抑制急性消耗STX17时可抑制自噬通量,而慢性缺乏STX17则无明显作用[15]。在哺乳动物中,YKT6定位于自噬体,并与SNAP29和Qa-SNARE STX7形成复合物,其作用可能与STX17-SNAP29-VAMP7/VAMP8复合物相同。
2.3溶酶体与自噬溶酶体循环 在长期的自噬过程中,持续的自噬体-溶酶体融合导致大量溶酶体被消耗[21]。除了溶酶体的生物发生外,细胞还通过自噬溶酶体再生(autophagic lysosome reformation,ALR)补充其溶酶体储存数量,这是一个在长时间饥饿和溶酶体大量消耗的情况下从自噬溶酶体再生溶酶体的过程[22-23]。
ALR开始于mTORC1的重新激活。在长时间的持续自噬过程中,自噬溶酶体内的物质消化释放出一系列必需的氨基酸和能量,这些氨基酸和能量重新激活mTORC1[24]。在ALR过程中,自噬溶酶体中管状结构延伸,形成原溶酶体,然后成熟为溶酶体,以实现自噬循环过程[21]。磷酸化紫外线抵抗相关基因激活Ⅲ类磷脂酰肌醇-3-激酶/液泡分选蛋白34在自噬溶酶体上生成磷脂酰肌醇-3-磷酸盐,其水平可决定小管化率[22]。磷脂酰肌醇-3-磷酸盐参与spastizin和spatacsin的募集,spastizin和spatacsin是两种功能未知的蛋白质,但据报道其是自噬溶酶体小管形成所必需[25]。管状结构的形成首先需要mTORC1通过磷脂酰肌醇-4-磷酸5-激酶1型β在成熟的自噬溶酶体上催化合成磷脂酰肌醇-4,5-二磷酸,后者与网格蛋白、衔接蛋白2形成有助于膜变形的复合物[26]。然后这一出芽结构通过驱动蛋白家族成员5B的募集形成小管,驱动蛋白家族成员5B是一种结合磷脂酰肌醇-4,5-二磷酸的运动蛋白[27]。随后在磷脂酰肌醇-4-磷酸5-激酶1型α的驱动下,磷脂酰肌醇-4,5-二磷酸在远端切断小管,使网格蛋白-动力蛋白复合物释放原溶酶体[26]。肿瘤坏死因子-α诱导蛋白8样蛋白2可以通过调节Ras相关的C3肉毒素底物1(Ras-related C3 botulinum toxin substrate 1,RAC1)-mTORC1轴影响自噬溶酶体再生,并推测肿瘤坏死因子-α诱导蛋白8样蛋白2在ALR过程中可能通过减少磷脂酰肌醇-4,5-二磷酸在脂质双层上的分布而直接破坏自身溶酶体小管的形成[28]。
3 溶酶体与自噬信号调控
自噬在真核细胞中扮演重要角色,在高等真核生物中,自噬参与多种过程,如细胞死亡、炎症和免疫代谢等[29-30]。自噬的调节机制复杂,各种信号级联和调节机制调节自噬活性,但调控自噬的主要信号主要有AMPK和mTORC1。
3.1溶酶体与自噬能量调控信号AMPK AMPK是一种由α催化亚基、调节性β和γ亚基组成的异三聚体蛋白,是细胞能量主要细胞感受器,可监测AMP/ATP的比值,在低能量水平下促进分解过程[31]。一般情况下,ATP结合的AMPK将3个亚基维持在一个非活动池中。但在饥饿、缺氧等应激状况下,细胞能量不足,导致AMP/ATP的比值升高,高水平的AMP与ATP竞争结合AMPK γ调节亚基,从而释放α催化亚基,使其作用于许多刺激分解代谢和抑制合成代谢过程的靶点[32]。而基于AMPK的途径对缺氧和DNA损伤等应激的能量和感应发生在溶酶体表面。较低能量状态下,轴抑制蛋白(axis inhibition protein,AXIN)在肝激酶基因B1(liver kinase B1,LKB1)、AMPK、Ragulator p18亚基和V-ATPases之间形成复合物,其中V-ATPases促进AXIN-Ragulator相互作用,AMPK β亚基的肉豆蔻酰化有助于AMPK定位于溶酶体膜[33-34]。这一过程最终使LKB1磷酸化AMPK α亚基的Thr172位点,释放催化亚基,从而起到抑制合成代谢和促进分解代谢的作用[35]。
近年研究发现,AMPK调节中心是由溶酶体的糖酵解副产物和酶调节,糖酵解产物1,6-二磷酸果糖(fructose-1,6-biphosphate,FBP)在低水平的情况下能够促进AMPK活化和随后mTORC1的失活[33]。醛缩酶是一种丙酮酸激酶的激活剂,可能是FBP理想的传感器,同时可作为一个监测器,在细胞能量状态下降前感知到可用于分解代谢的葡萄糖水平下降,并以一种独立于AMP/ADP的方式激活AMPK[32]。当醛缩酶与FBP结合时,醛缩酶定位于溶酶体,在溶酶体中与V-ATPases相互作用,破坏AXIN/LKB1与V-ATPases受体复合体的相互作用,从而促进mTORC1活化,抑制自噬。但在低糖条件下,FBP水平下降,醛缩酶与FBP结合减少,促进了AXIN/LKB1-Ragulator-V-ATPases复合物的组装,该复合物促进AMPK磷酸化,激活自噬,并通过损害Ragulator和Rag GTP酶使mTORC1脱离溶酶体[33]。此外,AMPK也参与调节代谢,以应对其他应激反应。如抑癌蛋白p53能够诱导Sestrins的表达,进而磷酸化AMPK的α亚基[36]。同时,AMPK还可通过促进去磷酸化和核易位激活转录因子EB,且不依赖于mTOR信号[37]。总之,溶酶体通过与AMPK结合促进分解代谢和应对应激反应,整合能量,见图1。
3.2溶酶体与自噬氨基酸调控信号mTORC1 mTORC1的激活需要两个主要步骤:首先mTOCRC1通过Rheb GTP酶定位到溶酶体,然后与GTP结合形式的Rheb GTP酶相互作用。Rag GTP酶作为mTORC1在溶酶体上的锚定点受Ragulator调控,Ragulator是由5个亚基[p18、p14、MP1、C7orf 59和乙型肝炎病毒X相互作用蛋白(hepatitis B X-interacting protein,HBXIP)]组成的蛋白质复合物[24]。Ragulator通过p18亚基的N端锚定在溶酶体上,该亚基具有肉豆蔻酰化和棕榈化位点[38]。然后,p18和MP1-p14亚基将Rag GTP酶拴系在溶酶体上[39]。Rag家族的小GTP酶由两个特殊的异二聚体对(RagA/RagB、RagC/RagD)组成[40]。当Rag GTP酶被激活时,RagA/RagB是GTP结合形式的,RagC/RagD是GDP结合形式的,而非活性Rag GTP酶具有相反的核苷酸状态[24]。当特异性氨基酸刺激时,Ragulator作为Rag的鸟嘌呤核苷酸交换因子作用于RagA/RagB,后者表现为GTP结合形式[40]。此时,Rag GTP酶能够结合和锚定mTORC1至溶酶体表面。
mTORC1定位溶酶体这一步骤还受特异性氨基酸,特别是亮氨酸、精氨酸、谷氨酸和甲硫氨酸的有效性控制[7,31]。溶酶体利用“内-外”机制和胞质机制来感知和响应与调节mTORC1活性机制相关的氨基酸水平。
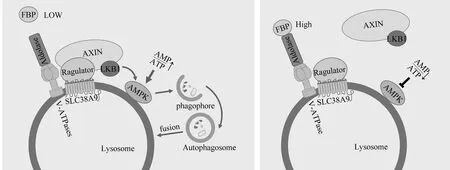
AMPK的激活 AMPK的抑制
内-外信号依赖于腔内氨基酸感应。首先,溶酶体精氨酸结合钠偶联氨基酸转运体溶质载体家族38成员9(solute carrier family 38 member 9,SLC38A9)经过构象变化,使其可能与Ragulator复合物相互作用,从而激活mTORC1[41]。此时,精氨酸的结合允许SLC38A9作为鸟嘌呤核苷酸交换因子与RagA GTP酶相互作用并刺激GTP负载[42]。然后,RagA GTP酶从SLC38A9中释放出来,与mTORC1结合。研究发现,溶酶体中高水平的精氨酸能刺激SLC38A9将腔内氨基酸如亮氨酸转运至胞质中[43]。管腔内亮氨酸是溶酶体募集mTORC1的有效激活剂,其在溶酶体管腔内的储存涉及多种机制。首先,随着富含营养条件下亮氨酸浓度的增加,卵巢滤泡激素通过损害溶酶体质子协助氨基酸转运蛋白1使溶酶体内存留的亮氨酸增加;相反,在饥饿条件下,质子协助氨基酸转运蛋白1可促进溶酶体中亮氨酸的排出[44]。另一方面,胞质中的亮氨酸可以传递到溶酶体内并在溶酶体内聚集,其原因是溶酶体膜蛋白溶酶体相关跨膜蛋白4B保留了溶酶体上的亮氨酸转运体L氨基酸转运体1-细胞表面抗原4F2重链,然后通过递入亮氨酸来交换非必需氨基酸[45]。高水平的腔内亮氨酸通过V-ATPases促进ATP水解,从而与Ragulator-Rag复合物相互作用并刺激其支持mTORC1招募至溶酶体[45-46]。无论何种机制,最终均通过刺激Ragulator和Rag GTP酶影响mTORC1定位。
细胞液中的精氨酸和亮氨酸也被细胞液中的Rag基因的间隙蛋白活化物1(GAP activity towards Rag 1,GATOR1)-GATOR2复合物所感知和调控,从而调节mTORC1向溶酶体的募集[47-48]。GATOR1复合物被一种新识别的蛋白复合物KICSTOR招募到溶酶体中,然后作为RagA/B GTP酶的GAP,与Ragulator复合物竞争,从而取代溶酶体中的mTORC1[47,49]。在氨基酸存在下,GATOR2复合物与GATOR1结合并损害GATOR1,引起RagA/B上的GTP负载并激活mTORC1,从而抑制自噬[47]。GATOR1-GATOR2输出之间的平衡取决于多种细胞质蛋白复合物,包括精氨酸和亮氨酸及其他代谢物。首先,亮氨酸与Sestrins(一类高度保守的应激蛋白)结合以调节GATOR2,即高水平的亮氨酸增加了亮氨酸结合Sestrins的比例,从而抑制Sestrins,使其无法阻止GATOR2对GATOR1的损害[7]。相反,胞质亮氨酸水平降低会增加不含亮氨酸的Sestrins数量,这些Sestrins结合并阻断GATOR2对GATOR1的损害,从而使GATOR1抑制GTP结合的RagA/B。另外,精氨酸能够结合并阻断另一种GATOR2抑制剂CASTOR1(cytosolic arginine sensor for mTORC1 subunit 1),因此,在高水平精氨酸下,CASTOR1被精氨酸结合并抑制,释放GATOR2以损害GATOR1[7]。相反,在精氨酸水平较低的情况下,更多的CASTOR1可以自由阻断GATOR2,释放GATOR1来阻断RagA/B介导的mTORC1的募集,见图2。
4 以溶酶体为靶向的抗肿瘤治疗
分解代谢亢进是肿瘤细胞的主要特征之一,也是肿瘤进展和转移的主要原因,高合成率保证了肿瘤细胞的快速增殖,这在很大程度上取决于细胞成分的降解和再循环[50]。因此,溶酶体功能及功能障碍在肿瘤的发生发展中起重要作用。肿瘤细胞能够在饥饿、应激条件下促进自噬,而自噬通过降解损伤的细胞器、异常聚集的蛋白质来产生营养物质及能量。溶酶体作为自噬底物最终的降解场所,代谢过程中的某些产物是肿瘤细胞增殖的物质基础。针对癌症中溶酶体的药物主要有氯喹衍生物、V-ATPases抑制剂、酸性鞘磷脂酶抑制剂、组织蛋白酶抑制剂、热激蛋白70抑制剂五大类,除羟基氯喹外,大多数药物仍处于临床前期实验研究阶段,并在许多临床试验中与其他抗癌治疗方法相结合进行广泛的试验[51]。见表1。
除以上五大类抑制剂外,一种新型溶酶体自噬抑制剂ROC-325也在临床前期研究中发挥出极大的潜力。ROC-325是一种含有羟基氯喹和硫蒽酮重要结构的二聚体小分子,其抗癌活性和自噬抑制能力均强于羟基氯喹,且能诱导LC3B斑点的形成、自噬体的积累、自噬通量阻断等自噬抑制的所有标志性特征[59]。青蒿素是治疗疟原虫引起的疟疾的一线药物。然而新的研究表明,青蒿素诱导的活性氧类导致急性髓系白血病溶酶体破裂,释放的溶酶体酶激活促凋亡蛋白导致细胞死亡,表明青蒿素作为溶酶体靶向治疗癌症的潜在临床用途[60]。

mTORC1的激活 mTORC1的抑制

表1 以癌症溶酶体为靶向的治疗药物
目前,溶酶体特异性靶向药物的数量较少,许多表明靶向溶酶体成分的药物也被发现能够与非溶酶体受体相互作用,从而降低了其疗效和安全性[61]。如氯喹和羟基氯喹是靶向溶酶体的药物,其可抑制溶酶体酸化,从而影响溶酶体的整体功能并削弱自噬蛋白的降解,但也对人体产生不可忽略的不良反应[61]。
5 小 结
溶酶体参与自噬过程的终末阶段,清除受损物质并提供营养,从而维持细胞内稳态。这一过程需要溶酶体感知细胞内营养水平,协调底物降解和细胞代谢。研究表明,溶酶体是多种信号通路的交汇点,为细胞合成代谢和分解代谢信号提供平台[7]。溶酶体对AMPK和mTORC1信号的调节影响自噬的进程,深入研究AMPK和mTORC1信号通路有助于丰富溶酶体代谢信号平台信号分子网络及明确其机制。肿瘤的发生发展与肿瘤代谢重构密切相关,研究溶酶体对代谢信号的调控,有助于进一步探索溶酶体信号在癌症发生发展中作用的分子机制,促进靶向溶酶体的抗肿瘤治疗及药物研发。

