光遗传学技术应用于疼痛领域的研究进展
张力,梅伟,王培民
(南京中医药大学附属医院骨伤科,南京 210029)
疼痛是临床常见症状和亟待解决的难题,为十大致残病因之一[1]。近年研究致力于探索外周和中枢神经系统对伤害性刺激的感知和反应,以期阐释疼痛的发生及痛觉敏感的维持。关于膝骨关节炎疼痛的研究显示,机械敏感离子通道瞬时受体电位香草酸亚型4、冷刺激敏感离子通道瞬时受体电位通道A1、瞬时受体电位melastatin 8具有介导机械痛敏、冷痛敏的重要作用,并提出“以痛为枢、截断扭转”控制膝骨关节炎疼痛的治疗理念[2-4]。近年研究表明,疼痛是涉及感觉识别、情感激励和认知维度的综合体验[5],因此疼痛研究不仅需要关注痛觉的感知和传导,还需强调痛觉敏化的形成。此外,光遗传学技术利用遗传学方法使光敏感通道蛋白在参与疼痛感知的特定离子通道、细胞或组织中稳定表达,实现了光照控制下的疼痛信息处理,并使自由行为动物感觉传入、脊髓神经元活动、皮质加工处理疼痛信息等的操作迅速进展,且广泛运用于疼痛及其敏化特征的研究。现就光遗传学技术应用于疼痛领域的研究进展予以综述,以期推动光遗传学技术在疼痛研究中的应用,并促进疼痛机制的研究以及镇痛治疗的进步。
1 疼痛与痛觉敏化
1.1疼痛的感知与传导 疼痛的感知始于感觉神经纤维中表达的外周伤害感受器对伤害性刺激的处理,随后疼痛信号传递至初级感觉传入的外周终端——背根神经节(dorsal root ganglia,DRG)。疼痛信息在DRG完成整合处理后传递至脊髓背角,随后到达脊髓上节段(包括脑干、皮质下结构及皮质)并产生疼痛感觉[6]。值得注意的是,脊髓及脊髓上节段均可对中枢神经系统疼痛信号进行抑制性处理,疼痛感知可理解为一种疼痛传递/抑制传递的失衡,这可能是中枢敏化形成以及导致不同个体对疼痛耐受差异的原因。因此,完整的疼痛体验是感觉识别、情感激励和认知维度的综合评价[7],见图1。

DRG:背根神经节
位于DRG的痛觉伤害性感受器种类多元、结构复杂。DRG属于假单极神经元,中枢突和外周突合并成“T”型结构连接细胞体,外周突分布于体表、骨、骨骼肌,感知伤害性刺激,中枢突终止于脊髓背角Ⅰ层边缘和Ⅱ层胶质区[8]。常根据髓鞘特性、感受刺激类型、电压门控通道的不同对痛觉感受器进行分类,如机械敏感离子通道瞬时受体电位香草酸亚型4、冷刺激敏感离子通道瞬时受体电位通道A1、瞬时受体电位melastatin 8;此外,参与炎性疼痛和神经病理性疼痛的伤害性感受器也不同[9]。
1.2痛觉敏化的形成 病理状态下各个脊髓节段疼痛信号的传导均与正常状态不同,相应的病理改变形成了痛觉敏化的结构基础,伤害局部和DRG参与外周敏化,而脊髓及脊髓上节段则参与了中枢敏化[10]。
局部炎症或损伤引起炎症介质释放,痛觉感受器的阈值降低,进而使DRG神经元兴奋、放电频率增加,甚至产生异常放电,形成外周敏化。因此,外周敏化主要涉及炎症环境的维持、离子通道的敏化以及疼痛相关受体的活化[11]。经典的促炎因子白细胞介素-1β、白细胞介素-17、白细胞介素-18、肿瘤坏死因子-α等不仅参与了局部组织的炎症反应级联放大,还参与了外周敏化的形成[12];电压门控钾通道家族、电压门控钠通道家族、质子门控离子通道、瞬时受体电位通道等离子通道的异常活化通过异常的生物电传导参与外周敏化[13];此外,DRG膜表面G蛋白偶联受体、神经营养因子受体等疼痛相关受体也通过释放神经肽(P物质和降钙素基因相关肽)改变细胞内能量代谢、调节磷酸化水平等,从而影响外周敏化[14]。
脊髓节段的中枢敏化较外周敏化更复杂,既受外周传入的影响,又受脊髓上节段的调节,同时脊髓背角神经元自身的改变也是脊髓节段中枢敏化的重要因素。外周敏化引起的DRG过度放电引起脊髓节段免疫细胞(小胶质细胞)的活化,从而导致神经炎症,随后出现与外周敏化相似的致敏过程[15]。中枢节段的神经炎症直接作用于神经元轴突、突触周围,更易于造成局部的神经损伤[16]。近年研究发现,轴突损伤后的芽生是中枢敏化的重要成因,如DRG的轴突芽生形成“篮状”结构包绕DRG神经元胞体、DRG轴突芽生异位侵入脊髓背角Ⅲ、Ⅳ层,这些均与脊髓节段的中枢敏化高度相关[17]。脊髓节段的下行传入主要起于中缝大核的5-羟色胺能神经元,起自蓝斑核、脑桥的去甲肾上腺素能神经元和来自延髓的γ-氨基丁酸能神经元。在正常生理状态下,去甲肾上腺素能轴突释放的去甲肾上腺素通过刺激α2肾上腺素能受体在脊髓背角产生抑制神经元兴奋的作用,而外周敏化则减弱了这些下行传入的疼痛抑制作用,使脊髓背角神经元的兴奋性相对增加,推动中枢敏化[18]。此外,脊髓背角神经元分为中间神经元和投射神经元,中间神经元的兴奋性异常或投射神经元的突出可塑性改变均能在脊髓节段对中枢敏化进行调节[19]。
脊髓上节段的中枢敏化是参与疼痛感知、调控多个脑结构域共同作用的结果,是多个神经环路易化和抑制的综合结果。神经影像学研究发现了伤害性刺激激活的脑区域,包括初级躯体感觉皮质、次级躯体感觉皮质、前扣带回皮质(anterior cingulate cortex,ACC)、前额叶皮质(prefrontal cortex,PFC)、岛叶、杏仁核、丘脑、小脑以及中脑区——腹侧被盖区和伏隔核[20],上述区域的功能在伤害感觉的背景下存在联系,在执行对疼痛信号的感知调控过程中产生痛苦体验,还可影响多种神经功能(认知、情感、动机等),部分解释了抑郁、焦虑、帕金森病、阿尔茨海默病等对中枢敏化的影响[21]。目前,人们对这些神经通路的具体效应途径的认识仍有限,因此寻找一种能够观察研究特定神经元类型、独立神经通路的技术至关重要。
2 光遗传学
光遗传学利用基因工程技术实现光敏离子通道(opsin)的特异表达,以控制细胞中的信号事件,满足疼痛领域研究中高时间、高空间精度调控神经元活性的要求。Oesterhelt和Stoeckenius[22]于1971年发现了第一个光敏离子通道——细菌视紫红质(一种绿光驱动的质子泵)。1977年,Matsuno-Yagi和Mukohata[23]发现了一种抑制性氯通道——嗜盐菌紫红质(一种黄光驱动的氯离子通道)。蓝光驱动的单价阳离子——视紫红质通道(channelrhodopsin,ChR)[24]的发现实现了动物体内精确敏感的光刺激对神经元细胞膜离子通道的开启或关闭,并实现了对激活特定神经元后动物行为的直接观察[25]。ChR突变体(如ChR2-H134R和ChR2-T159C)的位点突变旨在增加灵敏度和光电流[26]。研究者基于ChR晶体结构设计出介导氯离子的抑制性ChR,进而开发了双稳态变体抑制性ChR,该通道允许短暂的蓝光激活和随后的红光失活[27]。上述光敏离子通道的驱动光源和离子类型见表1。除光敏离子通道外,嵌合光敏感的G蛋白偶联受体、光学激活的μ阿片受体、嵌合视紫红质/β2肾上腺素能受体均被开发应用于细胞内信号通路的研究[28]。
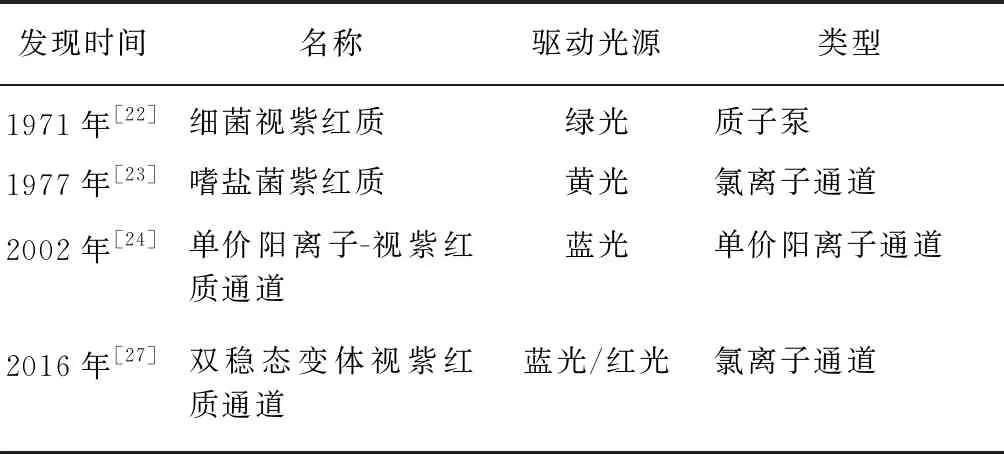
表1 光敏离子通道
遗传学技术针对选定细胞的特异性启动子调控光敏离子通道基因在实验动物中的转录。在疼痛领域的研究中,近85%伤害感受器表达电压门控钠通道NaV1.8,因此,针对NaV1.8启动子选择性地在伤害感受器中表达光敏离子通道有助于对该离子通道的观察[29];表达Mas基因相关G蛋白偶联受体D的神经元能够感受机械性伤害刺激,靶向该受体启动子实现光敏离子通道的表达,有助于机械痛觉敏感的研究[30]。Sanders等[31]成功在Fos阳性神经元中表达光敏离子通道,实现仅对特定事件中受刺激活化神经元的观察。此外,非神经元细胞也可以是光遗传学的研究靶标,如靶向星形胶质细胞胶质纤维酸性蛋白启动子的研究,有助于理解神经元和胶质细胞在疼痛状态中的相互作用[32]。
除在光敏离子通道蛋白开发和使用方面的进展外,光遗传学技术(图2)在基因传递、光的使用等方面也取得了进步。血脑屏障的存在,使蛋白质向大脑的输送十分困难,而以慢病毒或腺病毒为载体递送光敏离子通道蛋白则很好地解决了上述问题。腺病毒具有非致病性、非免疫原性、不裂解细胞等优点,且转染高效稳定。近年来,关于腺病毒载体(腺病毒衣壳蛋白、腺病毒血清)等方面的研究取得了一定的进展,显著提高了其转染效率[33]。有研究尝试利用转基因动物特定细胞表达光敏离子通道,但该方法受到启动子活性的限制,难以实现细胞特异性[34]。此外,光源的使用也一直是光遗传学技术的挑战之一,通过光纤接口与LED或激光二极管系统耦合的轻量柔性光纤将光传输到更深的脑组织,可同时刺激和记录实验动物的特定神经元活动[35]。而闭环电路和电流仪的使用实现了无线光刺激和实时控制,更能模拟自然环境[36]。

图2 光遗传技术示意图
3 光遗传学在疼痛领域的应用
利用光遗传学技术刺激特定的外周伤害性感受器或脊髓、脊髓上中枢神经环路是疼痛领域一种重要的研究手段,该技术在急性疼痛、炎性疼痛、神经病理性疼痛的研究中应用,有助于解析复杂的疼痛通路、阐释疼痛敏化机制以及选择镇痛治疗。
3.1急性疼痛 急性疼痛大多直接源于伤害性刺激,随着原发病的治愈,疼痛也随之消失,但急性疼痛具有痛觉敏化的特点,如果在初始阶段未得到完全控制,则有可能发展为慢性疼痛。速激肽1型神经元是一种与外周伤害刺激高度相关的神经元,Barik等[37]采用cre转基因技术使ChR特异性表达于臂旁核中的速激肽1型神经元,证实臂旁核中速激肽1型神经元的活动极大地影响了急性疼痛引起的跳跃型逃逸反应。故认为,臂旁核是感知急性疼痛的脑分区,且速激肽1型神经元是影响急性疼痛的重要单元。Xu等[38]将腺病毒装载的ChR2注射至PFC下区和边缘区,并使用牙科生物水泥将光纤固定于颅骨,随后应用热板实验测定实验动物的热痛觉敏感,证实PFC的认知功能在疼痛调制中具有重要作用。将ChR2表达在扣带回分裂周围神经元的研究发现了一条ACC-后岛叶神经通路,在没有外周伤害驱动的情况下,其可诱导和维持伤害性疼痛敏化,这对于理解急性疼痛向慢性疼痛过渡的神经元机制具有重要意义[39],即“扣带回分裂-ACC-后脑叶”对疼痛信号的传递可能是急性疼痛发展为慢性疼痛的转折点,具有干预价值。
3.2炎性疼痛 炎性疼痛常由感染和损伤感染引起,具有共同的组织病理,即炎症,绝大部分退行性病变(如颈肩腰腿痛)均属此类,患病人群较多,涵盖范围较广。Zhang等[40]构建弗氏完全佐剂诱导的大鼠炎性疼痛模型,将腺病毒装载的ChR2和嗜盐菌紫红质分别靶向ACC颅内病毒注射并立体定向植入光纤,随后蓝光、黄光各10 s交替照射,分别激活和抑制ACC的神经元活动,证实炎性疼痛对ACC神经回路的破坏增强了厌恶情感体验。Massaly等[41]采用cre转基因技术使弗氏完全佐剂诱导的炎性疼痛模型大鼠腹内侧伏隔核表达强啡肽的神经元具有ChR2背景,从而确认了疼痛引起的负面影响由伏隔核的Kappa阿片系统募集;在辣椒素诱导的炎性疼痛模型中,研究者利用光遗传学技术观察到躯体感觉皮质的兴奋对三叉神经尾核存在抑制效应,进而抑制了疼痛感知,表明皮质三叉神经通路是有效的伤害感受调节通路[42]。综上,ACC、伏隔核、三叉神经尾核是炎性疼痛感知的责任脑区,而强啡肽、Kappa阿片系统、辣椒素受体均对炎性疼痛的调控有干预作用。
3.3神经病理性疼痛 神经病理性疼痛多由神经变性、中枢神经系统可塑性变化及传导异常等引起,如三叉神经痛、带状疱疹后神经痛、糖尿病周围神经病变、神经卡压等。Zhou等[43]在选择性神经损伤模型大鼠的PFC锥体神经元中表达嗜盐菌紫红质,然后选择性地抑制从PFC锥体神经元到伏隔核神经元的轴突投射,结果显示,抑制PFC或其向伏隔核的投射可提高大鼠的疼痛阈值,减少大鼠的厌恶症状,故认为PFC到伏隔核的投射在神经病理性疼痛调节中起重要作用;Watanabe等[44]将ChR2表达在坐骨神经结扎小鼠的腹侧被盖区向伏隔核投射的多巴胺能神经元,结果显示,光激活腹侧被盖区巴胺能神经回路增加了模型小鼠的疼痛阈值,证实中脑多巴胺能神经元活性与伏隔核的抑制作用对调控神经病理性疼痛、癌症疼痛具有重要价值。由此可见,PFC向伏隔核的神经投射以及中脑的多巴胺能神经元活性可能对神经病理性疼痛的调控有重要意义。目前光遗传学在疼痛领域研究的光敏离子通道、遗传学手段、参与疼痛的解剖结构/靶点见表2。

表2 光遗传学在疼痛领域的研究
4 小 结
光遗传学技术能精确靶向特定区域、特点表型、特点时间点的神经元活动,其在疼痛领域的研究得到普遍认可。与传统神经生物学方法相比,光遗传学技术在解析外周伤害器功能、阐释脊髓、脊髓上节段疼痛通路、探索疼痛敏化病理机制等方面具有明显优势,但存在实验成本过高、光敏感蛋白转录稳定性较差等缺点。随着神经科学的不断进步以及Crispr Cas 9等新兴基因编辑工程技术的出现,光遗传学技术将得到更广泛的运用。未来疼痛领域的研究有望在昼夜节律、脑图谱的绘制中取得突破性进展。

