澳洲茄边碱对人肝癌HepG2细胞生长和凋亡的影响及机制初探
吴晶晶 张文娟 张骏鸿 张雅婷 黎莉 卢月 危建安 韩凌









中图分类号 R735.7;R965 文献标志码 A 文章编号 1001-0408(2021)24-2963-07
DOI 10.6039/j.issn.1001-0408.2021.24.04
摘 要 目的:探讨澳洲茄边碱对人肝癌HepG2细胞生长和凋亡的影响,并研究其潜在作用机制。方法:考察0(空白组)~12 μmol/L澳洲茄边碱作用24、48 h对HepG2细胞存活率的影响,0(空白组)、6 μmol/L澳洲茄边碱作用10 d对細胞克隆形成的影响,0(空白组)、4、6、8 μmol/L澳洲茄边碱作用24 h对细胞凋亡率和细胞中B细胞淋巴瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)、胱天蛋白酶3(caspase-3)mRNA表达量以及Bcl-2、剪切的caspase-3(cleaved caspase-3)蛋白表达量和磷酸化腺苷一磷酸活化蛋白激酶α(p-AMPKα)/AMPKα的影响。考察AMPK抑制剂compound C对经6 μmol/L澳洲茄边碱作用24 h后细胞中AMPKα、Bcl-2蛋白表达量的影响。结果:与空白组比较,1~12 μmol/L澳洲茄边碱作用24、48 h均可显著降低细胞存活率(P<0.05),且有浓度依赖趋势,其半数抑制浓度分别为8.310、7.996 μmol/L;经6 μmol/L澳洲茄边碱作用10 d后细胞的克隆形成率显著降低(P<0.05)。6、8 μmol/L澳洲茄边碱作用后细胞凋亡率和细胞中Bax、caspase-3 mRNA及cleaved caspase-3蛋白(除8 μmol/L外)表达量、p-AMPKα/AMPKα(除8 μmol/L外)均显著升高(P<0.05),Bcl-2 mRNA及蛋白表达量均显著降低(P<0.05),部分指标变化有浓度依赖性。compound C可以抑制AMPKα蛋白表达并逆转澳洲茄边碱对Bcl-2蛋白的抑制作用。结论:澳洲茄边碱可以抑制HepG2细胞增殖,诱导其凋亡,作用机制可能与激活AMPK信号通路有关。
关键词 澳洲茄边碱;人肝癌HepG2细胞;生长;凋亡;磷酸化腺苷一磷酸活化蛋白激酶信号通路
Preliminary Study on Effects of Solamargine on the Growth and Apoptosis of Human Hepatocarcinoma Cells HepG2 and Its Mechanism
WU Jingjing1,ZHANG Wenjuan2,ZHANG Junhong1,ZHANG Yating2,LI Li1,LU Yue1,WEI Jian’an1,HAN Ling3,4(1. Research Team of Molecular Biology and System Biology of Chinese Medicine, the Second Affiliated Hospital of Guangzhou University of Chinese Medicine,Guangzhou 510120, China; 2. The Second Clinical College of Guangzhou University of Chinese Medicine, Guangzhou 510120, China; 3. State Key Laboratory of Dampness Syndrome of Chinese Medicine, the Second Affiliated Hospital of Guangzhou University of Chinese Medicine,Guangzhou 510120, China; 4. Guangdong Provincial Key Laboratory of Clinical Research on Traditional Chinese Medicine Syndrome/Guangdong Clinical Research Center for Dermatosis in Chinese Medicine/Guangdong-Hong Kong-Macau Joint Lab for Chinese Medicine and Immune Disease Research, Guangzhou 510120, China)
ABSTRACT OBJECTIVE: To explore the effects of solamargine on the growth and apoptosis of human hepatocarcinoma cells HepG2 and its underlying mechanism. METHODS: The effects of 0(blank group)-12 μmol/L solamargine treatment of 24, 48 h on survival rate of HepG2 cells were investigated. The effects of 0 (blank group), 6 μmol/L solamargine treatment of 10 days on cell clone formation were also investigated. The effects of 0 (blank group), 4, 6, 8 μmol/L solamargine for 24 h on the apoptotic rate of cells, mRNA expression of Bcl-2, Bax and caspase-3, protein expression of Bcl-2 and cleaved caspase-3 as well as ratio of p-AMPKα to AMPKα were all tested. The effects of AMPK inhibitor as compound C on the protein expression of AMPKα and Bcl-2 in cells were investigated after treated with 6 μmol/L solamargine for 24 h. RESULTS: Compared with blank group, 1-12 μmol/L solamargine for 24, 48 h could significantly decrease the survival rates of cells (P<0.05) in a concentration-dependent manner; IC50 of them were 8.310 and 7.996 μmol/L,respectively; the rate of cell clone formation was decreased significantly after treated with 6 μmol/L solamargine for 10 days (P<0.05). The apoptotic rate of HepG2 cells, mRNA expression of Bax and caspase-3, protein expression of cleaved caspase-3 (except for 8 μmol/L) as well as ratio of p-AMPKα to AMPKα (except for 8 μmol/L) were all increased significantly after treated with 6, 8 μmol/L solamargine (P<0.05); mRNA and protein expression of Bcl-2 were decreased significantly (P<0.05); the changes of some indexes were in a concentration-dependent manner. The compound C could inhibit protein expression of AMPKα, and reverse the inhibitory effect of solamargine on Bcl-2 protein. CONCLUSIONS: Solamargine can inhibit the proliferation of HepG2 cells and induce apoptosis, the mechanism of which may be associated with activating AMPK signaling pathway.
KEYWORDS Solamargine; Human hepatocarcinoma cells HepG2; Growth; Apoptosis; AMPK signaling pathway
基金项目:国家自然科学基金(青年科学基金)资助项目(No.81902752);广东省科技计划项目(No.2020B1212030006);广东省自然科学基金项目(No.2020A1515010607);省部共建中医湿证国家重点实验室重点项目(No.SZ2021ZZ29);广东省中医院-瑞博奥研究项目(No.YN2018RBA02)
助理研究员,硕士。研究方向:中西医结合基础。电话:020-39318678。E-mail:wujingjing6028@gzucm.edu.cn
通信作者:研究员,博士。研究方向:中西医结合基础。电话:020-39318678。E-mail:linghan99@gzucm.edu.cn
肝癌是全球最常见的恶性肿瘤之一,也是恶性肿瘤导致患者死亡的第三大原因[1]。目前,手术切除是肝细胞癌的最佳治疗方法,特别是在发病早期且肿块直径小于2 cm时,手术切除是最有效的方法,但患者的5年复发率仍高达68%[2-3]。近年来,化疗和靶向治疗在肝癌的治疗中得到了广泛的应用,其代表药物索拉非尼和仑伐替尼可以明显提高无法进行手术的肝癌患者的生存率[4-5]。然而,分子靶向治疗的耐受性和相对严重的副作用限制了这类药物在临床上的进一步应用[6]。因此,寻找新的肝癌治疗方法和抗肝癌药物意义重大。
澳洲茄边碱(solamargine)是中药龙葵Solanum nigrum L.生物碱中的主要成分,属于甾体生物碱的胆甾烷衍生物,已被证实对非小细胞肺癌、肝癌等多种恶性肿瘤细胞的生长有明显的抑制作用[7-10]。但该成分抑制肝癌细胞生长的分子机制尚不明确。腺苷一磷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是维持细胞能量稳态的重要介质,活化后的AMPK可以通过抑制哺乳动物雷帕霉素靶蛋白信号通路来促进细胞凋亡[11]。基于此,本研究拟探讨澳洲茄边碱对人肝癌HepG2细胞生长和凋亡的影响,以及可能涉及的分子机制,为该成分在肝癌临床治疗领域中的应用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有SYNERGY-H1型多功能酶標仪(美国BioTek公司),TS2型倒置生物显微镜(日本Nikon公司),Centrifuge 5430R型高速离心机、Galaxy 170S型CO2细胞培养箱(德国Eppendorf公司),Novo Quanteon型流式细胞仪(美国ACEA Biosciences公司),ViiA 7型荧光定量聚合酶链反应(PCR)仪(美国ABI公司),Mini-PROTEAN® Tetra cell小型垂直电泳转印系统、ChemiDoc Touch型高灵敏度化学发光成像仪(美国Bio-Rad公司),NanoDrop 2000型超微量分光光度计(美国Thermo Fisher Scientific公司),ELPH 1301S型相机(日本Canon公司)等。
1.2 主要药品与试剂
澳洲茄边碱对照品(批号MUST-20112005,纯度≥98%)购自成都曼斯特生物科技有限公司;二甲基亚砜(DMSO,批号RNBH8343)购自美国Sigma公司;MTT试剂(批号S3444)购自美国MP Biomedicals公司;4%多聚甲醛固定液、结晶紫染色液均购自上海碧云天生物技术有限公司;兔源磷酸化AMPKα(p-AMPKα)(T172)单克隆抗体、兔源AMPKα单克隆抗体、兔源B细胞淋巴瘤2(Bcl-2)单克隆抗体、兔源胱天蛋白酶3(caspase-3)单克隆抗体、兔源β-肌动蛋白(β-actin)单克隆抗体、兔源剪切的caspase-3(cleaved caspase-3)单克隆抗体和RIPA细胞裂解液(批号分别为50081S、5832S、4223S、9665S、4970S、9664S、7723S)均购自美国CST公司;辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(H+L)二抗(批号1706515)购自美国Bio-Rad公司;膜联蛋白Ⅴ(Annexin Ⅴ)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)凋亡试剂盒(批号73001255)购自杭州联科生物科技股份有限公司;DMEM培养基、胎牛血清、青-链霉素溶液和0.25%胰蛋白酶-乙二胺四乙酸(EDTA)消化液均购自美国Gibco公司;BCA蛋白定量试剂盒(批号VK314219)购自美国Thermo Fisher Scientific公司;聚偏二氟乙烯(PVDF)膜购自美国Millipore公司;Trizol试剂(批号74117)购自美国Life Invitrogen公司;Evo M-MLV反转录预混型试剂盒、SYBR® Green Premix Pro Taq HS qPCR Kit(批号分别为AG11728、AG11718)均购自艾科瑞生物科技有限公司;AMPK抑制剂6-{4-[2-(1-哌啶基)乙氧基]苯基}-3-(4-吡啶基)吡唑并[1,5-A]嘧啶对照品(compound C,批号HY-13418A,纯度99.65%)购自美国MCE公司;ECL化学发光超敏显色试剂盒(批号36208ES76)购自翌圣生物科技(上海)股份有限公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 细胞
本研究所用人肝癌HepG2细胞购自广州赛库生物科技有限公司。
2 方法
2.1 澳洲茄边碱溶液的制备
取澳洲茄边碱对照品适量,用DMSO溶解、稀释,制成浓度为50 mmol/L的贮备液,分装后,于-20 ℃冰箱中保存,备用。
2.2 细胞培养
HepG2细胞用含10%胎牛血清、100 u/mL青霉素和100 μg/mL链霉素的DMEM培养基(下文简称“DMEM完全培养基”),在37 ℃、5%CO2细胞培养箱中无菌培养(培养条件下同),每隔24 h换液1次,待细胞生长至70%左右,用0.25%胰蛋白酶-EDTA消化液消化(消化方法下同)传代,待细胞贴壁后,取对数生长期的细胞进行后续实验。
2.3 细胞存活率的检测和澳洲茄边碱作用浓度及时间的筛选
采用MTT法检测细胞存活率。取对数生长期的HepG2细胞,消化后计数,分别以每孔10 000个接种到96孔板中,每孔加入DMEM完全培养基100 μL,培养24 h后,弃去培养基,分别加入含澳洲茄边碱0(空白组)、1、2、4、6、8、10、12 μmol/L的DMEM完全培养基100 μL,每个浓度设置3个复孔。分别培养24、48 h后,每孔加入5 mg/mL的MTT试剂10 μL,培养4 h后,弃去培养基,每孔加入DMSO 150 μL,振荡5 min,使用酶标仪于570 nm波长处检测各孔的吸光度(A),按下式计算细胞存活率:细胞存活率(%)=实验组A值/空白组A值×100%。实验重复3次,取平均值。使用GraphPad Prism 7软件计算半数抑制浓度,以筛选后续实验的药物作用浓度和作用时间。
2.4 分组与给药
取对数生长期的HepG2细胞,以每孔2×105个接种到6孔板中,每孔加入DMEM完全培養基2 mL,待细胞贴壁后,弃去培养基,分别加入含澳洲茄边碱0(空白组)、4、6、8 μmol/L(浓度根据“2.3”项下结果设置)的DMEM完全培养基2 mL,每个浓度设置3个复孔。
2.5 细胞凋亡率的检测
采用Annexin Ⅴ-FITC/PI双染色法结合流式细胞仪进行检测。取对数生长期的HepG2细胞,按“2.4”项下方法接种、分组、给药。培养24 h后,消化并收集细胞,用预冷的磷酸盐缓冲液(PBS,pH 7.2)离心(100×g,5 min)洗涤2次,弃去上清液;用水稀释5×binding buffer得1×binding buffer,取1×binding buffer 500 μL重悬细胞,加入Annexin Ⅴ-FITC试剂5 μL和PI试剂10 μL,轻柔涡旋混匀后,室温避光孵育5 min,使用流式细胞仪分析细胞凋亡情况,记录细胞凋亡率(含早期凋亡率和晚期凋亡率)。实验重复3次。
2.6 细胞克隆形成率的检测
采用结晶紫染色法进行检测。取对数生长期的HepG2细胞,以每孔500个接种到6孔板中,每孔加入DMEM完全培养基2 mL。培养次日,弃去培养基,分别加入含澳洲茄边碱0(空白组)、6 μmol/L(浓度根据“2.5”项下结果设置)的DMEM完全培养基2 mL,每个浓度设置3个复孔。培养10 d后,用4%多聚甲醛固定液固定30 min,以结晶紫染色液染色30 min,再用ddH2O冲洗干净,记录各孔内形成的克隆数[细胞数大于50个的集落(直径大于0.3~1.0 mm)计为1个克隆]并拍照,按下式计算克隆形成率:克隆形成率(%)=克隆数/接种细胞数×100%。
2.7 细胞中Bcl-2、Bax、caspase-3 mRNA表达的检测
采用实时荧光定量PCR法进行检测。取对数生长期的HepG2细胞,按“2.4”项下方法接种、分组、给药。培养24 h后,弃去上清液,用PBS洗涤2次,每孔加入Trizol试剂1 mL,提取细胞总RNA,使用超微量分光光度计测定RNA浓度后,按试剂盒说明书方法将总RNA反转录成cDNA。以上述cDNA为模板,按试剂盒说明书方法进行扩增。反应体系(共10 µL)如下:2×SYBR Green Pro Taq HS Premix(ROX plus)5 μL,cDNA模板 1 μL,上、下游引物各0.2 μL,RNase-free水3.6 μL。反应程序采用两步法,具体条件如下:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火与延伸30 s,40个循环。使用2-ΔΔCt法以甘油醛-3-磷酸脱氢酶(GAPDH)为内参计算细胞中Bcl-2、Bcl-2相关X蛋白(Bax)、caspase-3 mRNA的表达量。PCR引物均委托美国Thermo Fisher Scientific公司设计、合成,引物序列及产物长度见表1。
2.8 细胞中p-AMPKα、AMPKα、Bcl-2、cleaved caspase-3蛋白表达的检测
采用Western blot法进行检测。取对数生长期的HepG2细胞,按“2.4”项下方法接种、分组、给药。培养24 h后,收集细胞,提取总蛋白,用BCA蛋白定量试剂盒测定蛋白浓度后,煮沸5 min使其变性。取变性蛋白30 μg进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,用半干转印法转移到PVDF膜上,用TBST缓冲液(含0.5%吐温20,下同)洗涤3次后,用5%脱脂牛奶室温封闭1 h;加入p-AMPKα(T172)(稀释比例1 ∶ 1 000)、AMPKα(稀释比例1 ∶ 1 000)、Bcl-2(稀释比例1 ∶ 1 000)、caspase-3(稀释比例1 ∶ 1 000)、cleaved caspase-3(稀释比例1 ∶ 1 000)、β-actin(稀释比例1 ∶ 5 000)一抗,4 ℃孵育过夜;用TBST缓冲液洗涤3次,加入相应二抗(稀释比例1 ∶ 3 000),室温孵育1 h;用TBST缓冲液洗涤3次,将显色液A液和B液混合,用移液枪均匀加至膜上,再用高灵敏度化学发光成像仪成像,用Image Lab 5.2.1软件分析目标蛋白与内参蛋白(β-actin)的灰度值比值,并计算p-AMPKα/AMPKα,再将上述结果与空白组比较进行归一化处理,作为目标蛋白的表达量。
另取对数生长期的HepG2细胞,按“2.4”项下方法接种后分为空白对照组、澳洲茄边碱组、compound C组和compound C+澳洲茄边碱组,每组设置3个复孔。相应药物组加入含compound C 5 μmol/L[12]的DMEM完全培养基2 mL,培养2 h后,弃去培养基,再(或)加入含澳洲茄边碱6 μmol/L(浓度根据“2.5”项下结果设置)的DMEM完全培养基2 mL,继续培养24 h,然后按上述方法测定细胞中AMPKα、Bcl-2蛋白的表达量。
2.9 统计学方法
采用GraphPad Prism 7软件进行数据分析及作图。实验结果采用x±s表示,两组间比较采用t检验;多组间比较采用单因素方差分析,多组间两两比较采用Bonferroni检验。检验水准α=0.05。
3 结果
3.1 澳洲茄边碱对HepG2细胞存活率的影响
与空白组比较,1~12 μmol/L澳洲茄边碱作用24、48 h后,HepG2细胞存活率均显著降低(P<0.05),且有浓度依赖趋势。澳洲茄边碱作用24、48 h对HepG2细胞的半数抑制浓度分别为8.310、7.996 μmol/L,故后续实验以4、6、8 μmol/L作为澳洲茄边碱的作用浓度,24 h作为其作用时间。澳洲茄边碱作用24、48 h对HepG2细胞存活率的影响见表2。
3.2 澳洲茄边碱对HepG2细胞凋亡率的影响
0、4、6、8 μmol/L澳洲茄邊碱作用24 h后,HepG2细胞的凋亡率分别为(8.687±0.331)%、(9.707±0.891)%、(12.753±0.534)%、(13.900±1.015)%,其中6、8 μmol/L澳洲茄边碱作用后HepG2细胞的凋亡率均显著高于空白组和4 μmol/L澳洲茄边碱(P<0.05),故后续细胞克隆形成实验和机制验证实验以6 μmol/L作为澳洲茄边碱的作用浓度。澳洲茄边碱对HepG2细胞凋亡率的影响见图1。
3.3 澳洲茄边碱对HepG2细胞克隆形成的影响
经6 μmol/L澳洲茄边碱作用10 d后,HepG2细胞的克隆形成率较空白组显著降低[(20.666±5.033)%vs.(32.667±3.055)%,P<0.05]。澳洲茄边碱对HepG2细胞克隆形成的影响见图2。
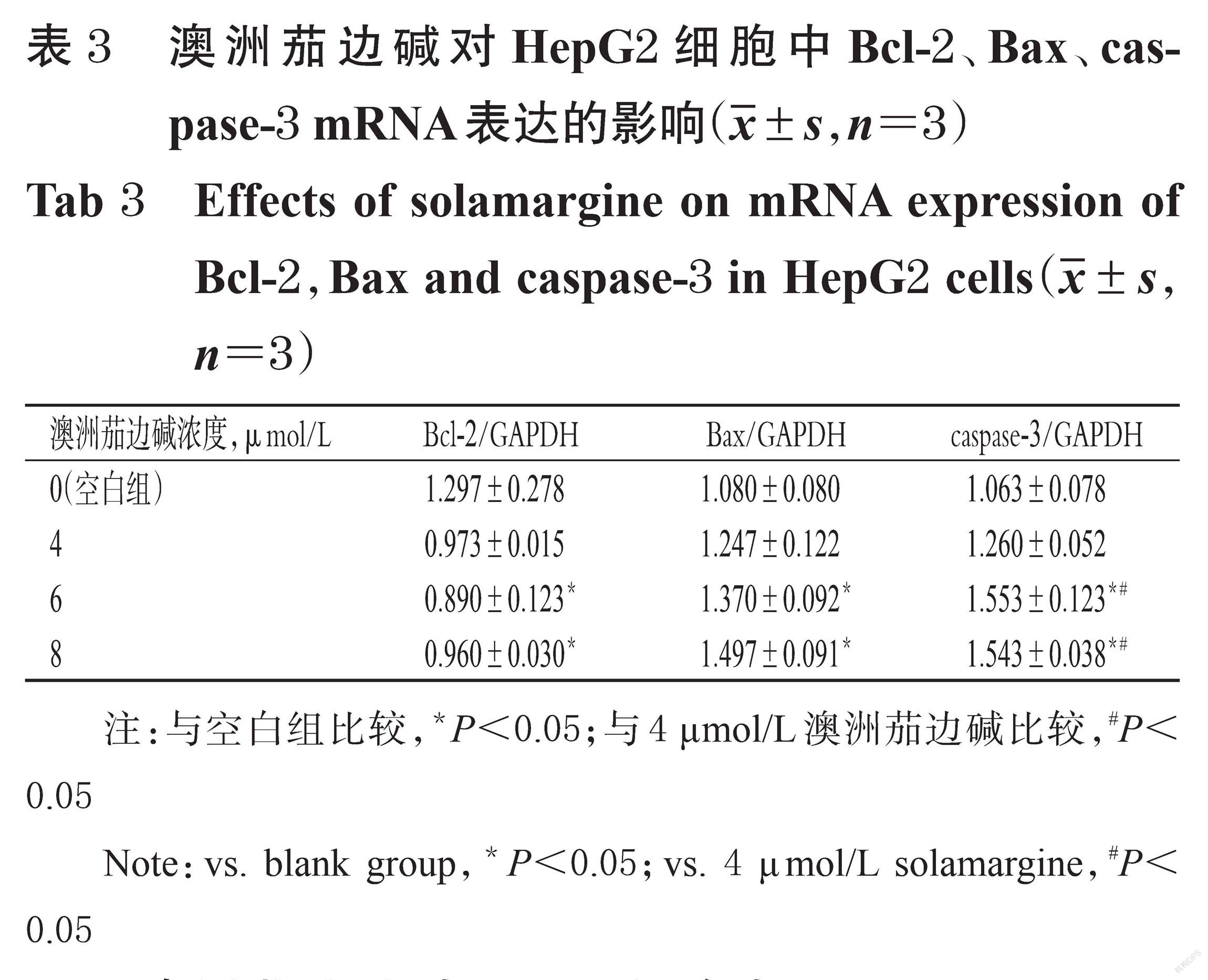
3.4 澳洲茄边碱对HepG2细胞中Bcl-2、Bax、caspase-3 mRNA表达的影响
与空白组比较,6、8 μmol/L澳洲茄边碱作用24 h后,HepG2细胞中Bcl-2 mRNA的表达量均显著降低(P<0.05),Bax、caspase-3 mRNA的表达量均显著升高(P<0.05)。与4 μmol/L澳洲茄边碱比较,6、8 μmol/L澳洲茄边碱作用24 h后HepG2细胞中caspase-3 mRNA的表达量均显著升高(P<0.05)。澳洲茄边碱对HepG2细胞中Bcl-2、Bax、caspase-3 mRNA表达的影响见表3。
3.5 澳洲茄边碱对HepG2细胞中Bcl-2、cleaved caspase-3蛋白表达的影响
与空白组比较,6、8 μmol/L澳洲茄边碱作用24 h后HepG2细胞中Bcl-2蛋白的表达量均显著降低(P<0.05),6μmol/L澳洲茄边碱作用后HepG2细胞中cleaved caspase-3蛋白的表达量显著升高(P<0.05)。与4、6 μmol/L澳洲茄边碱比较,8 μmol/L澳洲茄边碱作用24 h后HepG2细胞中Bcl-2蛋白的表达量均显著降低(P<0.05)。澳洲茄边碱对HepG2细胞中Bcl-2、cleaved caspase-3蛋白表达的影响见图3、表4。
3.6 澳洲茄边碱对AMPK信号通路的影响及验证
经0、4、6、8 μmol/L澳洲茄边碱作用24 h后,HepG2细胞中p-AMPKα/AMPKα分别为1、1.212±0.114、1.315±0.143、1.310±0.320。与空白组比较,4、6、8 μmol/L澳洲茄边碱作用24 h后HepG2细胞中p-AMPKα/AMPKα均有升高趋势,其中6 μmol/L澳洲茄边碱可使上述比值显著升高(P<0.05)。澳洲茄边碱对HepG2细胞中p-AMPKα、AMPKα蛋白表达影响的电泳图见图4。
与空白对照组比较,compound C组、compound C+澳洲茄边碱组HepG2细胞中AMPKα蛋白的表达量和澳洲茄边碱组HepG2细胞中Bcl-2蛋白的表达量均显著降低(P<0.05)。与澳洲茄边碱组比较,compound C+澳洲茄边碱组HepG2细胞中Bcl-2蛋白的表达量显著升高(P<0.05)。AMPK抑制剂对经澳洲茄边碱作用后HepG2细胞中AMPKα、Bcl-2蛋白表达的影响见图5、表5。
4 讨论
我国肝癌的发病人数占全世界所有肝癌病例总数的55%[13-14]。尽管治疗肝癌有许多策略,包括手术切除、肝脏移植、消融、经动脉化学栓塞术和分子靶向治疗(索拉非尼和仑伐替尼)等,但疗效仍不令人满意[15-16]。因此,进一步寻找新的抗肝癌治疗途径和药物是国内外研究的热点之一。
已有体内外研究表明,澳洲茄边碱对鼻咽癌、肺癌细胞的生长均有抑制作用[8-9],但其在肝癌细胞中的作用尚不明确。细胞增殖是活细胞的重要生理功能之一,当细胞受到致癌因素的影响时,其无法正常地完成分化,取而代之的则是不受控制地持续分裂、恶性增殖[17-19]。既往研究发现,澳洲茄边碱可通过下调基质金属蛋白酶2和基质金属蛋白酶9的表达来抑制细胞的迁移和侵袭[20]。本研究采用MTT法和细胞克隆形成实验考察了澳洲茄边碱对HepG2细胞生长的影响,结果显示,澳洲茄边碱可降低HepG2细胞的存活率且对存活率的影响有浓度依赖趋势,并能抑制其克隆形成。
細胞凋亡是维持细胞内环境稳定所必需的一种基本的生物学过程[21]。Bcl-2和Bax均为Bcl-2家族成员,是参与细胞凋亡的重要因子。Bcl-2在维持细胞存活中起着重要作用,而Bax的主要作用是加速细胞凋亡[22]。有研究表明,细胞凋亡实际上是caspase被活化并诱发凋亡蛋白酶级联反应的过程[23]。caspase-3是caspase家族成员之一,可激活凋亡信号的传递,是促进细胞凋亡的关键蛋白;caspase-3切割之后可形成cleaved caspase-3,cleaved caspase-3是caspase-3的活化形式并能够破坏细胞功能、促进细胞凋亡[23-24]。本研究结果显示,澳洲茄边碱可通过抑制Bcl-2 mRNA及其蛋白的表达,促进Bax、caspase-3 mRNA和cleaved caspase-3蛋白的表达来诱导HepG2细胞凋亡,与Ding等[25]研究结果一致。
AMPK是细胞能量的传感器,可调节细胞的增殖、生长和自噬[26]。有研究表明,AMPK可作为抑癌因子发挥作用,其活化可以抑制肿瘤细胞的增殖[27]。AMPK还是一种参与凋亡信号通路信号转导的交互蛋白,包括LKB1(liver kinase B1)/AMPK和AMPK/p53信号通路[28-29]。有研究发现,ω-羟基十一碳-9-烯酸可增加乳腺癌细胞中AMPK的磷酸化水平和cleaved caspase-3、Bax蛋白的表达水平,下调Bcl-2蛋白的表达水平,而使用AMPK抑制剂可以逆转这种作用[30]。本研究结果显示,澳洲茄边碱作用于HepG2细胞后可轻微上调磷酸化AMPKα蛋白的表达,使用AMPK抑制剂compound C后可以抑制AMPKα蛋白的表达,从而逆转澳洲茄边碱对Bcl-2蛋白的抑制作用,说明澳洲茄边碱诱导HepG2细胞凋亡的作用可能与调控AMPK信号通路有关。
综上所述,澳洲茄边碱可以抑制HepG2细胞增殖,诱导其凋亡,作用机制可能与激活AMPK信号通路有关。在下一步研究中,本课题组将采用肝癌细胞荷瘤小鼠模型评估澳洲茄边碱治疗肝癌的效果与机制。
参考文献
[ 1 ] SIEGEL R L,MILLER K D,JEMAL A. Cancer statistics,2018[J]. CA Cancer J Clin,2018,68(1):7-30.
[ 2 ] European Association for the Study of the Liver. EASL clinical practice guidelines:management of hepatocellular carcinoma[J]. J Hepatol,2018,69(1):182-236.
[ 3 ] ROAYAIE S,OBEIDAT K,SPOSITO C,et al. Resection of hepatocellular cancer ≤2 cm:results from two Western centers[J]. Hepatology,2013,57(4):1426-1435.
[ 4 ] AL-SALAMA Z T,SYED Y Y,SCOTT L J. Lenvatinib:a review in hepatocellular carcinoma[J]. Drugs,2019,79(6):665-674.
[ 5 ] ESCUDIER B,WORDEN F,KUDO M. Sorafenib:key lessons from over 10 years of experience[J]. Expert Rev Anticancer Ther,2019,19(2):177-189.
[ 6 ] ZHANG C,JIANG W Q,DING J. New insights on sorafenib resistance in liver cancer with correlation of individua- lized therapy[J]. Biochim Biophys Acta Rev Cancer,2020,1874(1):188382.
[ 7 ] FU R J,WANG X X,HU Y,et al. Solamargine inhibits gastric cancer progression by regulating the expression of lncNEAT1_2 via the MAPK signaling pathway[J]. Int J Oncol,2019,54(5):1545-1554.
[ 8 ] TANG Q,ZHENG F,LIU Z,et al. Novel reciprocal in- teraction of lncRNA HOTAIR and miR-214-3p contribute to the solamargine-inhibited PDPK1 gene expression in human lung cancer[J]. J Cell Mol Med,2019,23(11):7749-7761.
[ 9 ] WU J J,TANG X J,MA C J,et al. The regulation and interaction of colon cancer-associated transcript-1 and miR7- 5p contribute to the inhibition of SP1 expression by solamargine in human nasopharyngeal carcinoma cells[J]. Phytother Res,2020,34(1):201-213.
[10] XIE X D,ZHANG X M,CHEN J,et al. Fe3O4-solamargine induces apoptosis and inhibits metastasis of pancre- atic cancer cells[J]. Int J Oncol,2019,54(3):905-915.
[11] FUMAROLA C,CAFFARRA C,LA MONICA S,et al. Effects of sorafenib on energy metabolism in breast cancer cells:role of AMPK-mTORC1 signaling[J]. Breast Cancer Res Treat,2013,141(1):67-78.
[12] TANG Q,ZHAO S Y,WU J J,et al. Inhibition of inte- grin-linked kinase expression by emodin through crosstalk of AMPKα and ERK1/2 signaling and reciprocal interplay of SP1 and c-Jun[J]. Cell Signal,2015,27(7):1469-1477.
[13] ALSAIED O A,SANGWAN V,BANERJEE S,et al. Sorafenib and triptolide as combination therapy for hepatocellular carcinoma[J]. Surgery,2014,156(2):270-279.
[14] ZHU Z X,HUANG J W,LIAO M H,et al. Treatment strategy for hepatocellular carcinoma in China:radiofrequency ablation versus liver resection[J]. Jpn J Clin Oncol,2016,46(12):1075-1080.
[15] FORNER A,REIG M,BRUIX J. Hepatocellular carcinoma[J]. Lancet,2018,391(10127):1301-1314.
[16] ZHANG Y,HUANG F,WANG J,et al. MiR-15b me- ; diates liver cancer cells proliferation through targeting Bcl-2[J]. Int J Clin Exp Pathol,2015,8(12):15677- 15683.
[17] ICIEK M B,KOWALCZYK-PACHEL D,KWIECIEŃ I,et al. Effects of different garlic-derived allyl sulfides on peroxidative processes and anaerobic sulfur metabolism in mouse liver[J]. Phytother Res,2012,26(3):425-431.
[18] YUE X,ZHANG Z,LIANG X,et al. Zinc fingers and homeoboxes 2 inhibits hepatocellular carcinoma cell proli- feration and represses expression of cyclins A and E[J]. Gastroenterology,2012,142(7):1559-1570.
[19] ZHAO D,ZHANG T,HOU X M,et al. Knockdown of fascin-1 expression suppresses cell migration and invasion of non-small cell lung cancer by regulating the MAPK pathway[J]. Biochem Biophys Res Commun,2018,497(2):694-699.
[20] SANI I K,MARASHI S H,KALALINIA F. Solamargine inhibits migration and invasion of human hepatocellular carcinoma cells through down-regulation of matrix metalloproteinases 2 and 9 expression and activity[J]. Toxicol In Vitro,2015,29(5):893-900.
[21] TIAN X,WANG Y,LI S,et al. ZHX2 inhibits proliferation and promotes apoptosis of human lung cancer cells through targeting p38MAPK pathway[J]. Cancer Biomark,2020,27(1):75-84.
[22] LIN P,TIAN X H,YI Y S,et al. Luteolin-induced protection of H2O2-induced apoptosis in PC12 cells and the associated pathway[J]. Mol Med Rep,2015,12(5):7699- 7704.
[23] MANNING B D,TOKER A. Akt/PKB signaling:naviga- ting the network[J]. Cell,2017,169(3):381-405.
[24] HOU X,TONG Q,WANG W,et al. Dihydromyricetin protects endothelial cells from hydrogen peroxide-induced oxidative stress damage by regulating mitochondrial pathways[J]. Life Sci,2015,130:38-46.
[25] DING X,ZHU F S,LI M,et al. Induction of apoptosis in human hepatoma SMMC-7721 cells by solamargine from Solanum nigrum L[J]. J Ethnopharmacol,2012,139(2):599-604.
[26] KIM J,KUNDU M,VIOLLET B,et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nat Cell Biol,2011,13(2):132-141.
[27] LIANG J,MILLS G B. AMPK:a contextual oncogene or tumor suppressor?[J]. Cancer Res,2013,73(10):2929- 2935.
[28] NIEMINEN A I,ESKELINEN V M,HAIKALA H M,et al. Myc-induced AMPK-phospho p53 pathway activates Bak to sensitize mitochondrial apoptosis[J]. Proc Natl Acad Sci U S A,2013,110(20):e1839-e1848.
[29] SHAW R J,KOSMATKA M,BARDEESY N,et al. The tumor suppressor LKB1 kinase directly activates AMP-activated kinase and regulates apoptosis in response to energy stress[J]. Proc Natl Acad Sci U S A,2004,101(10):3329-3335.
[30] AHN J,KIM H,YANG K M. ω-hydroxyundec-9-enoic acid induction of breast cancer cells apoptosis through generation of mitochondrial ROS and phosphorylation of AMPK[J]. Arch Pharm Res,2020,43(7):735-743.
(收稿日期:2021-08-19 修回日期:2021-11-19)

