白屈菜红碱纳米粒的制备及体外抗黑色素瘤活性评价
杨锦 韩伟 张永萍 陈晓兰 李哲 刘杰 吴静澜













中圖分类号 R283.6;R979.1 文献标志码 A 文章编号 1001-0408(2021)24-2980-07
DOI 10.6039/j.issn.1001-0408.2021.24.07
摘 要 目的:制备白屈菜红碱纳米粒(CHE-NPs),对其处方进行优化,并评价其体外释药行为及对黑色素瘤的抑制作用。方法:以甲氧基聚乙二醇-聚乳酸-羟基乙酸共聚物(mPEG-PLGA)为载体材料,采用纳米沉淀法制备CHE-NPs,采用高效液相色谱法和透析袋法测定包封率、载药量。以二者的总评归一(OD)值为因变量,以CHE投药量、mPEG-PLGA质量浓度、泊洛沙姆188(F68)浓度为自变量,采用Box-Behnken响应面设计优化CHE-NPs处方。检测最优处方所制CHE-NPs的粒径和Zeta电位,考察其体外释药特征,比较CHE原料药和CHE-NPs对小鼠B16黑色素瘤细胞存活率的影响并计算二者的半数抑制浓度。结果:最优处方为CHE投药量2 mg、mPEG-PLGA质量浓度13 mg/mL、F68浓度1.8%。以此所制CHE-NPs的平均包封率为(80.18±1.11)%,平均载药量为(11.36±0.28)%,平均OD值为0.96±0.04[与OD预测值(0.90)的相对偏差为6.67%],粒径为(113.1±1.40)nm,Zeta电位为(-21.6±0.29)mV,多分散性指数为0.07±0.01(n=3)。CHE对照品、CHE-NPs在孵育8 h时的累积释放率分别为90.87%、68.68%,后者的体外释药行为符合Weibull动力学模型。CHE-NPs对B16黑色素瘤细胞的抑制作用显著强于CHE原料药,CHE-NPs和CHE原料药的24 h半数抑制浓度分别为69.35、107.36 μg/mL。结论:所制CHE-NPs具有缓释作用和较强的载药能力,同时增强了CHE对黑色素瘤的体外抑制作用。
关键词 白屈菜红碱;黑色素瘤;抑瘤作用;甲氧基聚乙二醇-聚乳酸-羟基乙酸共聚物;纳米粒;Box-Behnken响应面设计
Preparation of Chelerythrine Nanoparticles and Evaluation of Anti-melanoma Activity in vitro
YANG Jin1,HAN Wei1,ZHANG Yongping1,CHEN Xiaolan1,LI Zhe2,3,LIU Jie1,WU Jinglan1(1. College of Pharmacy, Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China; 2. College of Basic Medicine, Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China; 3. Innovation Research and Development Center of Veterinary Traditional Chinese Medicine Preparations, Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China)
ABSTRACT OBJECTIVE: To prepare chelerythrine nanoparticles (CHE-NPs), optimize their formulation, and evaluate its drug release behavior in vitro and its inhibitory effect on melanoma. METHODS: Using methoxy polyethylene glycol-poly(lactic-co- glycolic acid) (mPEG-PLGA) as carrier, CHE-NPs were prepared by the nano-precipitation method. HPLC method and dialysis bag method were used to determine entrapment efficiency and drug loading. The formulation of CHE-NPs was optimized by Box-Behnken response surface design using overall desirability (OD) of them as dependent variables, CHE dosage, mPEG-PLGA concentration and poloxamer 188 (F68) concentration as independent variables. The particle size and Zeta potential of CHE-NPs prepared by the optimal formulation were detected; the characteristics of drug release in vitro were investigated; the effects of CHE and CHE-NPs on survival rate of mice B16 melanoma cells were compared, and median inhibition concentrations (IC50) of them were calculated. RESULTS: The optimal formulation included CHE of 2 mg, mPEG-PLGA of 13 mg/mL, F68 of 1.8%. Average entrapment efficiency rate of CHE-NPs prepared by the optimal formulation was (80.18±1.11)%, average drug loading was (11.36±0.28)%, average OD value was 0.96±0.04 [the relative deviation from predicted value (0.90) of OD was 6.67%]; particle size was (113.1±1.40) nm, and Zeta potential was (-21.6±0.29) mV; polydispersity index was 0.07±0.01 (n=3);accumulative release rates of CHE control and CHE-NPs were 90.87% and 68.68% within 8 h, and drug release behavior in vitro of the latter was in accordance with Weibull kinetic model. Inhibitory effect of CHE-NPs on B16 melanoma cells was significantly stronger than that of CHE; the 24 h IC50 of CHE-NPs and CHE were 69.35 and 107.36 μg/mL, respectively. CONCLUSIONS: The prepared CHE-NPs show good sustained-effect and high capacity of drug loading, and strengthen the inhibitory effect of CHE on melanoma.
KEYWORDS Chelerythrine; Melanoma; Anti-tumor effect; Methoxy polyethylene glycolpolylactic acid-hydroxyacetic acid copolymer; Nanoparticles; Box-Behnken response surface design
基金项目:国家苗药工程技术研究中心组建项目(No.2014FU-125Q09);贵州省科技厅学术新苗培养及创新探索专项项目(No.黔科合平台人才〔2018〕5766号-13);地方病与少数民族性疾病教育部重点实验室(贵州医科大学)开放课题基金资助项目(No.黔教合KY字〔2019〕047)
硕士研究生。研究方向:中药及民族药物新制剂与新剂型。E-mail:1510428733@qq.com
通信作者:教授,硕士生导师,硕士。研究方向:中药及民族药物新制剂与新剂型。E-mail:1259803072@qq.com
白屈菜红碱(chelerythrine,CHE)是来源于苗药号筒杆Macleaya cordata(Willd.)R. Br.、白屈菜Chelidonium majus Linn.等药用植物的生物碱类活性成分。大量研究数据显示,CHE具有抑制腫瘤细胞生长的作用,包括人结肠癌HCT-116、人肝癌HepG2、小鼠黑色素瘤B16细胞等[1-4]。但CHE的水溶性差,加之游离药物本就难以在肿瘤部位扩散、渗透,从而导致该成分的开发利用受到限制[5-6]。本研究拟结合现代药剂学新理论与新技术,将难溶性CHE载于高分子载体中以制备纳米粒,以期提高其生物利用度、增强其抗肿瘤活性。
纳米递药系统在肿瘤组织中表现出较好的渗透性和滞留效应,在构建该系统时,选择合适的纳米载体可改善药物的递送和释放性能[7]。将亲水性的甲氧基聚乙二醇(methoxy polyethylene glycol,mPEG)嵌段引入聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]分子链中,制成mPEG-PLGA聚合物,该聚合物具有疏水和亲水的双重特性,同时mPEG可以保护纳米粒不受网状内皮系统的影响,使纳米粒在体内循环中拥有较长的半衰期[8-11];PLGA的存在也可使所载药物不被快速降解[12-14]。本研究选择两亲性mPEG-PLGA聚合物作为载体材料,制备CHE纳米粒(CHE-NPs)并优化其处方,考察所制CHE-NPs的粒径、Zeta电位等参数以及体外释药行为,评价CHE-NPs对B16黑色素瘤细胞的体外抑制作用,以期构建一种对黑色素瘤抑制活性更强的纳米载药制剂。
1 材料
1.1 主要仪器
本研究所用主要仪器包括1260型高效液相色谱(HPLC)仪(美国Agilent公司),SK8200H型超声波清洗机(上海科导超声仪器有限公司),3310-DMP型激光粒度分析仪(美国Beckman公司),RCT basic型磁力搅拌器(德国Ika公司),H2050R型台式高速大容量冷冻离心机(湖南湘仪实验室仪器开发有限公司),N-1300型旋转蒸发仪(上海爱朗仪器有限公司),JEM-1400FLASh型透射电子显微镜(日本JEOL公司),AUW12D型电子分析天平(日本Shimadzu公司),T09-1S型酶标仪、3111型CO2培养箱、Sorvall ST 8R型低温离心机[赛默飞世尔科技(中国)有限公司],CKX53型倒置荧光显微镜(日本Olympus公司)等。
1.2 主要药品与试剂
CHE对照品(批号AF9030102,纯度≥98%)购自成都埃法生物科技有限公司;CHE原料药(批号34316-15-9,纯度>98%)购自西安开来生物工程有限公司;mPEG-PLGA聚合物[mPEG分子量2 000 Da,PLGA分子量15 000 Da,乳酸(LA)/乙醇酸(GA)比例50 ∶ 50]购自济南岱罡生物工程有限公司;聚山梨酯80(批号301C054)、MD34透析袋(截留分子量3 500 Da)、RPMI 1640培养基(批号20210531)、磷酸盐缓冲液(PBS,pH 7.2,批号20201217)、MTT试剂(批号309E059)、二甲基亚砜(DMSO,批号1121E0325)均购自北京索莱宝科技有限公司;泊洛沙姆188(F68,批号T24J10Z80481)购自上海源叶生物科技有限公司;胎牛血清(批号20200328)、青-链霉素双抗(批号20200703)均购自赛澳美细胞技术(北京)有限公司;含乙二胺四乙酸(EDTA)的0.25%胰蛋白酶(批号2277237)购自赛默飞世尔科技(中国)有限公司;其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 细胞
小鼠B16黑色素瘤细胞(货号ZQ0186)购自上海中乔新舟生物科技有限公司。
2 方法与结果
2.1 CHE-NPs及空白NPs的制备
采用纳米沉淀法制备CHE-NPs[15]。精密称取处方量的mPEG-PLGA聚合物和CHE原料药分散于丙酮1 mL中,超声(功率500 W,频率53 kHz,下同)处理5 min,作为有机相。配制质量分数为0.4%的F68溶液,取5 mL,作为水相。在1 000 r/min条件下,以1 mL/min的速度将有机相缓慢滴加到水相中,室温搅拌10 min,得到淡蓝色乳光的混悬液,使用旋转蒸发仪除去有机溶剂,即得CHE-NPs。按上述方法制备不含CHE的空白NPs。CHE-NPs的结构示意图见图1。
2.2 CHE的含量测定
2.2.1 色谱条件 以Ultimate XB-C18(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0 min,20%A;20 min,60%A;25 min,95%A;35 min,20%A);流速为0.8 mL/min;检测波长为270 nm,柱温为35 ℃;进样量为10 μL。
2.2.2 对照品溶液的配制 精密称定CHE对照品5 mg,置于25 mL量瓶中,加入甲醇超声10 min,使其溶解,再加入甲醇稀释、定容,摇匀,制成质量浓度为200 μg/mL的对照品溶液。
2.2.3 供试品溶液的配制 精密量取CHE-NPs 0.1 mL,置于2 mL量瓶中,加甲醇1.9 mL,超声30 min破乳,在35 ℃条件下以氮气流吹干,残渣加甲醇2 mL复溶,用0.22 μm微孔滤膜滤过,取续滤液,作为供试品溶液。
2.2.4 方法学考察 参考文献[16-17]方法进行方法学考察。结果显示,溶剂(甲醇)、载体材料对CHE-NPs中CHE的检测无干扰(图2);以CHE质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程为y=14.868x-0.813 3(R 2=0.999 8),CHE检测质量浓度的线性范围为0.125~200 μg/mL;精密度试验的RSD为0.22%(n=6);平均回收率为100.99%(RSD=2.32%,n=6);稳定性(12 h)试验的RSD为1.46%(n=6);重复性试验的RSD为1.21%(n=6)。
2.3 包封率与载药量的测定
2.3.1 透析袋的预处理 取透析袋,剪成适宜长度,放入水中煮沸10~20 min,冷却后取出,浸泡在水中,備用。
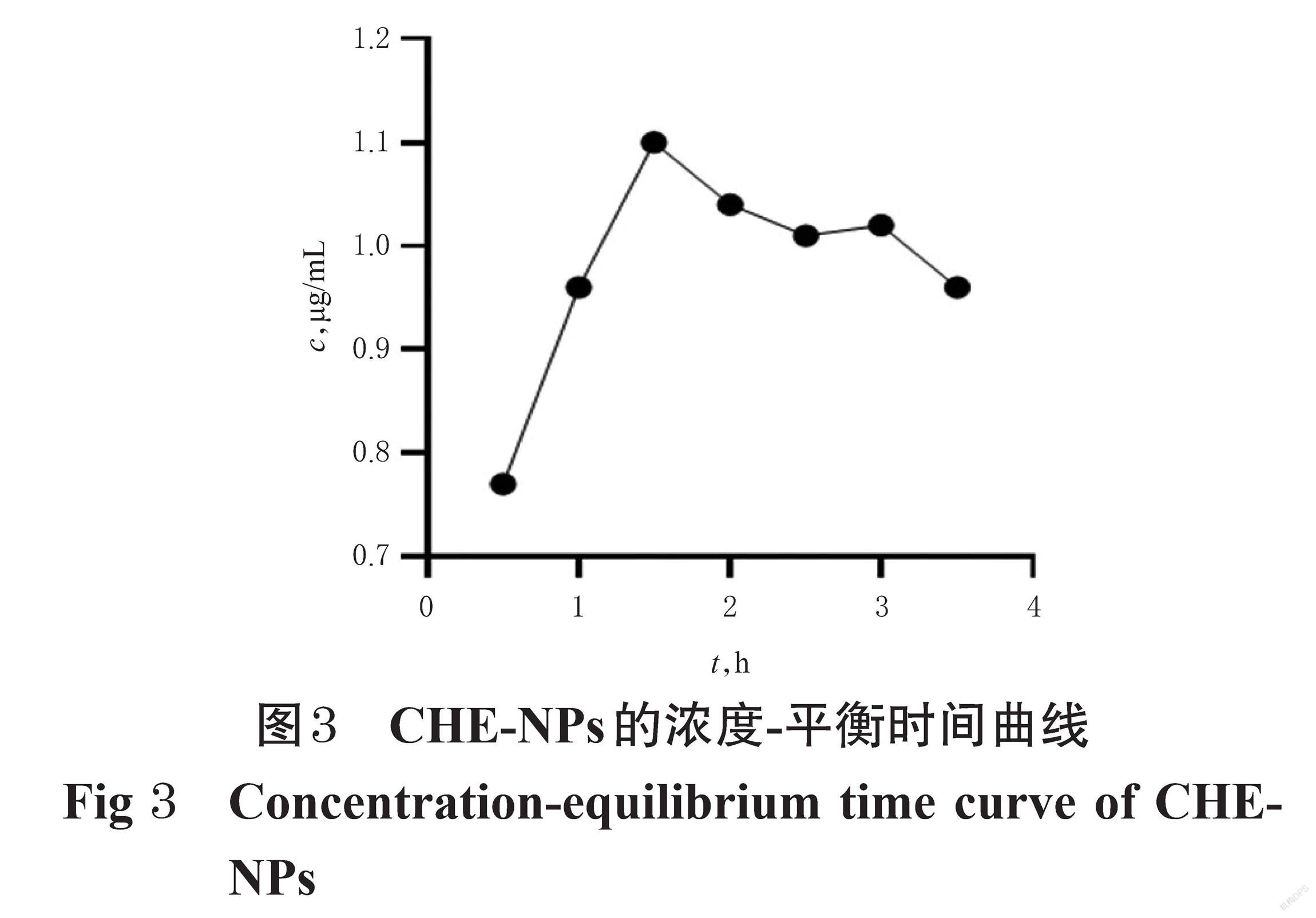
2.3.2 透析平衡时间的确定 精密吸取CHE-NPs 2 mL,置于透析袋内,两头扎紧。将封口的透析袋置于锥形瓶中,以水50 mL为透析介质,转速为600 r/min,分别于透析0.5、1.0、1.5、2.0、2.5、3.0、3.5 h时精密吸取外液0.5 mL,同时补足等体积水[18]。用甲醇将外液稀释至1 mL,用0.22 μm微孔滤膜滤过,取续滤液按“2.2.1”项下色谱条件进样测定,记录峰面积,代入回归方程计算外液中CHE的质量浓度,同时绘制浓度-平衡时间曲线(图3)。由图3可知,随着透析时间的延长,CHE的质量浓度呈先升高后降低再升高再降低的趋势,说明CHE-NPs已逐渐破裂;当透析时间为1.5 h时,外液中CHE的质量浓度达到最大值。因此,本研究选择1.5 h为透析平衡时间。
2.3.3 包封率与载药量的测定方法 精密吸取CHE- NPs 2 mL,置于透析袋内,两头扎紧。将封口的透析袋置于锥形瓶中,以水50 mL为透析介质,转速为600 r/min,于透析1.5 h时精密吸取外液0.5 mL,用甲醇稀释至1 mL,再用0.22 μm微孔滤膜滤过,取续滤液按“2.2.1”项下色谱条件进样测定,记录峰面积,代入回归方程计算外液中CHE的质量浓度。按以下公式计算包封率和载药量:包封率(%)=(药物总量-外液中药物含量)/药物总量×100%,载药量(%)=(药物总量-外液中药物含量)/(药物总量+辅料总量)×100%。
2.4 Box-Behnken响应面设计优化CHE-NPs的处方
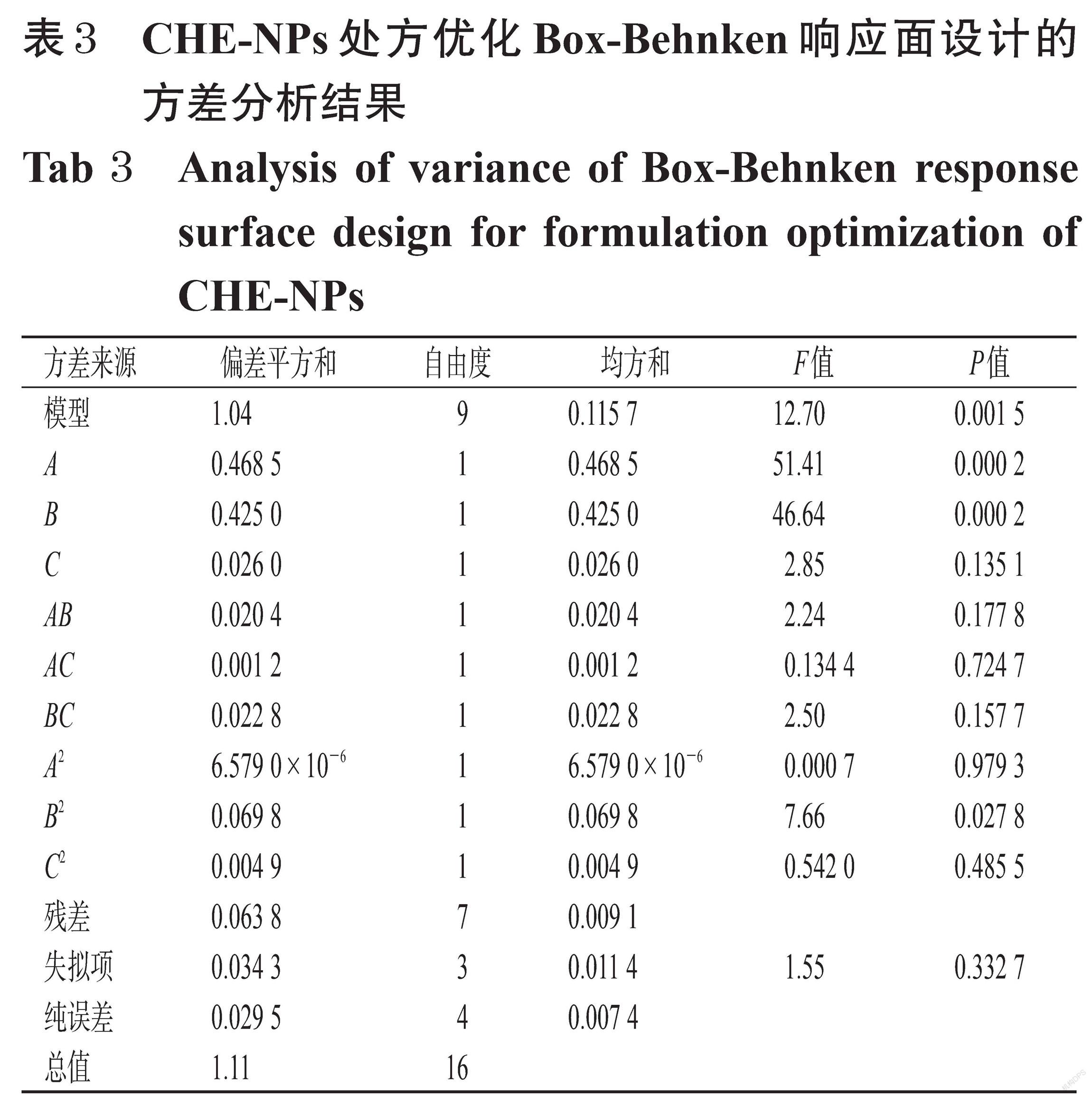
本课题组前期以有机溶剂种类、有机相与水相比例、F68浓度、磁力搅拌器转速、载体材料质量浓度、投药量、载体材料种类为影响因素进行单因素实验,考察其对CHE-NPs包封率、载药量的影响。在单因素实验的基础上,本研究选择对包封率和载药量影响较大的因素——CHE投药量(A)、mPEG-PLGA质量浓度(B)、F68浓度(C)为自变量,以包封率(Y1)和载药量(Y2)的总评归一(OD)值为因变量,采用Box-Behnken响应面设计,以Design Expert 12软件优化CHE-NPs处方。由于Y1、Y2的取值越大越好,故选择对应dmax[dmax=(Yi-Ymin)/(Ymax-Ymin)]以计算OD值:OD=(d1×d2)[19-20]。CHE-NPs处方优化Box-Behnken响应面设计的因素与水平见表1,实验安排与结果见表2。
采用Design Expert 12软件对数据进行二次多项式回归拟合,得到二次多元回归方程为OD=0.597 0+0.242 0×A-0.230 5×B+0.057 0×C+0.071 5×AC+0.075 5×BC-0.001 3×A2-0.128 8×B2-0.034 2×C2(R 2=0.942 3),方差分析结果见表3。由表3可知,模型的拟合程度较好(P=0.001 5),因素A、B、B2对OD值均具有显著影响(P<0.05)。
为进一步评价A与B、B与C、A与C交互作用对OD值的影响,本研究采用Design Expert 12软件绘制各因素的响应面图和等高线图,详见图4。由图4可知,OD值随A、C的升高而升高。根据Box-Behnken响应面设计结果,求解二次多元方程得到CHE-NPs的最优处方如下:CHE 2.0 mg、mPEG-PLGA质量浓度12.79 mg/mL、F68浓度1.8%,为方便称量,优化mPEG-PLGA质量浓度为13 mg/mL。
按上述最优处方称取CHE、mPEG-PLGA聚合物,分散于丙酮1 mL中,超声处理5 min,作为有机相。配制质量分数为1.8%的F68溶液5 mL,作为水相。在1 200 r/min条件下,以1 mL/min的速度将有机相缓慢滴加到水相中,室温搅拌10 min,得到淡蓝色乳光的混悬液,使用旋转蒸发仪除去有机溶剂,即得CHE-NPs。平行制备3份,按“2.3.3”项下方法测得平均包封率为(80.18±1.11)%,平均载药量为(11.36±0.28)%,平均OD值为0.96±0.04[与OD预测值(0.90)的相对偏差为6.67%],说明Box-Behnken响应面设计所得的模型预测良好。
2.5 CHE-NPs的表征
2.5.1 粒径与Zeta电位 吸取按最优处方制备的CHE-NPs 0.2 mL,加水1.8 mL稀释,使其均匀分散,所得混悬液呈淡蓝色乳光。取上述混悬液适量,采用激光粒度分析仪,在25 ℃下测定CHE-NPs的粒径和Zeta电位,重复测定3次。结果显示,CHE-NPs的粒径为(113.1±1.40)nm,Zeta电位为(-21.6±0.29)mV,多分散性指数为0.07±0.01(n=3)。CHE-NPs的粒径分布图见图5。
2.5.2 形态观察 吸取按最优处方制备的CHE-NPs 1 mL,加水稀释10倍,用2%磷钨酸于室温下染色1~2 min,于透射电子显微镜下进行形态观察。结果显示,所得CHE-NPs呈球形,表面光滑、圆整,大小均匀,分散良好。结果见图6。
2.6 体外稳定性考察
将按最优处方制备的CHE-NPs置于4 ℃冰箱中冷藏,分别于冷藏0、7、14 d时取样,按“2.5”项下方法测定粒径、Zeta电位及多分散性指数。结果显示,CHE-NPs的粒径、Zeta电位及多分散性指数均无明显变化,其混悬液仍呈淡蓝色乳光,说明CHE-NPs的稳定性良好。结果见表4。
2.7 体外释药实验
采用动态透析法进行考察。精密量取CHE对照品溶液、按最优处方制备的CHE-NPs各5 mL,分别置于预处理后的透析袋中,两头扎紧,置于生理盐水(含0.3%聚山梨酯80,下同)20 mL中,于(37.0±0.5)℃条件下以100 r/min恒温振荡,分别于孵育1、2、4、6、8、12、24、48 h时取样1 mL,同时补足等温等体积的生理盐水。样品于60 ℃水浴中挥干,残渣加甲醇1 mL复溶,用0.22 μm微孔滤膜滤过,取续滤液按“2.2.1”项下色谱条件进样测定,记录峰面积,代入回归方程计算样品中CHE的质量浓度。实验平行操作3次,按以下公式计算累积释放率:累积释放率=(V0cn+V[∑][n=1][t-1]ct)/M药(式中,V0表示释放介质总体积,t表示n-1,cn表示第n个时间点所测得的CHE质量浓度,V表示每次取样的体积,ct表示n-1个时间点所测得的CHE质量浓度,M药表示投入药物总质量)。采用Origin 2021软件,以累积释放率(Q)和释放时间(t)对CHE-NPs的体外释药行为进行零级动力学模型、一级动力学模型、Higuchi动力学模型、Weibull动力学模型方程拟合。结果显示,CHE对照品溶液在孵育8 h时的累积释放率已达90.87%,提示已基本释放完全,而CHE-NPs 在孵育8 h时的累积释放率为68.68%,48 h时的累积释放率为88.72%,具有缓释特征,其体外释药行为符合Weibull动力学模型。CHE对照品和CHE-NPs的体外释放曲线见图7,CHE-NPs的体外释药动力学方程拟合结果见表5。
2.8 体外抑瘤作用评价
2.8.1 空白NPs的细胞毒性 采用MTT法进行检测。取处于对数生长期的B16黑色素瘤细胞,以5 000个/孔接种于96孔板中,于37 ℃、5%CO2培养箱中孵育24 h至细胞贴壁。实验共设置9个组别,分别为空白组(无细胞、无药物)、對照组(有细胞、无药物)和不同质量浓度(10、25、50、100、250、500、1 000 μg/mL[21],以mPEG-PLGA计)空白NPs,药物溶液用空白培养基配制。每组设6个复孔。药物干预24 h后,每孔加入MTT试剂10 μL(1×PBS配制,5 mg/mL),于37 ℃培养箱中避光孵育4 h。弃去孔中液体,每孔加入DMSO 150 μL,使用酶标仪在490 nm波长处测定各孔的吸光度(A),并按以下公式计算细胞存活率:细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。结果显示,空白NPs对B16黑色素瘤细胞的存活率无明显影响,说明其具有良好的生物相容性。结果见图8。
2.8.2 CHE-NPs的细胞毒性 按“2.8.1”项下方法检测不同质量浓度CHE原料药(1、20、40、60、80、100、120 μg/mL,浓度根据预实验结果设置)和不同质量浓度CHE-NPs(1、20、40、60、80、100、120 μg/mL,以CHE计,浓度根据预实验结果设置)干预24、48、72 h对B16黑色素瘤细胞存活率的影响,并计算半数抑制浓度。采用SPSS 17.0软件对数据进行统计分析,计量资料均以x±s表示,组间比较采用单因素方差分析。结果显示,当质量浓度超过20 μg/mL后,CHE-NPs的细胞毒性均显著大于CHE原料药(P<0.05或P<0.01),且有浓度和时间依赖趋势,CHE-NPs和CHE原料药的24 h半数抑制浓度分别为69.35、107.36 μg/mL。结果见表6。
3 讨论
mPEG-PLGA聚合物易溶于有机溶剂,难溶于水,在水相比例高的流动相条件下易对HPLC仪及色谱柱造成不良影响(4 min时有最大吸收)。本课题组前期研究发现,使用氮气流吹干样品进行前处理,可减少mPEG-PLGA聚合物对色谱系统的干扰。
本课题组在前期预实验及单因素实验考察中对mPEG-PLGA聚合物进行了筛选,分别考察了亲水段和疏水段比例对CHE-NPs包封率、载药量的影响。因CHE是由疏水段PLGA包裹,所以较大的疏水段分子量对CHE-NPs包封率和载药量的影响更大。当mPEG分子量为2 000 Da、PLGA分子量为15 000 Da时,CHE-NPs的包封率与载药量均较高。
为准确地测定CHE-NPs的包封率,本课题组前期考察了低速离心法、低温超速离心法、鱼精蛋白沉淀法和透析袋法对CHE-NPs包封率测定的影响。结果发现,无论是低速还是超速离心都无法将NPs与游离的CHE完全分离。使用鱼精蛋白沉淀吸附之后再离心,可能会使NPs和游离CHE的分离度更高,因为鱼精蛋白是一种碱性氨基酸,拥有大量带正电的胍基,可与Zeta电位为负的NPs相结合,在此基础上进行超速离心,可使包载的NPs凝聚沉淀[22-25]。但结果发现,鱼精蛋白沉淀法所测得的包封率重复性及稳定性并不佳,相对偏差为25.44%。而透析袋法所测得的包封率稳定性高、重复性好,故本研究最终选择透析袋法测定CHE-NPs的包封率。
Box-Behnken响应面设计是一种多因素非线性实验优化方法,可以连续对实验的各个因素及水平进行分析,既弥补了正交试验和均匀设计的不足,又具有实验次数少、精准度高的优点,在制剂优化应用领域显现出独特的优势[26-27]。本研究选择Box-Behnken响应面设计对CHE-NPs的处方进行优化,结果显示,该法所拟合的模型回归方程预测性良好;模型拟合的R 2为0.942 3,表明94.23%实验数据的变异可用此回归模型来解释。体外释药实验结果显示,CHE-NPs体外释药行为符合Weibull动力学模型,且具有缓释特征。
细胞毒性实验结果表明,CHE-NPs对B16黑色素瘤细胞有明显的体外抑制作用,在相同用量下,其抑制作用强于CHE原料药,且有一定的时间和浓度依赖趋势。这可能与纳米递药系统本身的优势相关,如较小的粒径、在肿瘤部位的高度滞留及更易被细胞内吞摄取等[28-29]。
综上所述,本研究采用纳米沉淀法成功制备了一种以mPEG-PLGA聚合物为载体的CHE-NPs,其具有缓释作用和较强的载药能力,同时增强了CHE对黑色素瘤的体外抑制作用。在后续实验中,本课题组将继续探索CHE-NPs在体内的抑瘤作用,考察其是否能有效抑制实体瘤的生长及其抑瘤作用机制,为进一步的临床应用提供理论依据。
参考文献
[ 1 ] 刘翀,蒋晓梅.白屈菜红碱对人结直肠癌细胞凋亡的影响及其机制研究[J].中国现代应用药学,2019,36(24):3034-3039.
[ 2 ] 韩聪,朱国福.白屈菜红碱诱导人肝癌细胞HepG2凋亡及机制探讨[J].中国实验方剂学杂志,2016,22(11):127-130.
[ 3 ] 李晓明,欧阳婷庭,董妙先,等.白屈菜红碱对肝纤维化小鼠TGF-β/Smads信号通路的影响[J].中国病理生理杂志,2018,34(7):1323-1328.
[ 4 ] 张步鑫,赵献敏,成琼,等.白屈菜红碱对黑色素瘤B16细胞增殖抑制和凋亡诱导作用的实验研究[J].时珍国医国药,2018,29(4):793-795.
[ 5 ] 王云,李平平,高振珅,等.白屈菜红碱固体分散体的制备及其理化性质和抗氧化活性研究[J].中国药房,2020,31(9):1054-1061.
[ 6 ] 李昕,朱丹丹,陈裕,等.纳米药物递送系统在促进肿瘤深层渗透方面的研究进展[J].中南药学,2020,18(12):2009-2018.
[ 7 ] 郭惠婕,姜文姣,缪明星,等.抗肿瘤纳米药物的靶向递送及药代动力学模型研究进展[J].中南药学,2020,18(1):74-79.
[ 8 ] XING L X,SHI Q S,ZHENG K L,et al. Ultrasound-me- diated microbubble destruction(UMMD)facilitates the delivery of CA19-9 targeted and paclitaxel loaded mPEG- PLGA-PLL nanoparticles in pancreatic cancer[J]. Thera- nostics,2016,6(10):1573-1587.
[ 9 ] CHEN T K,LI C W,LI Y,et al. Small-sized mPEG-PLGA nanoparticles of schisantherin A with sustained release for enhanced brain uptake and anti-Parkinsonian activity[J]. ACS Appl Mater Interfaces,2017,9(11):9516-9527.
[10] HASANPOUR A,ESMAEILI F,HOSSEINI H,et al. Use of mPEG-PLGA nanoparticles to improve bioactivity and hemocompatibility of streptokinase:in-vitro and in-vivo studies[J]. Mater Sci Eng C Mater Biol Appl,2021,118:111427.
[11] XU R L,WANG J Y,XU J J,et al. Rhynchophylline loaded-mPEG-PLGA nanoparticles coated with tween-80 for preliminary study in Alzheimer’s disease[J]. Int J Nanomedicine,2020,15:1149-1160.
[12] BIRHAN Y S,HAILEMESKEL B Z,MEKONNEN T W,et al. Fabrication of redox-responsive Bi(mPEG-PLGA)-Se2 micelles for doxorubicin delivery[J]. Int J Pharm,2019,567:118486.
[13] GUO D D,LI Q,SUN Y Y,et al. Evaluation of controlled-release triamcinolone acetonide-loaded mPEG-PLGA nanoparticles in treating experimental autoimmune uveitis [J]. Nanotechnology,2019,30(16):165702.
[14] GAN M Y,ZHANG W P,WEI S J,et al. The influence of mPEG-PCL and mPEG-PLGA on encapsulation efficiency and drug-loading of SN-38 NPs[J]. Artif Cells Nanomed Biotechnol,2017,45(2):389-397.
[15] 管慶霞,于欣,吕邵娃,等.包载丁香苦苷和羟基酪醇的mPEG-PLGA纳米粒处方与制备工艺的优化[J].中成药,2017,39(12):2508-2512.
[16] 王莎莎,陈家琦,王华华,等.甘草次酸修饰多西紫杉醇磁性纳米粒的制备与表征[J].中国药房,2020,31(19):2345-2350.
[17] 李楠,李旭,程鹏,等.纳米多孔花形乳糖装载姜黄素干粉吸入剂的制备及体外释药性能研究[J].中国药房,2021,32(7):794-801.
[18] 余昕,陈斯玮,欧丽兰,等.芍药總苷的理化性质及其脂质体包封率的测定方法[J].中成药,2016,38(6):1260- 1264.
[19] 谢青璇,李小芳,谢龙,等. Box-Behnken效应面法优化大黄素/小檗碱-壳聚糖双载药纳米粒的处方工艺研究[J].中草药,2021,52(6):1614-1622.
[20] 徐玲霞,刘水婷,刘骏,等. Box-Behnken效应面法优化吴茱萸次碱脂质液晶纳米粒的处方研究[J].中草药,2018,49(21):5076-5081.
[21] 洪伟勇,王金明,王海英,等.载姜黄素两亲性星状聚酯纳米粒的制备、表征及体外抗肿瘤研究[J].中草药,2021,52(8):2237-2246.
[22] 谢锐锋,杨琪璿,刘小敏,等.脑靶向阿霉素脂质体的制备及评价[J].今日药学,2018,28(7):438-441.
[23] 陈丽萍,吴智敏,杨畅,等.广藿香酮传递体包封率测定方法的筛选研究[J].中南药学,2019,17(11):1864-1868.
[24] 刘卫斌,薛彦宁,秦永刚.鱼精蛋白凝聚法测定和厚朴酚脂质体的包封率[J].中国药房,2010,21(39):3695-3697.
[25] 孙维彤,黄桂华,叶杰胜,等.鱼精蛋白凝聚法测定脂质体和纳米脂质体包封率[J].中国药学杂志,2006,41(22):1716-1720.
[26] 陈婷婷,李顺英,秦婷婷,等. Box-Behnken响应面法优化海藻酸钠mPEG-b-PLGA纳米粒处方工艺[J].中国药学杂志,2019,54(19):1590-1598.
[27] GIULIANA V,MINNA D,BYRNE H J,et al. Application of Box-Behnken experimental design for the formulation and optimisation of selenomethionine-loaded chitosan nanoparticles coated with zein for oral delivery[J]. Int J Pharm,2018,551(1/2):257-269.
[28] 李晓婷,决利利,郝海军,等.隐丹参酮纳米混悬剂的制备及其抗肿瘤活性[J].中成药,2021,43(1):6-10.
[29] 陈奋,杨月,张玲,等.姜黄素纳米制剂在肿瘤治疗中的研究进展[J].中国现代应用药学,2019,36(21):2731-2737.
(收稿日期:2021-09-08 修回日期:2021-11-18)

