TAP63γ基因调节Col10a1基因表达及软骨细胞分化成熟*
李 娜,王 倩,夏 康,孙晓曦,展丙香,吴 璇,陈 晨,郑其平△
1.安徽医科大学第一附属医院输血科,安徽合肥 230022;2.江苏大学医学院,江苏镇江 212013
骨骼包括两种组织,即分别由成骨细胞和软骨细胞形成的骨与软骨。骨骼的发育或形成又有两种方式:膜内成骨及软骨内成骨。正常生理状况下,机体的膜内成骨和软骨内成骨合理、协调地进行。当膜内成骨受损时可致多种颌面部骨骼畸变,而软骨内成骨异常则可致骨与软骨发育不良或过生长[1-3]。 P63作为P53抑癌基因家族的重要成员,同时发挥了抑癌基因(介导细胞衰老)和原癌基因(促增殖、促生长)的双重作用[4-5]。近年来,研究发现除了严重的上皮缺陷,P63基因缺失型小鼠的肢体严重缩短或缺如并伴有颌面部异常[6-7]。此外,P63基因突变也可致人体发生明显的骨骼改变,进一步说明P63基因在机体骨骼发育,尤其是软骨内成骨中的作用[4,8]。然而,小鼠P63有8种变异体[9-10],这些变异体与骨骼发育的关联目前知之甚少。基于前期对P63变异体的研究,笔者推测TAP63γ是控制长骨发育的效应P63变异体[2,11]。MCT 细胞是经过SV40大T抗原转化的软骨细胞,这些细胞在32 ℃培养时可持续生长,而在37 ℃培养时会出现生长阻滞并高表达十型胶原蛋白基因(Col10a1基因)[1]。ATDC5细胞是由小鼠畸胎瘤衍生的细胞系,具有类似于软骨细胞的生长特性, 长期培养(+ITS诱导)可向分化成熟过渡,并且也高表达Col10a1等基因[2]。TAP63γ基因在肥大型MCT细胞和经诱导向成熟分化的ATDC5细胞中的水平明显升高[10],提示TAP63γ基因可能在软骨细胞分化成熟时起作用。因此,本研究拟进一步探讨TAP63γ基因如何影响Col10a1基因表达及软骨细胞的分化与成熟。
1 材料与方法
1.1仪器与试剂 主要仪器:细胞培养箱(Thermo Fisher Scientific)、PCR仪(GENE)、荧光定量PCR仪(BIO-RAD)。主要试剂:TRIzol 试剂盒(15596018,Invitrogen)、iScriptTMcDNA Synthesis Kit(1708890,BIO-RAD)、DreamTaq Green PCR Master Mix(2x)(K1071,Thermo Fisher Scientific)、iQTMSYBR Green Supermix(1708882,BIO-RAD)、ITS(胰岛素-转铁蛋白-Selenium-硒)、ITS(13146,Sigma)、引物(上海生工生物工程有限公司)、茜素红染色试剂盒(A5533,Sigma)、碱性磷酸酶染色试剂盒(南京建成生物研究所CAKP D001-2)、阿尔新蓝染色试剂盒(上海生工生物工程有限公司A0298-1g)、TAP63γ基因 SiRNA(SR417746,Origene)、pCMV6-TAP63γ基因过表达载体(MR227536,Origene)、pCMV6空载体(PS100001,Origene)、LipofectamineTM2000脂质体(11668027,Invitrogen)、G418(158782,MP Biomedicals)。
1.2方法
1.2.1引物设计 在GenBank数据库中查找基因的mRNA序列(NCBI,https://www.ncbi.nlm.nih.gov/gene)。运用Primer3软件设计引物,并在PubMed-Blast中验证所设计的引物,见表1。

表1 qRT-PCR引物
1.2.2MCT与ATDC5细胞株的培养 (1)MCT细胞使用含有8%FBS的DMEM培养基,置于8%CO2的32 ℃培养箱培养。MCT细胞培养至80%融合度时,把MCT细胞从32 ℃、8%CO2的培养箱移到37 ℃、5%CO2培养箱内继续培养,两种状态下(32 ℃/37 ℃)的MCT细胞需做3个复孔,隔1 d换1次培养液。(2)ATDC5细胞使用含有5%FBS的DMEM/F12(1∶1)培养基,置于5%CO2的37 ℃培养箱培养。ATDC5细胞生长至80%融合度时,加入含1%ITS诱导剂的完全培养基开始诱导培养。开始诱导记为0 d(无ITS),两组的ATDC5细胞均需做3个复孔,隔1 d换1次培养液。
1.2.3细胞转染及瞬时转染 使用干扰片段TAP63γ基因 SiRNA,分别转染MCT细胞(32 ℃培养24 h后转入37 ℃继续培养24 h)和ATDC5细胞(37 ℃培养24 h),即转染干扰片段组。稳定转染: 分别转染TAP63γ基因表达质粒和pCMV空载体质粒,利用G418筛选,生成了过表达TAP63γ基因(目的组)和含有空载体(对照组)的ATDC5稳定转染细胞系[6],未进行转染的ATDC5细胞系设为空白组。质粒转染实验参照说明书和参考文献[3,6]进行。简要的步骤如下:待细胞长至 70%~80%融合度时, MCT/ATDC5 细胞使用LipofectamineTM2000无血清转染 6 h后,完全培养基再培养 24~48 h。稳定转染再换含有G418的完全培养液,并连续培养两周,隔1 d换1次培养液,剩下没有被杀死的细胞继续传代培养,以备后续实验。
1.2.4细胞RNA提取、反转录及荧光定量PCR 使用TRIzol试剂进行RNA的提取,按说明书的实验步骤依次进行RNA提取、DNA酶处理及反转录。得到的cDNA 1∶10稀释,按照iQTMSYBR Green supermix反应体系配比,在BIO-RAD荧光定量PCR仪上进行扩增。Gapdh作为内参和目的基因同时进行qRT-PCR,采用相对定量2-ΔΔCT方法计算基因的相对表达量。
1.2.5细胞染色 染色实验参照说明书进行,简要步骤如下。阿尔新蓝染色:细胞采用-20 ℃甲醇固定2 min,加入0.1%的阿尔新蓝(0.1 g阿尔新蓝粉末加入盐酸溶液至100 mL,配成0.1 mol/L的盐酸溶液),静置过夜,洗净镜检;碱性磷酸酶染色:4%多聚甲醛固定1 min,加入新鲜配制的碱性磷酸酶染液,湿盒内37 ℃避光孵育10 min,洗净,苏木精-伊红复染3~5 min,洗净镜检;茜素红染色:95%乙醇固定10 min,洗净后加入1%茜素红(pH值6.4),室温静置10 min,洗净镜检。
1.3观察指标 (1)分析TAP63γ基因和Col10a1基因分别在增殖/肥大状态下小鼠MCT细胞和ATDC5细胞中的表达;(2)过表达或抑制TAP63γ基因,观察其对Col10a1基因表达的调控作用;(3)进行细胞染色,并比较诱导培养第4、7、14、21天的对照组与目的组的阳性染色面积。
1.4统计学处理 目的基因在肥大型软骨细胞内和增殖型软骨细胞内的比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1Col10a1基因与TAP63γ基因在两种肥大型软骨细胞模型中的表达 MCT细胞在37 ℃诱导3 d后Col10a1基因相对表达量为50.20±1.99(P<0.001),TAP63γ基因相对表达量为4.90±0.13,与32 ℃增殖状态下MCT细胞基因相对表达量(基因相对表达量设为1)比较,差异有统计学意义(P<0.05)。ATDC5细胞在肥大状态下(ITS诱导14 d)Col10a1基因相对表达量为2.60±0.79,TAP63γ基因的相对达量为2.58±0.10,与ATDC5细胞在增殖状态下(无ITS)基因相对表达量(基因相对表达量设为1)比较,差异有统计学意义(P<0.05)。
2.2ATDC5细胞中过表达TAP63γ基因对Col10a1基因的影响 在诱导培养的第0、7、21天,发现目的组的TAP63γ基因相对表达量明显高于对照组,差异有统计学意义(P<0.05);同时在第7、14、21天,目的组的Col10a1基因相对表达量明显高于对照组,差异有统计学意义(P<0.05)。空白组与对照组TAP63γ基因、Col10a1基因相对表达量比较,差异无统计学意义(P>0.05)。见表2。
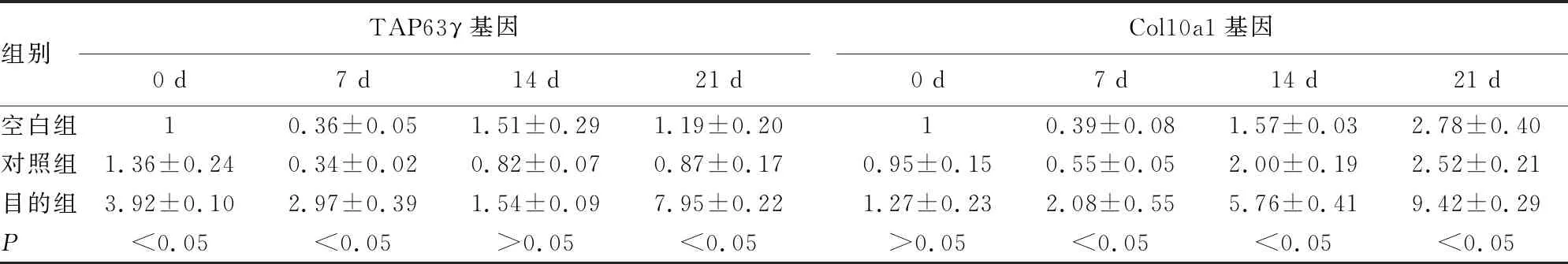
表2 不同诱导时间的TAP63γ基因、Col10a1基因相对表达量
2.3空白组和转染干扰片段组细胞中TAP63γ基因与Col10a1基因的表达 在MCT细胞中,与空白组(基因相对表达量设为1)比较,转染干扰片段组TAP63γ基因相对表达量(0.79±0.11)明显降低,同时Col10a1基因相对表达量(0.68±0.03)也明显降低,差异有统计学意义(P<0.05)。 在ATDC5细胞中,与空白组(基因相对表达量设为1)比较,转染干扰片段组TAP63γ基因相对表达量(0.42±0.10)明显降低,同时Col10a1基因相对表达量(0.35±0.04)也明显降低,差异有统计学意义(P<0.05)。
2.4染色结果 阿尔新蓝染色在诱导培养的第7天显示出最强的染色强度,但目的组与对照组间没有显示出明显的差异。同时在第4、14、21天也没有观察到明显的染色强度差异(图1)。在诱导培养的第21天,观察到目的组与对照组相比显示出更强的碱性磷酸酶染色强度(图2)。对诱导培养第21天的目的组和对照组进行茜素红染色,然而并没有观察到明显的染色强度差异(图3)。
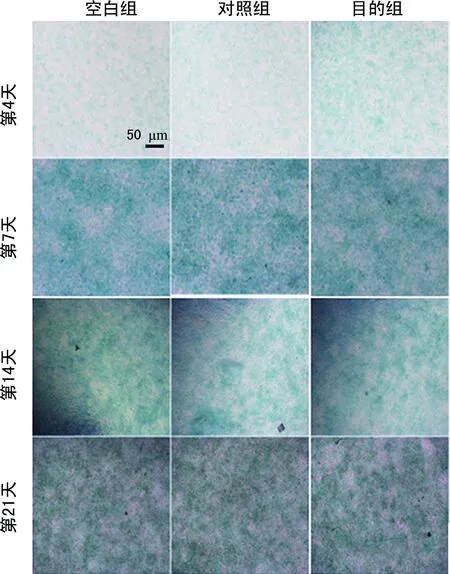
图1 阿尔新蓝染色结果(×4)
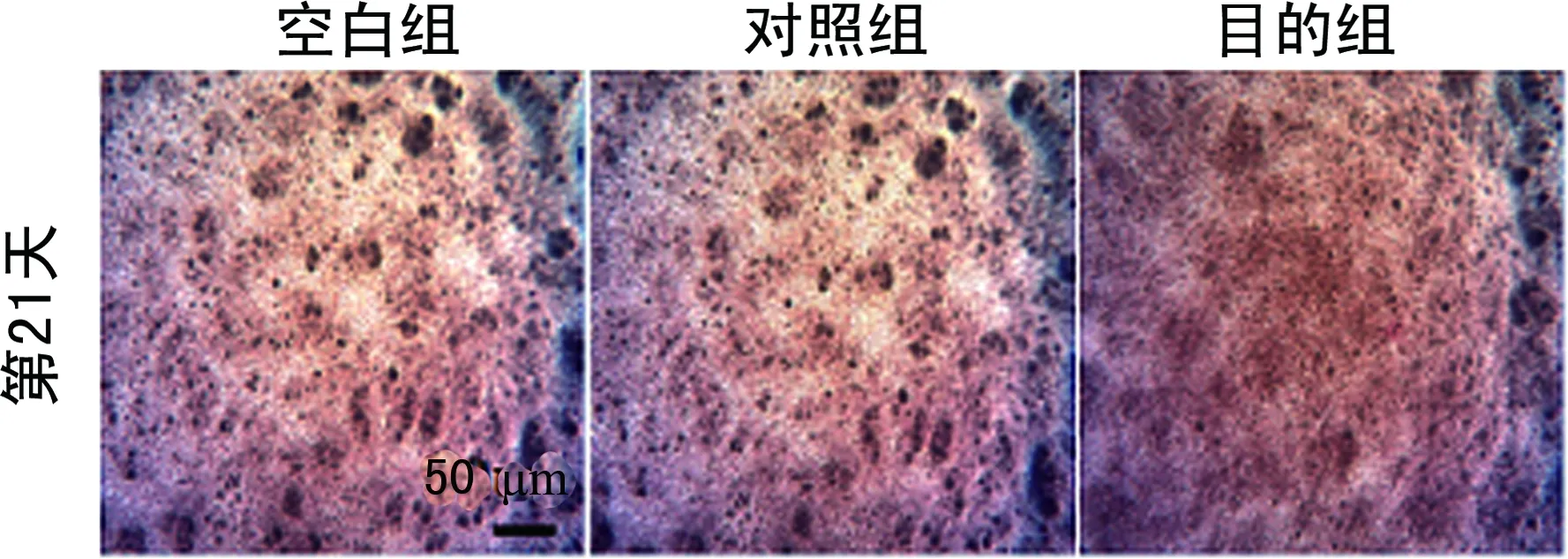
图3 茜素红染色结果(×4)
3 讨 论
大量的研究揭示了P63基因在肿瘤形成和发育过程中的多样性功能[12-13]。由于启动子的不同和可变剪接,P63含有多种异构体,不同异构体之间也会产生相互作用[14-15],这不仅导致了P63基因功能的多样性,同时也阻碍了对其体内功能的研究。小鼠肢体的缺陷主要归于受损的上皮发育,即顶外胚层脊缺失导致肢体的起始发育不能正常进行。然而,肢体缩短和颌面部骨骼改变提示P63缺失型小鼠的软骨内成骨和膜内成骨均受损[16-17]。这些结果提示P63可能在机体的软骨内成骨过程中发挥重要作用 。
本研究进行了TAP63γ基因在两种软骨细胞模型中的表达分析。结果表明,相比增殖型细胞,肥大型MCT和ATDC5细胞中Col10a1基因的上调与增加的TAP63γ基因表达一致。为了确认两个基因之间的相关性,本研究在ATDC5细胞中过表达TAP63γ基因,可见Col10a1基因相对表达量上调;同时,在MCT和ATDC5细胞中抑制TAP63γ基因的表达活性则进一步降低Col10a1基因的表达。这些结果证明了TAP63γ基因和Col10a1基因表达之间的直接关联。在诱导培养的第21天,观察到TAP63γ基因过表达(目的组)与对照组相比显示出更强的碱性磷酸酶染色强度(图2)。与此同时,在目的组和对照组之间,阿尔新蓝染色和茜素红染色都没有检测到明显差异(图1、3)。这些结果清楚地表明TAP63γ基因促进和加速软骨细胞肥大分化并可能促进随后的基质矿化,而在ATDC5细胞早期的增殖和后期的成骨分化阶段中可能影响甚微。
此前的研究表明TAP63γ基因型异构体可能在胚胎骨骼发育的不同阶段发挥不同功效,TAP63γ基因可能参与软骨内成骨过程中的软骨成熟[10,18]。Col10a1基因是软骨内成骨过程中众所周知的肥大型软骨细胞的标志基因。在本研究中,进一步分析了TAP63γ基因与Col10a1基因的关系,以及TAP63γ基因对软骨细胞分化成熟的影响。本研究已经用数据表明TAP63γ基因表达对Col10a1基因的正向调控作用,还证实了Col10a1基因上调与体外软骨内成骨的细胞模型中增强的软骨细胞肥大分化相一致。这些发现可能解释和支持TAP63γ基因在骨折愈合过程中类似于软骨内成骨的作用。然而,关于TAP63γ基因在骨的形成和修复中的确切机制还需要进一步的研究。

