儿童急性淋巴细胞白血病伴白质脑病临床及影像学特点
褚思嘉 汤继宏 张兵兵 肖 潇 王曼丽
苏州大学附属儿童医院神经内科(江苏苏州 215025)
近年来,白血病已成为儿童最常见的恶性肿瘤之一,发病率有逐年上升的趋势。根据2020年中国儿童白血病现状新闻发布会上公布的统计数据,我国2016—2018年平均年新发白血病登记率为4.29/100万,其中急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)占72.4%[1]。随着治疗方案的更新完善,白血病的治疗缓解率逐年上升,以2015版治疗方案为例,其诱导缓解率达97.4%,4 年无病生存率为81.7%。ALL 预后得到很大改善的同时,也明显增加了其相关并发症。白质脑病(leukoencephalopathy)是ALL中枢神经系统并发症的一种,可影响患儿大脑结构和功能的发育,也严重影响患儿预后。本研究分析近10年在苏州大学附属儿童医院就诊的ALL后发生白质脑病患儿的病史资料,总结ALL伴白质脑病的临床特点和影像学特征,以提高对该疾病的认识,为其早期诊断提供依据。
1 临床资料
选择2011年5月至2021年4月在苏州大学附属儿童医院血液肿瘤科、重症医学科、神经内科明确诊断的发生白质脑病的ALL患儿28例。收集患儿的基本信息、合并症、临床症状及体征、血常规、血生化、凝血常规、脑脊液常规、脑背液生化、神经影像学检查结果等。
ALL 伴白质脑病的诊断标准参考文献[2-4],具体如下:①经临床表现和辅助检查确诊为ALL;②ALL临床表现出现在白质脑病临床表现之前;③具有急性脑功能障碍的表现,如癫痫发作、头痛、恶心、呕吐、肢体或面部瘫痪、感觉异常、失语、共济失调和意识改变等;④头颅MRI符合白质脑病的病灶特点,显示双侧大脑半球脑叶、侧脑室周围及半卵圆中心、小脑、脑干等部位白质区异常信号,也可累及灰质或灰质核团,T1WI序列呈等或稍低信号,T2WI序列或液体衰减反转恢复(FLAIR)序列呈高信号;⑤排除中枢神经系统白血病、颅内感染、脑血管病(如脑出血或脑梗死)、颅内占位等脑损伤情况。入组患儿需同时满足以上5条标准。
28例患儿中男18例、女10例。ALL中位发病年龄为6.63(1.37~12.87)岁,在0.75(0.02~5.31)年之后并发白质脑病,白质脑病的中位发病年龄为7.81(1.45~14.01)岁。24例为B淋巴细胞白血病,4例为T淋巴细胞白血病,均曾接受或白质脑病发生时正处于化疗过程,以CCCG-ALL 2015化疗方案为主,有8例因ALL控制不佳而于发病前1年内行1次或多次造血干细胞移植术,其余未接受其他治疗。
28例患儿中24例(85.7%)出现神经系统症状,形式多样,以癫痫发作(13例,46.4%)最为多见,其中局灶性发作6例、全面性发作6例、局灶性兼全面性发作1例,发作时间为数十秒至数十分钟不等,发作表现以双眼凝视(10/13)、肢体抽搐(9/13)、呼之不应(8/13)、肢体僵直(3/13)较为常见;其次为瘫痪(8例),包括面部瘫痪与肢体瘫痪各4例,面部瘫痪均为中枢性面瘫,而肢体瘫痪者偏瘫、截瘫分别为3例、1例;肢体麻木6例,4例为四肢麻木,2例为半侧肢体麻木;视力异常6 例,其中2 例失明;其他神经系统症状包括口齿不清(4例)、恶心或呕吐(3例)、头晕或头痛(2例)、嗜睡(2例)、乏力(2例)、走路异常(1 例)、记忆减退(1 例)。有4 例未出现典型神经系统症状,可能与患儿年幼表述受限有关。
28例患儿均行头颅MRI检查。颅内病灶多为广泛性,主要累及白质和皮质下白质区域,也可累及灰质或灰质核团。头颅MRI异常信号在T1WI序列呈等信号或稍低信号,在T2 WI序列和FLAIR 序列上呈现高信号;病灶呈现多发性、不规则性小片状或大片状分布(图1)。病灶主要分布在顶叶(10 例)、侧脑室周围及半卵圆中心白质区(9例)、基底节区(6例)等部位,其次依次为额叶(4例)、枕叶(4例)、海马(2例)、丘脑(2例)等,颞叶、扣带回、胼胝体、小脑等区域亦可见异常信号影。11例患儿伴有轻度或中度脑沟、脑裂增宽。28 例患儿影像学随访结果:1个月后16例复查头颅MRI,12例影像学异常信号明显改善,其中2例异常信号完全消失;3个月后13例复查头颅MRI,影像学改善10例,其中2例异常信号完全消失;6 个月后17 例复查头颅MRI,14 例明显改善,其中7例异常信号完全消失;在1年的随访中19例复查头颅MRI,16例影像学较第1次明显改善,其中11例异常信号完全消失(图1)。
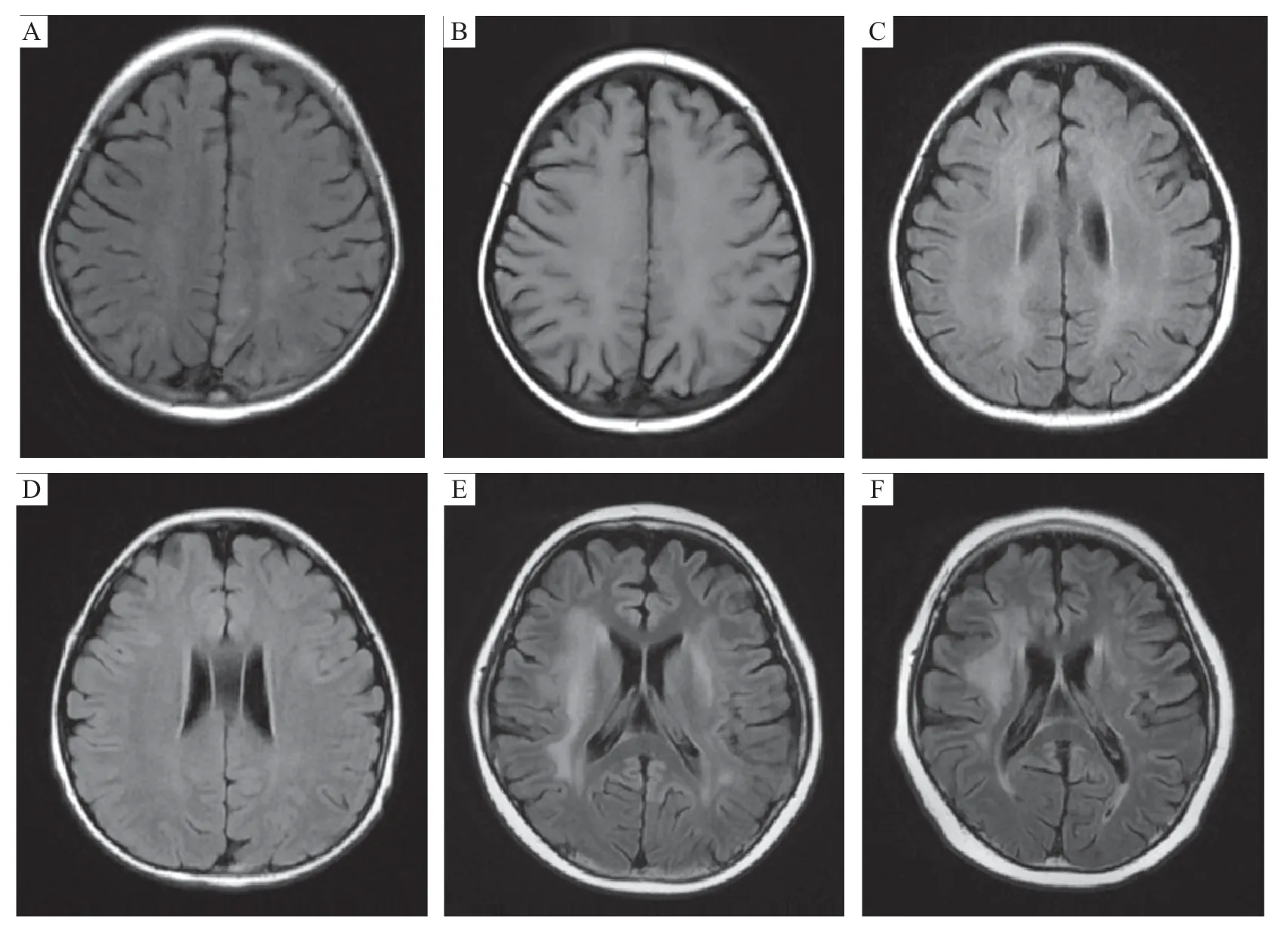
图1 3 例患儿头颅MRI 轴位FLAIR 像
在影像学出现异常信号前1 周内患儿进行了相关实验室检查。红细胞、白细胞或血小板异常26例,25例为2项及以上异常,24例患儿血红蛋白偏低,轻度贫血13例、中度贫血10例、重度贫血1例;凝血功能异常8 例;肝功能异常19 例;电解质紊乱13 例;血压异常6 例,以收缩压或/和舒张压偏高为主;脑脊液常规或生化异常8例。见表1。

表1 28例ALL患儿确诊白质脑病前1周实验室检查结果
正在化疗中的ALL 患儿出现白质脑病后均暂停使用化疗药物。22例患儿使用大剂量激素冲击治疗,静脉滴注甲基泼尼松龙15~20 mg/(kg·d)(最大单次剂量1 000 mg/d),连用3天后减半量,后予泼尼松1~2 mg/(kg·d)序贯口服,并逐渐减停,总疗程1~2个月;静脉丙种球蛋白支持(总量2 g/kg,分3~5天使用),联合神经营养药物,如奥拉西坦、B族维生素、单唾液酸四己糖神经节苷脂钠等;并行对症处理,如甘露醇或甘油果糖降颅压、镇静止痉等。6例患儿症状较轻,仅用静脉丙种球蛋白和/或神经营养药进行治疗。
白质脑病患儿总体预后较好,20 例患儿神经系统症状改善较快,在出院时完全消失或明显好转。视力异常恢复时间相对较长,6例视力下降患儿中,2例1个月恢复正常,2例2个月时视物清楚,与白质脑病前一样,1例3个月视力恢复正常,1例患儿因死亡恢复情况不明。从影像学角度看,16例患儿在1年后复诊时影像学异常信号明显改善,甚至消失。本组6例患儿死亡,死亡原因均非白质脑病,主要是呼吸衰竭、移植物抗宿主反应等。
2 讨论
近年来,随着化学药物开发,ALL 疗效明显改善,但也明显增加了化学药物不良事件的发生概率及程度,如添加鞘内甲氨蝶呤注射方案明显增加ALL 患儿生存率,但也导致中枢神经毒性损害,尤其是白质脑病并发症,严重影响ALL 患儿的预后和生活质量。本研究中,男性患儿要明显多于女性(18:10),B淋巴细胞白血病患儿占85.71%;并发白质脑病的时间有早有晚,中位发病时间为确诊ALL后0.8年,最长为5.31年。确诊白质脑病时,71.4%的患儿正接受化疗,28.6%的患儿处于造血干细胞移植术后及使用抗宿主排异药物过程中。
从临床表现看,85.7%的ALL伴白质脑病患儿均存在神经系统相关症状,以癫痫发作、瘫痪、肢体麻木、视力下降、口齿不清最为多见。经积极治疗,多数症状能较快好转乃至消失。除较容易被关注的神经系统症状外,与正常人群相比,白血病患儿的认知和执行功能、空间模式记忆、视觉识别记忆、注意力等均可能存在缺陷[4-6]。相关研究表明,白质脑病与神经认知功能障碍间存在统计学相关性[3]。白血病患儿顶叶、额叶、海马、杏仁核、丘脑和枕叶区域存在普遍性的聚集性连接改变,这种改变可以影响局部信息加工效率、中枢连接重组和认知储备,从而对患者的认知功能产生一定的影响[7]。本研究中,受患儿病情及家长态度的影响,仅4 例患儿做了中国韦氏幼儿智力量表(C-WYCSI)或韦氏儿童智力量表第四版(WISC-IV)评价认知情况,在认知功能、言语理解、知觉推理、工作记忆、加工速度及总智商方面均较正常同龄儿差,但因样本量少未行进一步分析。
从影像学检查结果来看,病灶主要集中在顶叶、侧脑室周围及半卵圆中心白质区、基底节区、额叶、枕叶、海马、丘脑等部位。根据随访观察,75.0%的患儿在1个月后的头颅MRI复查中可见异常信号显著好转;84.2%的患儿在1 年后神经影像学异常信号明显改善。患儿实验室检查结果显示,85.7%的患儿有贫血,以轻中度为主;46.4%有电解质紊乱,血清钾偏低者较多,血清钠偏低者次之;凝血功能异常者占28.6%;血压异常发生率达21.4%,多为收缩压或/和舒张压偏高;另外67.9%的患儿肝功能异常。
白质脑病患儿的总体预后情况较好,其临床症状和影像学异常大多能得到明显改善,甚至完全消失。本研究的死亡病例死亡原因均非白质脑病,其中4 例为T 淋巴细胞白血病。根据既往病例报道,T淋巴细胞白血病约占儿童ALL的15%,是ALL的独立危险因素,归为中高危组[8]。本研究中T淋巴细胞白血病患儿占14.29%,与既往报道较接近。故而,此类患儿的预后不佳或许与本身的表型及既往有限的医疗支持有关。另外,还需警惕患儿大脑的不典型发育和功能异常。在一项长达25 年的随访中,研究者发现白血病幸存者有大脑加速衰老的倾向[9]。相关研究在长期随访过程中发现,神经认知功能障碍的发生与白质微观结构完整性的破坏有关[10]。从病因学角度分析,ALL伴白质脑病病因复杂,年龄、T 淋巴细胞白血病、中枢神经系统受累、化疗药物、高血压等是伴发白质脑病的危险因素[11-14]。本研究28 例中,11 例患儿头颅MRI 提示脑沟、脑裂轻度或中度增宽,这种脑萎缩改变也会影响该病患儿的认知功能。
有研究发现白血病患儿的局部脑结构异常和脑功能障碍与甲氨蝶呤的暴露浓度及患儿的发病年龄有关[5,15],即ALL 患儿年龄越小,甲氨蝶呤血药浓度越高,其罹患白质脑病的风险越高。研究者对235例ALL患儿的脑脊液样本进行分析发现:①鞘内给药次数与神经生长因子的升高呈正相关(r=0.19,P=0.005),即鞘内给药次数越多,神经元损伤越严重;②胶质原纤维酸性蛋白(RR=1.23,95%CI:1.09~1.40)、髓鞘碱性蛋白(RR=1.06,95%CI:1.01~1.11)、tau蛋白(RR=1.76,95%CI:1.11~2.78)的升高与ALL确诊后5年内白质脑病发生风险的增加相关;③tau 蛋白水平上升与ALL 伴白质脑病患儿的注意力下降有关(P=0.04)[16]。另有研究发现白细胞介素-6 介导的炎症可能导致了甲氨蝶呤诱导的白质脑病[17]。除此之外,有研究分析脑电图发现,所有经甲氨蝶呤治疗缓解的患儿均可观测到失匹配负波振幅下降[18]。综上,发病年龄与甲氨蝶呤的暴露浓度是ALL患儿罹患白质脑病的重要危险因素。本文ALL 治疗以CCCG-ALL 2015 化疗方案为主,该方案每个病例均要用甲氨蝶呤治疗,其他化疗药物还有长春新碱、柔红霉素、左旋门冬酰胺酶、地塞米松、环磷酰胺、阿糖胞苷、6-巯基嘌呤等,多种化疗药物中,具体哪一种药物诱发白质脑病很难判断,化疗方案中的静脉用药或鞘内注射用药均可能触发[19-21]。甲氨蝶呤鞘内注射的神经毒性作用较大,可能在白质脑病的发生发展过程中发挥了重要的作用。
除了化学药物外,其他治疗手段同样可能导致ALL伴白质脑病的中枢神经系统不良反应。相关研究显示,以分次全身照射为基础的造血干细胞移植术准备方案会造成患儿皮质下结构减少以及认知能力下降,且长期后遗症较只接受预防性颅内放疗的患儿更为明显[21]。而放疗是一种危害性极强的治疗方式,除了众所周知的致癌作用外,同样可造成患儿在数年后出现较常见放射后遗症更严重的脑海绵状血管瘤[22]。此外,白血病细胞本身也可能是诱发白质脑病的重要因素。白血病细胞分泌的血管内皮生长因子A 等可导致骨髓血管通透性改变,并破坏血脑屏障[23]。内皮血-脑屏障、血-软脑膜屏障、血-脑脊液屏障、血-硬膜淋巴管屏障在此过程中均可能被累及[24]。
综上所述,ALL 伴白质脑病的发病机制复杂,临床症状以癫痫发作、瘫痪、麻木、视力障碍为主,神经影像学显示病灶多累及顶叶、侧脑室周围及半卵圆中心、基底节等部位。当ALL 患儿出现神经系统症状时,白质脑病可能是ALL治疗期间重要并发症。早期发现与及时治疗能使患儿的脑发育情况得到更好的改善,因此应该重视白质脑病的发生,使ALL得到更全面的治疗。

