敲低长链非编码RNA CCAT2 抑制胃癌细胞的糖代谢重编程和增殖能力
邓 欢,曹 博,崔 昊,赵瑞阳,李航航,刘贵宾,宋立强,陈 凛,卫 勃
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 普通外科医学部,北京 100853
早期胃癌一般无明显症状,产生明显不适症状时多处于中晚期,因此多数患者预后较差,5年生存率往往低于50%[1-2]。胃癌的发病及分子演化机制目前尚不明确,揭示这些机制对于胃癌的防治具有深远的临床意义[3]。大量研究表明有氧糖酵解在胃癌的发展中具有重要作用,是癌细胞主要的供能来源[4]。糖酵解是一个十分复杂的能量代谢过程,其机制复杂,靶点众多。lncRNA 是一类长度>200个核苷酸,本身不编码蛋白的分子。既往研究表明,lncRNA 在多种肿瘤组织中异常表达,与肿瘤细胞的发生、发展密切相关,参与肿瘤的恶性生物学行为的调控[5-7]。大量研究表明lncRNA在糖酵解的调控中起到重要作用[4,8-9]。本研究重点关注lncRNA CCAT2 这一关键靶点,探究其与胃癌恶性生物学行为及糖酵解的关系,为胃癌的发病机制研究提供新的理论依据与实验基础。
材料与方法
1 主要实验材料与仪器 TRIzol 试剂购自美国Invitrogen 公司;DMEM 培养基购自武汉赛维尔生物科技有限公司;胎牛血清购自天津康源科技有限公司;青霉素-链霉素双抗购自美国Gibco 公司;转染试剂Lipofectamine 2000 及蛋白定量试剂盒购自美国Thermo Fisher 公司。靶向lncRNA CCAT2 的siRNA、对照siRNA 由武汉金拓思生物科技有限公司设计并合成;lncRNA CCAT2 引物由北京博迈德基因技术有限公司设计并合成;反转录及qRT-PCR 试剂盒购自日本Takara 公司。葡萄糖、乳酸、丙酮酸、ATP 含量检测试剂盒购自德国Biovision 公司。全波谱酶标仪购自美国Biotek 公司。GLUT1、HK2、PGAM1、β-actin 抗体购自美国Abcam 公司,LDHɑ抗体购自美国Cell Signaling Technology 公司;辣根过氧化物酶标记的二抗及CCK-8 增殖检测试剂盒购自北京百瑞极生物技术有限公司;ECL 发光试剂盒和EdU 增殖检测试剂盒购自上海碧云天生物技术公司。数码凝胶图形分析系统购自上海天能科技有限公司;细胞培养箱为美国Thermo Fisher 公司产品;qRTPCR 检测仪购自鲲鹏基因(北京) 科技有限责任公司。
2 细胞培养 采用购自中国科学院细胞库(上海)的BGC-823、HGC-27 两种常用胃癌细胞系进行实验研究。使用含有10 %胎牛血清和青霉素-链霉素双抗的DMEM 培养基孵育细胞,并生长于37℃含5% CO2加湿培养箱中。培养1~ 3 d 后根据细胞密度进行传代或后续实验。
3 细胞转染 为防止脱靶效应的出现,本研究设计两个靶向CCAT2 的siRNA 敲低胃癌细胞系内lncRNA CCAT2 的表达水平。根据转染的siRNA种类不同将细胞分为siRNA 干扰组(siCCAT2-1,siCCAT2-2)和阴性对照组(NC)。转染前1 d 分别将两种细胞按(3~ 5)×104/孔种植于6 孔板中,24 h后细胞密度达到60%~ 70%,更换为无血清培养基。按照转染试剂操作说明书,Opti-MEM 溶液中加入75 pmol/L Oligo 使终体积为100 μL,轻柔混匀;向Opti-MEM 溶液中加入7.5 μL Lipofectamine 2000,使终体积为100 μL,轻柔混匀,室温放置5 min。将siRNA 分别与Lipofectamine 2000 转染试剂混合,室温放置20 min 后分别加至各组培养孔中。转染后6~ 8 h 更换无血清DMEM 培养基,48 h 后收集细胞,以备后续实验。
4 RNA 提取和定量实时聚合酶链式反应(qRTPCR)使用TRIzol 试剂从细胞中提取总RNA。使用ExScript RT-PCR 试剂盒将lncRNA CCAT2逆转录为cDNA,并配置 PCR 反应体系。然后应用SYBR 预混Ex TaqⅡ(日本Takara 公司)后进行扩增,以β-actin 作为内参,检测lncRNA CCAT2的表达情况。用比较Ct 值的方法计算相对表达量。扩增条件:预变性 95℃ 1 min,PCR 反应95℃ 20 s、60℃ 1 min,共40个循环(引物序列见表1)。实验重复 3 次,采用2-△△Ct法计算 lncRNA CCAT2 的相对表达量。

表1 siRNA 的序列及qRT-PCR 引物Tab.1 siRNA and primers sequences
5 Western blot 法检测4 种糖酵解相关蛋白的表达水平 细胞转染后48 h,收集各组细胞,每孔加100~ 150 μL RIPA 裂解液充分裂解细胞,BCA法蛋白定量试剂盒检测蛋白浓度,与4×SDS 混合后于100℃煮沸10 min。根据定量结果调整各组加样体积,10% SDS-PAGE 凝胶电泳(80~ 120 V,2 h),电泳后湿转法(200 mA,2 h)转至PVDF膜,5% 脱脂奶粉室温下封闭2 h,每次10 min,根据分子量大小裁剪PVDF 膜。TBST(1×)洗膜液洗膜3 次,每次10 min。一抗浓度为1∶1 000,4℃孵育过夜;洗膜同上;二抗浓度为1∶3 000,室温孵育1 h;洗膜同上;应用数码凝胶图形分析系统检测GLUT1、HK2、PGAM1、LDHɑ的蛋白条带。
6 CCK-8 实验检测胃癌细胞增殖 将转染后处于对数生长期的细胞接种于96 孔板中,每孔含细胞3×103个,每孔体积100 μL,每组设3个重复样孔。细胞贴壁后计为0 h,此后24 h、48 h、72 h、96 h 后吸出培养基,每孔加入100 μL 10% CCK-8溶液,放入培养箱内避光孵育1 h。酶标仪测定450 nm 波长的吸光值,绘制细胞生长曲线。
7 EdU 实验检测胃癌细胞增殖 将转染后处于对数生长期的细胞接种于6 孔板中,培养过夜并且恢复到正常状态后加入等体积浓度为20 μmol/L(2X) 的EdU 工作液,并在37℃、5% CO2条件下孵育2 h。去除培养液和EdU 工作液,加入4%多聚甲醛固定15 min。去除固定液,每孔用1 mL 洗涤液(含3% BSA 的PBS) 洗涤3 次,每次5 min。去除洗涤液,每孔用1 mL 通透液(含0.3% Triton X-100 的PBS)室温孵育15 min。去除通透液,每孔用1 mL 洗涤液洗涤细胞2 次,每次5 min。按照试剂盒说明书加入500 μL 的Click 反应体系,在室温下避光孵育30 min。吸除Click 反应液,用洗涤液洗涤3 次,每次5 min。用PBS 按1∶1 000比例稀释Hoechst 33342 (1000X),吸除洗涤液后,每孔加1X Hoechst 溶液1 mL,室温避光孵育10 min。吸除1X Hoechst 溶液,用洗涤液洗涤3 次,每次5 min,在荧光显微镜下观察拍照。
8 糖酵解水平检测 本实验分别使用葡萄糖摄取、乳酸、丙酮酸、ATP 含量检测试剂盒检测胃癌细胞的葡萄糖摄取率以及乳酸、丙酮酸、ATP 含量。实验按照产品说明书进行,待样本制备完成后,使用全波谱酶标仪根据相应波长测量吸光度,并进行校正比较。
9 统计学处理 应用SPSS 26.0 统计软件对数据进行处理,实验数据以表示,多组间比较采用单因素方差分析,实验组与对照组的两两比较采用Dunnet-t检验,P<0.05 为差异有统计学意义。
结 果
1 siRNA 能够有效降低胃癌细胞lncRNA CCAT2的表达 本研究首先利用siRNA 转染BGC-823、HGC-27 胃癌细胞,qRT-PCR 结果证实两条靶向lncRNA CCAT2 的siRNA 能够显著降低细胞中lncRNA CCAT2 的表达含量,且具有统计学差异(BGC-823:F=178.910,P<0.001;HGC-27:F=109.641,P<0.01)。见图1。

图1 应 用siRNA 敲 低lncRNA CCAT2 的 表 达(a P<0.001,vs NC)。NC 为对照,siCCAT2-1 和siCCAT2-2 为靶向lncRNA CCAT2 的两个小干扰RNAFig.1 Application of siRNA to knock down the expression of lncRNA CCAT2 (aP<0.001,vs NC).NC is the control,siCCAT2-1 and siCCAT2-2 are two small interfering RNAs targeting lncRNA CCAT2
2 敲低lncRNA CCAT2 可抑制胃癌细胞的糖酵解水平 酶标比色法检测葡萄糖吸收量(BGC-823:F=41.573,P<0.001;HGC-27:F=50.658,P<0.001) 以 及ATP(BGC-823 :F=47.775,P<0.05;HGC-27 :F=36.115,P<0.001)、乳酸(BGC-823:F=161.566,P<0.001;HGC-27:F=117.407,P<0.001)、丙酮酸(BGC-823:F=38.644,P<0.001;HGC-27:F=78.588,P<0.01) 产量,结果表明4 项糖酵解相关指标均明显下降(P<0.001,图2)。采用Western blot 法检测糖酵解相关的关键蛋白GLUT1、HK2 PGAM1、LDHα 的表达水平,与对照组相比,这4 种糖酵解相关蛋白呈现明显下调趋势。见图3。

图2 敲低lncRNA CCAT2 后对胃癌细胞糖酵解水平的影响(aP<0.001,bP<0.01,vs NC)Fig.2 Effect of knockdown of lncRNA CCAT2 on the glycolysis level of gastric cancer cells (aP<0.001,bP<0.01,vs NC)

图3 Western blot 检测4 种糖酵解相关蛋白表达水平(GLUT1:葡萄糖转运蛋白1;HK2:己糖激酶2;PGAM1:磷酸甘油酸变位酶1;LDHɑ:乳酸脱氢酶ɑ;β-actin 为内参蛋白。aP<0.001,bP<0.01,vs NC)Fig.3 Expression levels of 4 glycolysis-related proteins were detected by Western blot (GLUT1:glucose transporter 1;HK2:hexokinase 2;PGAM1:phosphoglycerate mutase 1;LDHɑ:lactate dehydrogenase alpha;β -actin is the internal reference protein.aP<0.001,bP<0.01,vs NC)
3 敲低lncRNA CCAT2 可抑制胃癌细胞的增殖能力 使用CCK-8 实验检测胃癌细胞的增殖能力,结果显示敲低lncRNA CCAT2 可抑制胃癌细胞的增殖水平(BGC-823:F=15.988,P=0.004;HGC-27:F=32.884,P=0.001)。EdU 法检测胃癌细胞增殖能力,与对照组相比,敲低lncRNA CCAT2 后胃癌细胞的增殖能力明显下降(BGC-823:F=25.526,P=0.001;HGC-27:F=24.621,P=0.001)。见图4。
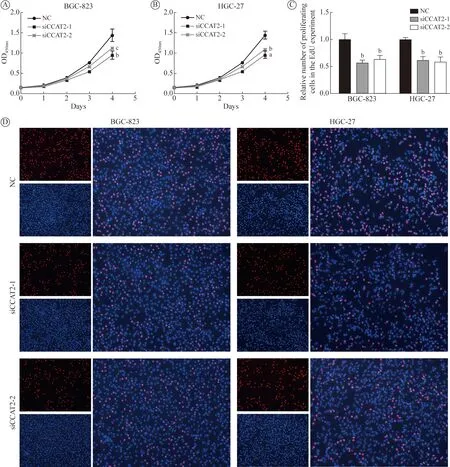
图4 敲低lncRNA CCAT2 后对胃癌细胞增殖能力的影响(aP<0.001,bP<0.01,cP<0.05,vs NC)A、B:CCK-8 实验;C:EdU 实验中的相对增殖细胞数;D:EdU 实验(蓝色代表总的细胞数,红色代表增殖水平的细胞数)Fig.4 Effect of knockdown of lncRNA CCAT2 on the proliferation of gastric cancer cells (aP<0.001,bP<0.01,cP<0.05,vs NC)A,B:CCK-8 experiment;C:the relative number of proliferating cells in the EdU experiment;D:EdU experiment (blue represents the total number of cells,red represents the number of proliferating cells)
讨 论
近年来,lncRNA 在胃癌中的作用机制已有较多研究报道。陈大欣等[10]报道lncRNA ATB 能够显著降低胃癌细胞摄取葡萄糖和乳酸产生的含量,从而影响胃癌的恶性生物学行为。Wang 等[11]研究发现,lncRNA HULC 可以通过LDHA 和PKM2促进肝癌细胞的糖酵解水平。Liao 等[12]研究表明lncRNA EPB41L4A-AS1 通过调控HDAC2 的核糖移位来发挥代谢重编程作用,影响癌细胞的糖酵解水平。Hu 等[13]研究发现敲低lncRNA HOTAIR通过miR-130a-3p/HIF-1α 信号轴抑制肝癌细胞的糖酵解能力。Guo 等[14]发现lncRNA-GC1 可以通过外泌体的形式参与胃癌的恶性行为,可以作为早期胃癌的诊断标志物。可见,lncRNA 在胃癌的诊断、治疗以及恶性生物学行为中起到重要作用,探明其在胃癌中的作用机制可以为胃癌的诊疗提供理论研究基础。
lncRNA CCAT2 是位于人类染色体8q24.21 区域的非编码RNA,最初发现在结肠癌中过度表达,可以促进肿瘤细胞的增殖、侵袭等恶性生物学行为[6,15]。多项研究结果表明,lncRNA CCAT2在食管癌、骨肿瘤等其他实体瘤中也呈现高表达,并且与肿瘤的增殖、侵袭,放化疗抵抗等存在一定关系[16-17]。lncRNA CCAT2 在胃癌中的作用也被逐渐认识。既往研究表明,lncRNA CCAT2的表达水平与胃癌患者预后明显相关,但具体调控机制尚不明确[18-19]。癌细胞的糖代谢功能较特殊,即使在氧气充足的情况下仍然存在十分活跃的糖酵解,甚至是其主要的供能来源[20-22]。因此,我们推测lncRNA CCAT2 可能与胃癌细胞的糖代谢重编程存在机制关联。研究发现,敲低lncRNA CCAT2 直接导致胃癌细胞糖酵解相关行为及代谢物水平下降,GLUT1 等4 种糖酵解相关蛋白的表达也随着lncRNA CCAT2 的降低而下调。GLUT1 是糖代谢的关键蛋白,与葡萄糖具有高度的亲和性,可以促进葡萄糖的转运,在缺氧条件呈现明显的上调趋势,促进了癌细胞的糖酵解能力[23]。PGAM1 是糖酵解途径中的关键酶,可将3-磷酸甘油酸催化生成2-磷酸甘油酸。近年来研究显示,PGAM1 参与肿瘤的发生和发展过程,其在乳腺癌、胰腺癌中呈现高表达[24]。体外实验表明,敲低lncRNA CCAT2 可显著削弱胃癌细胞增殖能力和糖酵解水平。以上实验提示,lncRNA CCAT2 可能通过调节胃癌细胞糖代谢重编程维持其恶性增殖能力。
综上所述,本研究揭示了lncRNA CCAT2与胃癌糖代谢之间的调控关系,敲低lncRNA CCAT2 可抑制胃癌细胞糖酵解能力以及体外增殖速度。实验诠释了lncRNA CCAT2 促进肿瘤恶性进展的潜在机制,为进一步丰富lncRNA 介导糖代谢重编程的机制网络以及寻找胃癌治疗的潜在靶点奠定了实验基础。
利益冲突:所有作者不存在利益冲突。

