油茶籽壳提取液对灵芝生长和灵芝酸代谢的影响
齐慧慧,卢玉栋,章文贤*
(1.福建师范大学生命科学学院, 福建 福州 350007; 2.福建师范大学化学与材料学院, 福建 福州 350007)
灵芝Ganodermalucidum是一种药食两用真菌,富含多糖、三萜、核苷和甾醇等生理活性物质,其中三萜类化合物具有抗肿瘤、保肝、抗菌、抗炎症、降低血糖血脂、抗氧化[1-3]等功效,灵芝酸作为最具代表性的三萜化合物在药用及功能食品领域具有广阔的应用前景。目前,灵芝酸生产大部分源于灵芝发酵,产量不能满足人们的需要,因此提高灵芝酸产量的研究成为灵芝研究领域的热点。
近年来有研究表明,灵芝生长和灵芝酸的代谢受中药及其提取物、金属离子、真菌激发因子和稀土元素等的影响[4-6]。朱强等[7]在灵芝液体发酵培养基中分别添加甘草、山茱萸等中药,发现甘草更利于促进灵芝酸的合成,山茱萸同时促进灵芝生长和灵芝多糖合成。鲍锐[8]在灵芝培养过程中分别添加硫酸铜和氯化钙,将灵芝酸产量提高了57%和29%。高兴喜等[9]以木素木霉、蘑菇轮枝孢和顶头孢为激发子菌株,采用脱脂脱蛋白酸解法制备真菌激发子,发现在发酵初期添加顶头孢激发子可将灵芝酸产量提高5.2倍,在发酵后期添加木素木霉激发子可将灵芝酸产量提高4.0倍。
目前在灵芝培养过程中添加生物质的研究较少,尚未报道过在灵芝培养基中添加油茶籽壳的研究。另有研究表明,油茶籽壳作为碳源能够促进茶树菇、平菇和杏鲍菇的菌丝体生长[10]。此外,多种外源添加物对灵芝酸代谢都有显著影响。因此本研究在灵芝液体发酵过程中添加不同浓度的油茶籽壳提取液,探究油茶籽壳提取液在灵芝液体静置培养过程中对灵芝菌丝生长以及灵芝酸代谢的影响,以期为油茶籽壳的高价值化和灵芝液体静置培养提供借鉴和技术参考。
1 材料与方法
1.1 菌种和材料
灵芝Ganodermalucidum(Leyss.ex Fr.)Karst,由福建师范大学国家教育部工业微生物研究工程中心保藏提供。
油茶籽壳均来自福建省永泰县山茶油加工厂,选用新鲜干燥,无霉变无虫蛀的油茶籽壳,经过预处理粉碎成长宽厚为(0.3~0.6)cm×(0.3~0.6)cm×(0.1~0.15)cm的颗粒。
1.2 培养基质
(1)PDA固体培养基:琼脂粉20 g,葡萄糖20 g,马铃薯200 g,硫酸镁1.5 g,磷酸二氢钾3.0 g,去离子水1 L,维生素 B10.05 g,pH为6.0。(2)种子培养基:葡萄糖35 g,蛋白胨5.0 g,酵母精粉2.5 g,硫酸镁0.5 g,磷酸二氢钾1.0 g,维生素 B10.05 g,pH为6.0。(3)深层液体发酵培养基:葡萄糖35 g,蛋白胨5.0 g,酵母精粉5.0 g,硫酸镁0.5 g,磷酸二氢钾1.0 g,维生素 B10.05 g,pH为6.0。(4)油茶籽壳深层液体发酵培养基:以基础深层培养基(不添加油茶籽壳提取液)为对照,油茶籽壳提取液原液在培养基中的配比分别设置为10%、20%、50%和100%。
1.3 培养方法
1.3.1油茶籽壳提取液制备 将预处理后的油茶籽壳用破碎机打成粉末,过60目筛,油茶籽壳粉与蒸馏水1∶9的比例煮沸30 min,纱布过滤制成油茶籽壳提取液原液。
1.3.2斜面培养 用接种铲将保藏在PDA试管中的灵芝菌丝切下一小块放入新配制的PDA斜面的试管中,30℃恒温培养,至菌丝长满斜面。
1.3.3种子液体培养 在PDA斜面试管中加入10 mL无菌水,用接种铲刮下白色菌丝体倒入种子培养基中。在30℃恒温摇床内培养4 d,转速为120 r·min-1。
1.3.4液体深层发酵培养 吸取20 mL灵芝菌丝接入深层发酵培养基中,每种浓度设置3组平行。在30℃恒温摇床内培养4 d,转速为120 r·min-1。
1.3.5液体静置培养 摇瓶培养4 d后,转移到平板中,每个平板接入25 mL,30 ℃恒温暗培养。静置培养结束时,将上层白色菌丝体取出,蒸馏水冲洗背面,收集备用。
1.4 测定方法
1.4.1灵芝菌丝体生物量的测定 将液体静置培养收集的上层白色菌丝体,放置于平板中,50℃烘干至恒重后称重。再在研钵中充分研磨成粉末,装在 5 mL的离心管中保存在 4℃的冰箱中备用。
1.4.2发酵液中残糖含量的测定 将发酵液离心取上清液,稀释适当倍数,利用葡萄糖氧化酶作为催化剂反应的原理,利用葡萄糖生物传感分析仪测定氧含量变化,由此得到葡萄糖的浓度。
1.4.3总灵芝酸含量的测定 因齐墩果酸和灵芝酸都是三萜类化合物,且化学结构相似,因此用齐墩果酸来绘制总灵芝酸的标准曲线,检测方法采用高氯酸-香草醛显色法[11]。
1.4.4灵芝酸单体的测定 样品前处理,称取1.4.1步骤得到的灵芝菌丝体粉末100 mg,于2 mL的离心管中,加入1 mL70%乙醇,超声处理30 min,静置30 min,重复3次,离心收集上清液;重复上述步骤,将3次离心收集到的上清液烘干。将烘干后的样品用1 mL色谱级甲醇溶解,再用0.22 μm的有机相滤膜过滤到样品瓶中。用高效液相色谱检测灵芝酸单体。HPLC检测条件为:HPLC色谱柱为C18柱 ( Kromasil 100-5-C8,4.6×250 mm,5μm);进样量20 μL;流速1 mL·min-1;流动相A为甲醇/乙酸(100∶0.5=V∶V),流动相B为超纯水;0~20 min,A相为80%~100%,B相为0~20%梯度洗脱;20~30 min,A相为100%,B相为0洗脱;紫外检测波长为245 nm;柱温为30℃;洗脱时间为30 min。记录相应的峰面积和出峰时间。计算出各个灵芝酸单体的含量。
2 结果与分析
2.1 油茶籽壳提取液对灵芝菌丝体生长形态的影响
由图1可知,添加10%和20%油茶籽壳提取液灵芝菌丝直径始终大于对照组,添加50%和100%的则小于对照组。这表明低浓度油茶籽壳提取液有利于灵芝菌丝扩张,高浓度油茶籽壳提取液会抑制灵芝菌丝的向外生长,但高浓度的油茶籽壳提取液促使菌丝生长更加密壮。

图1 油茶籽壳对灵芝菌丝体生长形态的影响Fig.1 Effect of camellia seed shell on the growth morphology of Ganoderma lucidum mycelia
2.2 油茶籽壳提取液对灵芝菌丝体生物量的影响
从图2可知,灵芝菌丝体生物量从静置培养开始随时间不断增加,前6 d生物量增加较快,从第6 d之后进入缓慢生长期,生物量积累较慢。在第6 d,对照组菌丝体生物量为16.7 g·L-1,添加10%、20%和50%油茶籽壳提取液的分别达到了19.2、21.3和16.5 g·L-1,添加100%油茶籽壳提取液为13.3 g·L-1,表明添加100%油茶籽壳提取液对菌丝体的生长有明显抑制作用,添加低浓度的油茶籽壳提取液对菌丝体生长具有一定促进作用。

图2 油茶籽壳对灵芝菌丝体生物量的影响Fig.2 Effect of camellia seed shell on the biomass of Ganoderma lucidum mycelia
2.3 油茶籽壳提取液对灵芝菌丝体发酵液中残糖含量的影响
由图3可知,灵芝菌丝体发酵液中葡萄糖含量随着时间的增加逐渐减少,前6 d的葡萄糖消耗速度较快,在第9 d基本耗尽。从整体趋势分析,添加不同浓度的油茶籽壳提取液能够不同程度地提升灵芝菌丝体对葡萄糖的利用能力。

图3 油茶籽壳提取液对葡萄糖消耗的影响Fig.3 Effect of camellia seed shell extract on the glucose consumption
2.4 油茶籽壳提取液对灵芝菌丝体总灵芝酸含量和产量的影响
由图4A可知,添加20%、50%、100%油茶籽壳提取液的总灵芝酸含量在第9 d达到最高,分别为5.11、6.64和7.97 mg·dg-1,是对照组的1.29、1.67和2.01倍,而添加10%油茶籽壳提取液的灵芝酸含量只有对照的93%。可见高浓度油茶籽壳提取液对灵芝酸的积累有促进作用。由图4B可知,添加10%和20%油茶籽壳提取液的总灵芝酸产量略低于对照组。而50%和100%油茶籽壳提取液使总灵芝酸产量达到了1 406.37和1 599.73 mg·L-1,分别为对照组的1.34和1.52倍。

注:A为总灵芝酸含量;B为总灵芝酸产量图4 油茶籽壳提取液对灵芝菌丝体总灵芝酸含量的影响Fig.4 Effect of camellia seed shell extract on the total content of ganoderic acid in Ganoderma lucidum mycelia
2.5 油茶籽壳提取液对灵芝菌丝体4种灵芝酸单体含量的影响
由图5可知,灵芝菌丝体4种灵芝酸单体的合成在高浓度提取液下都表现出了促进作用:添加50%油茶籽壳提取液的灵芝酸单体GA-Mk、GA-T、GA-S 和GA-Me含量在第9 d分别达到505.973、604.133、369.268和255.967 ug·dg-1,相较于对照组,分别提高了的16.05%、5.5%、32.5%和67.1%。添加100%油茶籽壳提取液的灵芝酸单体GA-Mk、GA-T、GA-S 和GA-Me含量在第9 d分别达到557.327、599.355、418.773和274.443 ug·dg-1,相较于对照组,分别提高了的27.83%、4.7%、50.3%和79.2%。可见在较高浓度范围内,4种灵芝酸单体的含量随着油茶籽壳提取液浓度的增高而增高。
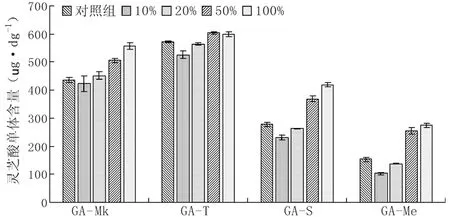
图5 油茶籽壳提取液对灵芝菌丝体灵芝酸单体含量的影响Fig.5 Effect of camellia seed shell extract on the content of ganoderic acid monomer in Ganoderma lucidum mycelia
3 结论与讨论
油茶籽壳作为常见的废弃生物质材料之一,其中包含粗蛋白、纤维素、半纤维素、木质素、还原糖、粗脂肪和灰分等多种成分[12],将其高价值化对环境保护和能源高效利用都具有意义。因此,本试验用不同浓度油茶籽壳提取液对灵芝进行液体静置培养,结果表明,添加高浓度的油茶籽壳提取液对灵芝的生长具有一定抑制作用,较低浓度的油茶籽壳提取液对灵芝的生长有一定促进作用。灵芝菌丝体发酵液的pH随着发酵过程不断降低,油茶籽壳提取液的添加并无影响。添加50%和100%浓度油茶籽壳提取液对灵芝菌丝体总灵芝酸含量和产量均有明显提升作用,相较于对照组,它们的含量分别提升了67%和101%,产量分别提升了34%和52%。4种灵芝酸单体GA-Mk、GA-S、GA-T和GA-Me的生成同样受到高浓度油茶籽壳提取液的促进,100%浓度的油茶籽壳提取液将灵芝酸单体GA-S和GA-Me的含量都提高了50%以上;而低浓度的油茶籽壳提取液(10%和20%浓度)则具有相反的抑制作用。
此前有研究报道,油茶籽壳中还含有总黄酮、花青素、多糖、茶皂素、木糖醇等物质[12]。在其他食用菌中如猴头菇,香菇,小白菇和黑木耳等食用菌中都发现一定浓度的茶皂素对其菌丝生长有显著的抑制作用[13-14],由此推断高浓度提取液条件下的生长抑制或许是由茶皂素导致的。灵芝酸的代谢往往受逆境因素的影响,油茶籽壳中的抑菌因子可能反而诱导灵芝酸的合成。另据裴海生等[15]的研究,木质素作为营养基质培养的灵芝多糖含量和总三萜含量均有提高,油茶籽壳中的木质素也可能是本研究中灵芝酸含量提高的原因。由此可见,油茶籽壳作为灵芝的培养基质具有一定应用价值,同时也是提高灵芝酸产量的一种有效方法。

