星点设计-效应面法优化负载和厚朴酚的当归多糖-小檗碱聚合物胶束的处方工艺研究
王彬彬,吕 白,张 琦,王玲钰,张 旭,于 超,周建文,韩翠艳
星点设计-效应面法优化负载和厚朴酚的当归多糖-小檗碱聚合物胶束的处方工艺研究
王彬彬,吕 白,张 琦,王玲钰,张 旭,于 超,周建文,韩翠艳*
齐齐哈尔医学院药学院,黑龙江 齐齐哈尔 161006
通过星点设计-效应面法优化负载和厚朴酚(honokiol,HNK)的当归多糖(polysaccharide,ASP)-小檗碱(berberine,Ber)聚合物胶束(ASP-SS-Ber/HNK)的处方工艺并考察其制剂学性质。HPLC法测定HNK的含量;采用薄膜水化法制备ASP-SS-Ber/HNK,在单因素实验的基础上,以粒径、载药量以及包封率为评价指标,对载药比、水化温度和水化时间进行处方工艺筛选,采用星点设计-效应面法进行3因素3水平的实验,分析结果得出最优处方工艺并对其进行验证;使用透射电子显微镜(TEM)和粒径仪观察测定ASP-SS-Ber/HNK形态、平均粒径和ζ电位,通过体外释药对该载药系统进行评价并考察其稳定性。优化得到的ASP-SS-Ber/HNK最佳处方工艺:当归多糖-小檗碱载体(ASP-SS-Ber)与HNK的投药量分别为5.00 mg和0.71 mg、水化温度为30 ℃、水化时间为100 min。采用最优处方制得的负载HNK的胶束制剂对HNK的载药量为(9.22±0.42)%,包封率为(71.77±1.20)%;胶束平均粒径为(44.38±2.95)nm;ζ电位接近于(−10.32±1.26)mV。在含有谷胱甘肽(GSH为10 mmol/L)的体外释放介质中72 h累积释放率达到80.2%;12 h的吸光度维持在0.29±0.01,连续7 d内的粒径稳定在(45.14±0.67)nm,ζ电位稳定在(−10.46±0.60)mV。星点设计-效应面法所建立的模型精度高,可用于ASP-SS-Ber/HNK胶束制剂的处方优化。
和厚朴酚;当归多糖;小檗碱;胶束;薄膜水化法;星点设计-效应面法
靶向纳米颗粒的制备一般是在纳米颗粒表面修饰靶向配体,因而可以与细胞表面受体特异性地相互作用[1]。与引入肝靶向基团的复杂性相比,具有内在肝靶向能力的多糖则使制备更为简单[2]。当归多糖(polysaccharide,ASP)是中药当归的主要活性成分之一,具有天然的肝脏靶向功能[3]。所以构建以当归多糖为亲水链段的胶束而不进行任何靶向修饰是一种很好的策略[4-5]。小檗碱(berberine,Ber)是一种亲脂性阳离子,本身具有抗肝癌作用及靶向线粒体的特性[6],但是较差的膜通透性使其不易进入细胞,较低的生物利用度也限制了其应用[7]。利用二硫键将当归多糖与小檗碱相连,将其作为胶束的疏水链段,提高了小檗碱的跨膜性[8],小檗碱定位于线粒体处,在线粒体高浓度的谷胱甘肽(glutathione,GSH)下[9],使具有氧化还原敏感的二硫键裂解,释放出所负载的药物[10]。和厚朴酚(honokiol,HNK)是厚朴的主要活性成分[11],具有线粒体依赖性的抗肿瘤作用[12-13],在抗肝癌方面展现出较好的药理活性,但是较差的溶解性导致其具有较低的药效[14-15]。因此,将其包载在当归多糖与小檗碱连接构建的载体(ASP-SS-Ber)中,可改善其溶解性,在靶向线粒体的同时提高药效。制备ASP-SS-Ber/HNK理论上可以利用当归多糖[16]和小檗碱[17]的特性,起到靶向抗肿瘤的作用。
本研究以胶束平均粒径以及和厚朴酚包封率和载药量为评价指标,考察负载和厚朴酚的当归多糖-小檗碱聚合物胶束(ASP-SS-Ber/HNK)处方中主要因素对制剂的影响,确定了最优处方[18-19],为制剂的进一步研究奠定了基础。
1 仪器与材料
1.1 仪器
高效液相色谱仪,山东鲁南瑞虹有限公司;Zetasizer Nano-ZS90纳米粒度仪,英国Malvern仪器有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限公司;UV-2550紫外可见分光光度计,北京浦西通用仪器有限公司;5417R高速冷冻离心机,德国Eppendof公司;AL 204电子天平,梅特勒-托利多上海有限公司;一次性无菌注射器,辽宁众源医疗器械有限公司;Genex Beta移液器,北京普析通用仪器有限公司;HT7700透射电子显微镜,日立高新技术公司;S-250D超声细胞破碎仪,美国Branson公司;EYELA旋转蒸发仪,郑州科泰实验设备有限公司;QT-2涡旋混合器,上海琪特分析仪器有限公司;ZHWY-200D恒温培养振荡器,上海智城分析仪器有限公司。
1.2 试药
和厚朴酚,批号MB5989,质量分数98%,大连美仑生物技术有限公司;当归多糖,批号B25568,质量分数90%,相对分子质量40 000左右,上海源叶生物科技有限公司;盐酸小檗碱(批号B802465,质量分数98%)、芘(批号P817273,质量分数99%)、还原型谷胱甘肽(批号G6268,质量分数99%,生物技术级)、聚乙二醇(PEG)2000(批号D875844,质量分数98%),上海麦克林生化科技有限公司;ASP-SS-Ber,课题组自制;甲醇、乙腈,色谱纯,天津市科密欧有限公司;泊洛沙姆-188(批号WPWL549B,质量分数98%)、二甲基亚砜(分析纯),上海阿拉丁生化科技股份有限公司;Kolliphor ELP(批号Batch Weight,纯化级),北京凤礼精求医药股份有限公司;透析袋,截留相对分子质量14 000,上海易佰聚经贸有限公司;丙酮,分析纯,哈尔滨化工化学试剂厂;磷酸盐缓冲液(PBS,pH 7.5),上海盛思生化科技有限公司;2%磷钨酸负染液,北京酷来搏科技有限公司;聚山梨酯80,质量分数97%,国药集团化学试剂有限公司;胎牛血清,美国Hyclone公司。
2 方法与结果
2.1 ASP-SS-Ber/HNK的制备
分别称取一定量的和厚朴酚与ASP-SS-Ber置于50 mL圆底烧瓶中,加入10 mL甲醇,超声使其充分溶解,加入表面活性剂后采用旋转蒸发仪去除有机溶剂,缓慢加入5 mL去离子水,使其薄膜水化,10 000r/min离心(离心半径13.5 cm)10 min后0.22 μm微孔滤膜滤过,即得ASP-SS-Ber/HNK胶束。空白胶束(ASP-SS-Ber)为不加和厚朴酚,其余同ASP-SS-Ber/HNK的制备过程。
2.2 色谱条件
色谱柱为Diamonsil C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(70∶30);检测波长292 nm;进样量20 μL;体积流量1.0 mL/min;柱温40 ℃。在该条件下和厚朴酚对照品溶液峰理论塔板数大于3000,分离度大于1.5。
2.3 和厚朴酚载药量、包封率的测定
采用滤膜滤过法进行聚合物胶束药物包封率的测定。取500 μL和厚朴酚聚合物胶束溶液,过0.22 μm滤膜后加入500 μL甲醇超声破乳,即得ASP-SS-Ber/HNK供试品溶液。按“2.2”项下色谱条件进样分析,色谱图见图1,ASP-SS-Ber/HNK与和厚朴酚峰的分离度()大于1.5,空白胶束在和厚朴酚处无干扰,专属性良好。将所得峰面积带入线性方程计算ASP-SS-Ber/HNK中和厚朴酚的含量。
包封率=胶束中包封的药物的质量/加入药物的质量
载药量=胶束中包封的药物的质量/(加入药物的质量+加入的载体材料的质量)
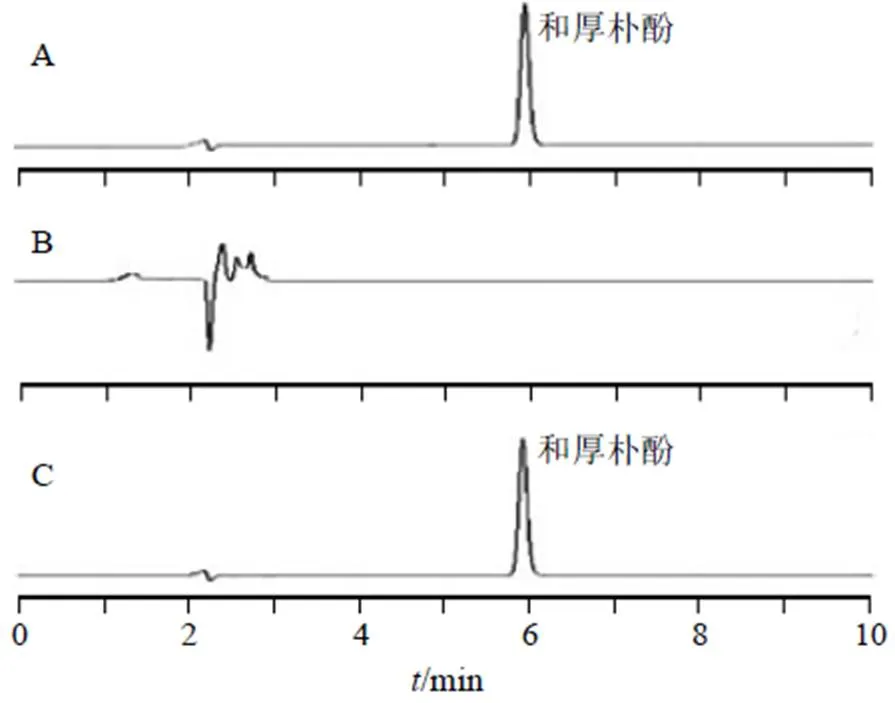
图1 和厚朴酚对照品溶液(A)、ASP-SS-Ber溶液 (B)、ASP-SS-Ber/HNK溶液(C)的HPLC图
2.4 单因素考察
2.4.1 溶剂用量的考察 在其他条件固定时,即表面活性剂为聚氧乙烯蓖麻油,用量为200 μL,载药比为1,水化温度为20 ℃,水化时间为40 min,加入一定量的ASP-SS-Ber和和厚朴酚分别溶解于3、5、10、15 mL甲醇中,考察不同溶剂用量对粒径、包封率和载药量的影响。结果(表1)显示,当加入甲醇的量为10 mL时和厚朴酚的载药量与包封率最高,因此选择10 mL作为溶剂用量。
2.4.2 表面活性剂种类选择 在其他条件固定时,即溶剂用量为10 mL,表面活性剂用量为200 μL,载药比为1,水化温度为20 ℃,水化时间为40 min,分别加入注射剂常用的表面活性剂[20]泊洛沙姆-188、PEG 2000和聚氧乙烯蓖麻油,考察不同表面活性剂种类对粒径、包封率和载药量的影响。结果(表2)显示,当选择聚氧乙烯蓖麻油时,和厚朴酚的载药量与包封率最高,因此选择聚氧乙烯蓖麻油作为表面活性剂来制备ASP-SS-Ber胶束。
表1 ASP-SS-Ber/HNK溶剂用量的选择 (, n = 3)
Table 1 Selection of ASP-SS-Ber/HNK solvent volume (, n = 3)
甲醇用量/mL粒径/nmPDI包封率/%载药量/% 389.39±2.050.216±0.1462.62±0.150.44±0.53 550.05±0.160.175±0.06210.65±0.131.77±0.24 1046.34±1.740.145±0.82326.11±1.248.71±0.15 1545.77±1.230.201±0.45224.15±0.686.32±0.21
表2 ASP-SS-Ber/HNK表面活性剂种类选择(, n = 3)
Table 2 Selection of ASP-SS-Ber/HNK surfactant types (, n = 3)
表面活性剂种类粒径/nmPDI包封率/%载药量/% 泊洛沙姆63.35±1.250.383±0.25312.13±0.082.17±0.03 PEG 200042.67±0.240.585±0.05112.62±0.332.37±0.05 聚氧乙烯蓖麻油67.88±1.030.249±0.55237.63±0.786.47±0.21
2.4.3 表面活性剂聚氧乙烯蓖麻油用量的选择 在其他条件固定时,即溶剂用量为10 mL,表面活性剂为聚氧乙烯蓖麻油,载药比为1,水化温度为20 ℃,水化时间为40 min,分别加入200、300、400、500 μL的聚氧乙烯蓖麻油,考察表面活性剂用量对粒径、包封率和载药量的影响。结果(表3)显示,当聚氧乙烯蓖麻油用量为400 μL时和厚朴酚的载药量与包封率最高,因此聚氧乙烯蓖麻油用量选择为400 μL。
表3 ASP-SS-Ber/HNK聚氧乙烯蓖麻油量的选择(, n = 3)
Table 3 Selection of amount of ASP-SS-Ber/HNK polyoxyethylene castor oil (, n = 3)
聚氧乙烯蓖麻油用量/μL粒径/nmPDI包封率/%载药量/% 20060.24±1.650.412±0.12640.05±0.476.56±0.33 30056.14±0.230.256±0.28963.30±1.3510.35±2.53 40044.14±1.200.120±0.22368.52±0.2811.54±0.56 50045.50±1.730.301±0.11264.40±0.6810.27±0.20
2.4.4 载药比(载体与药物质量比)的选择 在其他条件固定时,即溶剂用量为10 mL,表面活性剂为聚氧乙烯蓖麻油,用量为400 μL,水化温度为20 ℃,水化时间为40 min,精密称取载体5.00 mg,加入不同质量的药物,即载药比分别为1、3、5、7、9时,考察不同载药比对粒径、包封率和载药量的影响。结果(表4)显示,随着载体量的增加,和厚朴酚的载药量与包封率先升高后降低,因此将范围5、7、9的载药比设为待优化项进行星点设计-效应面法实验。
表4 ASP-SS-Ber/HNK载药比选择(, n = 3)
Table 4 ASP-SS-Ber/HNK drug loading ratio selection (, n = 3)
载药比粒径/nmPDI包封率/%载药量/% 170.93±1.450.262±0.0714.91±0.102.49±0.06 364.52±1.270.242±0.09563.13±1.3615.60±0.22 544.46±1.560.574±0.12264.57±1.6211.45±0.20 744.49±1.230.512±0.10470.23±1.068.69±0.18 938.25±1.650.562±0.08269.09±0.506.35±0.08
2.4.5 水化温度的考察 在其他条件固定时,即载体与药物的比例为7,制剂质量浓度为0.7 mg/mL,溶剂用量为10 mL,表面活性剂为聚氧乙烯蓖麻油,用量为400 μL,水化时间为40 min,考察水化温度在20、30、40、50、60 ℃时,不同水化温度对粒径、包封率和载药量的影响。结果(表5)显示,随着水化温度的增加,和厚朴酚的载药量与包封率均先增加后降低。因此将20~40 ℃的水化温度作为待优化项进行星点设计-效应面法实验。
2.4.6 水化时间的考察 在其他条件固定时,载体与药物的比例为7,制剂质量浓度为0.7 mg/mL时,溶剂用量为10 mL,表面活性剂为聚氧乙烯蓖麻油,用量为400 μL,水化温度为30 ℃,考察水化时间在40、60、80、100、120 min时,不同水化时间对粒径、包封率和载药量的影响。结果(表6)显示,随着水化时间的增加,和厚朴酚的载药量与包封率均先增加后降低。因此将80~120 min的水化时间作为待优化项进行星点设计-效应面法实验。
表5 ASP-SS-Ber/HNK水化温度选择(, n = 3)
Table 5 ASP-SS-Ber/HNK hydration temperature selection (, n = 3)
水化温度/℃粒径/nmPDI包封率/%载药量/% 2070.93±1.690.262±0.09110.80±0.291.46±0.15 3044.52±1.520.242±0.06571.59±1.089.68±0.17 4044.46±1.260.574±0.05763.12±0.427.68±0.05 5044.49±1.340.512±0.07658.76±1.949.68±0.17 6038.25±1.260.562±0.04553.04±1.306.96±0.17
表6 ASP-SS-Ber/HNK水化时间选择(, n = 3)
Table 6 ASP-SS-Ber/HNK hydration time selection (, n = 3)
水化时间/min粒径/nmPDI包封率/%载药量/% 6038.91±0.130.583±0.07852.59±0.706.84±0.09 8022.87±1.220.476±0.03464.68±2.188.04±0.36 10040.84±1.570.416±0.02369.54±0.448.27±0.17 12029.94±1.630.736±0.04358.95±1.317.62±0.18 14027.12±1.590.934±0.02256.60±0.287.10±0.04
2.5 星点设计-效应面法优化处方
以单因素实验结果为依据,进一步采用星点设计-效应面法优化制剂工艺。选取载药比(1)、水化温度(2)和水化时间(3)3个因素,每因素设3个水平(代码值分别为−1、0、+1)。以和厚朴酚包封率(1)、和厚朴酚载药量(2)和胶束粒径(3)为考察指标进行3因素3水平的星点设计-效应面法实验,结果见表7。利用Design-Expert 10.0.3统计软件对表7数据进行统计处理,并获得1、2、3值对自变量1、2、3的多元线性回归方程,各考察指标的2项式拟合方程如下1=70.07+7.551+3.242+4.043-1.2712-1.0613+0.5623-12.0312-11.1322-11.5532,<0.01,2=0.913 4;2=8.63-0.651+0.712+0.383-0.3612-0.1213+0.6223-1.0512-1.4322-1.6832,=0.007 1,2=0.906 7;3=45.73+1.831-0.132+0.683-0.6612+0.2613-1.2123-6.4312-2.9022-5.7332,=0.000 1,2=0.972 2。各方程的方差分析结果见表8,3个模型均具有显著性差异(<0.05),能较好反映因素对响应值的影响。进一步分析各方程中的各项,1、12、22、32对1有显著性影响;1、2、12、22、32对2有显著性影响;1、12、22、32对3有显著性影响。
利用Design-Expert 10.0.3软件的Analysis模块绘制自变量对因变量的三维效应面和二维等高线图:即1、2对1;1、2对2;1、2对3的三维效应面图和等高线图,结果见图2。结果表明,在考察范围内,愈接近较佳区,面的弯曲度就越大,限制考察指标1、2、3为尽量大,继续应用Design-Expert 10.0.3软件Optimization模块叠加各模型所得的最佳条件范围得到最终的最优处方:ASP-SS-Ber与和厚朴酚的投药量分别为5.00 mg和0.71 mg、水化温度为30 ℃、水化时间100 min。预测在此条件下制备ASP-SS-Ber/HNK的和厚朴酚载药量与包封率分别为8.63%、70.07%。
表7 ASP-SS-Ber/HNK制备工艺星点设计安排及结果
Table 7 Central composite design and results of preparation technology of ASP-SS-Ber/HNK
试验号X1X2/℃X3/minY1/%Y2/%Y3/nm 17 (0)30 (0)100 (0)75.119.1145.85 27 (0)30 (0)100 (0)72.769.0045.83 39 (+1)30 (0)80 (−1)55.055.3734.95 49 (+1)30 (0)120 (+1)59.256.1135.43 57 (0)30 (0)100 (0)61.577.4346.04 65 (−1)30 (0)80 (−1)31.615.4432.23 75 (−1)30 (0)120 (+1)40.036.6731.68 87 (0)30 (0)100 (0)74.368.9745.94 95 (−1)40 (+1)100 (0)48.738.3435.85 109 (+1)40 (+1)100 (0)55.055.3338.60 119 (+1)20 (−1)100 (0)47.614.6738.28 127 (0)20 (−1)120 (+1)50.254.4240.76 137 (0)30 (0)100 (0)66.548.6545.00 147 (0)40 (+1)120 (+1)54.387.1436.19 157 (0)20 (−1)80 (−1)41.525.1335.59 165 (−1)20 (−1)100 (0)36.226.2532.89 177 (0)40 (+1)80 (−1)43.395.3735.89
2.6 最优处方的验证试验
以上述最优处方条件制备5批ASP-SS-Ber/ HNK,测定和厚朴酚载药量、包封率,以及胶束粒径,结果见表9。和厚朴酚平均载药量为(9.22±0.42)%、平均包封率为(71.77±1.20)%、胶束平均粒径为(44.38±2.95)nm,实测值与预测值的误差均小于3%,实验预测性较好,且3个考察指标的RSD值均较小,工艺重现性较好。
2.7 粒径、电位测量
取制备好的ASP-SS-Ber/HNK溶液,用Zetasizer Nano-ZS90纳米粒度仪测定其粒径、粒度分布及电位。结果如图3所示,ASP-SS-Ber/HNK的粒径为(44.38±2.95)nm,多分散指数(polydispersed index,PDI)0.473±0.33,粒径分布较为均匀,ζ电位为(−10.32±1.26)mV。
表8 响应面拟合模型对包封率、载药量、粒径的方差分析
Table 8 Response surface fitting model on variance analysis of encapsulation rate, load capacity and particle size
方差来源自由度包封率载药量粒径 离均差平方和均方F值P值离均差平方和均方F值P值离均差平方和均方F值P值 模型92 574.74286.088.200.005 638.804.317.560.007 1422.0146.8927.190.000 1 X11455.57455.5713.060.008 63.413.415.970.044 526.6826.6815.470.005 7 X2184.1884.182.410.164 34.084.087.150.031 90.130.130.070.793 5 X31130.73130.733.750.094 11.151.152.010.199 03.673.672.130.187 9 X1X216.436.430.180.680 70.510.510.900.375 31.741.741.010.348 3 X1X314.454.450.130.731 40.060.060.110.755 10.270.270.150.706 6 X2X311.281.280.0370.853 71.541.542.700.144 65.885.883.410.107 3 X121609.63609.6317.480.004 14.654.658.150.024 5174.00174.00100.88<0.000 1 X221521.84521.8414.960.006 18.658.6515.170.005 935.3735.3720.510.002 7 X321561.72561.7216.100.005 111.93 11.9320.920.002 6138.29138.2980.18<0.000 1 残差7244.1934.88 3.990.57 12.071.72 失拟项3108.4436.151.070.457 32.070.691.430.357 311.383.7921.750.006 1 纯误差4135.7533.94 1.920.48 0.700.17 总离差162 818.93 42.79 434.08
2.8 胶束形态学
取制备好的ASP-SS-Ber/HNK溶液,纯化水稀释10倍后,滴加至TEM专用铜网上,晾至半干后,滴加2%的磷钨酸负染液,静置晾干后,转移至透射电镜下观察,如图4所示,ASP-SS-Ber/HNK在透射电镜下观察,呈类圆形,表面较光滑,且分散均匀,无黏连现象。

图2 X1、X2对Y1、Y2、Y3的效应面图和等高线图
表9 最优处方的验证试验
Table 9 Three batches samples for verification of optimized formulation
试验号Y1/%Y2/%Y3/nm 173.959.0646.90 273.348.9842.47 370.728.6643.06 471.879.0941.11 568.9910.3048.36 平均值71.779.2244.38 预测值70.078.6345.73 相对误差/%1.200.422.95
2.9 体外药物释放研究
将1 mLASP-SS-Ber/HNK放入透析袋(截留相对分子质量14 000)中。透析袋两端夹紧,分别浸没在不同浓度的GSH(0、0.1、1.0、10.0 mmol/L)的PBS(含0.5%聚山梨酯80、pH 7.4)中,同时设置对照组(游离的和厚朴酚)。于37 ℃恒温摇床中以100 r/min速率水平震荡72 h。在预定的时间点(0.5、1、2、4、8、12、24、48、72 h)采集1 mL样品,然后补充相同体积的新鲜释放介质。样品过0.45 μm滤膜后注入HPLC,根据下式计算体外累积释放率。

图3 ASP-SS-Ber/HNK的粒径分布(A)和电位分布(B)
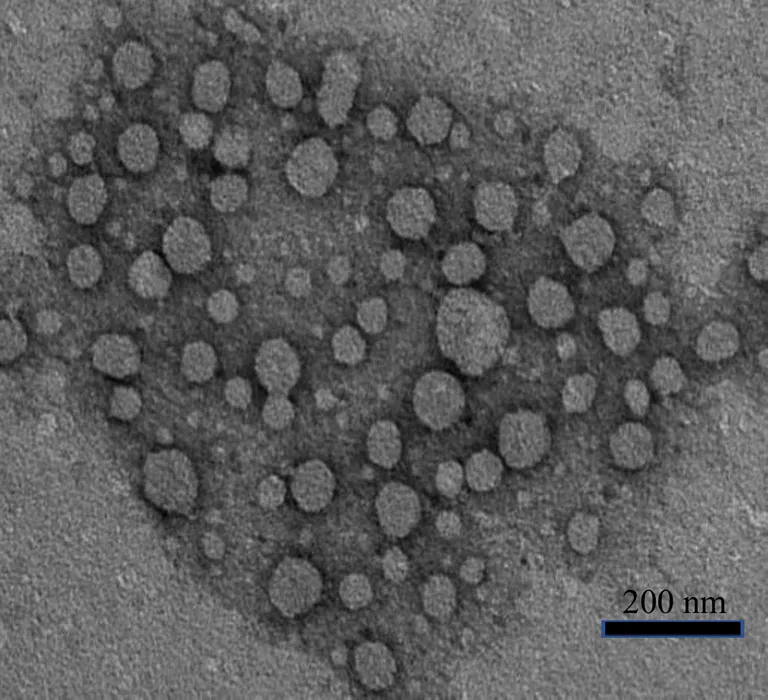
图4 ASP-SS-Ber/HNK的透射电镜照片
Q=CV0+∑CV/0
Q为第个时间点的累积释放百分率,C为第个时间点的药物浓度,0为释放介质的体积,C为第个时间点的药物浓度,V为所取样品体积,0为载药胶束中药物的质量
不同GSH浓度下的ASP-SS-Ber/HNK和和厚朴酚释放曲线如图5所示。在最初的12 h内,和厚朴酚快速释放,累积释放率为(79.75±2.13)%;24 h累积释放率为(89.10±3.32)%;72 h累积释放率为(92.57±2.20)%;随着释放介质中GSH浓度的增加,ASP-SS-Ber/HNK中和厚朴酚的累计释放率也逐渐增加。释放介质中GSH的浓度为0、0.10、1.00、10.00 mmol/L时,ASP-SS-Ber/HNK中和厚朴酚48 h累积释放率分别为(4.15±1.27)%、(40.2±2.25)%、(54.10±2.27)%、(78.50±1.25)%;72 h的累积释放率分别为(5.32±2.36)%、(46.20±2.65)%、(60.70±2.26)%、(80.20±2.21)%。结果表明,ASP-SS-Ber/HNK具有良好的GSH敏感药物释放能力,且ASP-SS-Ber/HNK作为载体具有良好的药物缓释功能。

图5 ASP-SS-Ber/HNK在不同溶液中的累积释放率(, n = 3)
2.10 体外、血清及包封率稳定性考察
2.10.1 储存稳定性 取ASP-SS-Ber/HNK溶液,通过Zetasizer ZS 90纳米粒度仪连续测定其粒径和电位的数值变化,测定时间为1周,结果见表10。
2.10.2 包封率稳定性 按照“2.3”项下包封率的测定方法,通过HPLC连续测定并计算其包封率的变化,测定时间为1周,考察样品的包封率稳定性,结果见表10。
2.10.3 血清稳定性 取适量载药胶束ASP-SS-Ber/ HNK溶液,将其置于加有血清的96孔板中,培养12 h,其中以每小时测定的频率置于酶标仪下(490 nm)记录吸光度()值,通过值的改变,考察样品的血清稳定性,结果见表11。
ASP-SS-Ber/HNK胶束溶液在12 h的吸光度维持在0.29±0.01,7 d内的粒径稳定在(45.14±0.67)nm,电位稳定在(−10.46±0.60)mV,包封率稳定在(70.42±0.63)%。结果表明,该胶束储存、血清及包封率稳定性良好。
表10 ASP-SS-Ber/HNK的粒径、ζ电位、包封率稳定性考察(, n = 3)
Table 10 Investigation of particle size, ζ potential and encapsulation efficiency stability(, n = 3)
t/d粒径/nmζ电位/mV包封率/% 143.70±0.38−12.03±0.6370.07±0.48 245.75±0.83−9.81±0.5668.59±0.63 345.46±0.93−9.11±0.7370.25±0.83 443.92±0.70−10.90±0.4971.63±0.80 545.57±0.52−11.90±0.5169.45±0.62 646.49±0.41−8.67±0.4470.52±0.71 745.07±0.94−10.77±0.8472.43±0.34
表11 血清稳定性
Table 11 Serum stability
t/hA值t/hA值t/hA值 10.29±0.0250.27±0.0290.30±0.01 20.30±0.0160.29±0.01100.30±0.01 30.29±0.0170.26±0.02110.29±0.01 40.32±0.0180.28±0.02120.31±0.01
3 讨论
采用薄膜水化法[21]制备胶束时,初始阶段和厚朴酚的载药量和包封率均偏低,因此尝试加入表面活性剂来增加载体在溶剂中的溶解量,和厚朴酚的包封率和载药量均得到了较好的改善。随后对注射剂中3种常用的表面活性剂进行筛选,其中聚氧乙烯蓖麻油的增溶效果最好并且可溶于水、乙醇、丙二醇等溶剂[22],特别适合含有疏水性物质的水溶液产品的制备,并且在动物体中的毒性试验表明,聚氧乙烯蓖麻油基本无毒、无刺激性[23]。因此经比较最终确定为不易诱导红细胞溶血且增溶效果好的聚氧乙烯蓖麻油。
研究表明,肿瘤细胞内的GSH(2~10 mmol/L)浓度是细胞外GSH浓度(2~10 μmol/L)1000倍以上,比正常细胞内浓度高4倍,尤其在一些耐药肿瘤细胞中,GSH甚至要高出10倍[24]。值得注意的是,肿瘤细胞内线粒体处的GSH浓度则更高[25]。聚合物载体ASP-SS-Ber的亲水端当归多糖和疏水端小檗碱是通过二硫键相连,而二硫键具有谷胱甘肽敏感性,添加谷胱甘肽,使得二硫键裂解,释放出和厚朴酚[1]。
在释放实验中,释放介质未加入GSH时,HPLC下检测到极低的和厚朴酚峰面积,72 h和厚朴酚的释放仅为(5.32±2.36)%。和厚朴酚在0.1 mmol/L GSH释放介质中72 h的累计释放率为(46.2±2.65)%,而在1.0、10.0 mmol/L GSH释放介质中和厚朴酚的累计释放率达到(60.7±2.26)%和(80.2±2.21)%,分别是0.1 mmol/L GSH的1.3倍和1.7倍,当GSH浓度增加ASP-SS-Ber/HNK二硫键裂解,释放出更多的和厚朴酚,和厚朴酚的释放具有GSH浓度相关性。而在4种释放介质中GSH浓度下48 h与72 h的累计释放率变化很小,可能的原因是,在GSH的作用下,48 h时,ASP-SS-Ber/HNK中二硫键裂解的化学反应达到了化学平衡点,和厚朴酚的释放基本达到平衡,ASP-SS-Ber/ HNK 48 h可基本发挥药效[2]。
综上,本研究采用薄膜水化法制备了ASP-SS- Ber/HNK胶束,并通过加入聚氧乙烯蓖麻油作为表面活性剂提高了ASP-SS-Ber/HNK的包封率和载药量,进一步通过单因素实验与星点设计-效应面法实验优化得到ASP-SS-Ber/HNK的最优处方工艺。该胶束制剂在电镜下形貌呈圆形,粒径(44.38±2.95) nm,ASP-SS-Ber/HNK的血清稳定性是根据粒子均匀分散在血清中的紫外吸光度值进行考察的,如粒子不稳定,就会在血清中发生聚集,吸光度就会增大。结果显示的ASP-SS-Ber/HNK血清溶液在12 h内吸光度未见明显增大,表明粒子未发生聚集,比较稳定。ASP-SS-Ber/HNK具有GSH浓度依赖性的释放,为该制剂的有效开发奠定了基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Fang L, Lin H, Wu Z F,./vivo evaluation of novel mitochondrial targeting charge-reversal polysaccharide- based antitumor nanoparticle [J]., 2020, 234: 115930.
[2] Fang L, Fan H Y, Guo C J,. Novel mitochondrial targeting multifunctional surface charge-reversal polymeric nanoparticles for cancer treatment [J]., 2019, 15(11): 2151-2163.
[3] Guo C J, Hou X Y, Liu Y H,. Novel Chinesepolysaccharide biomimetic nanomedicine to curcumin delivery for hepatocellular carcinoma treatment and immunomodulatory effect [J]., 2021, 80: 153356.
[4] Wang K P, Xu J Y, Liu Y,. Self-assembledpolysaccharide nanoparticles with an instinctive liver-targeting ability as a drug carrier for acute alcoholic liver damage protection [J]., 2020, 577:118996.
[5] Zhang Y, Cui Z, Mei H,.polysaccharide nanoparticles as a targeted drug delivery system for enhanced therapy of liver cancer [J]., 2019, 219: 143-154.
[6] Tuo J, Xie Y Q, Song J,. Development of a novel berberine-mediated mitochondria-targeting nano-platform for drug-resistant cancer therapy [J]., 2016, 4(42): 6856-6864.
[7] Yin J T, Hou Y T, Yin Y Y,. Selenium-coated nanostructured lipid carriers used for oral delivery of berberine to accomplish a synergic hypoglycemic effect [J]., 2017, 12: 8671-8680.
[8] Song J, Lin C C, Yang X,. Mitochondrial targeting nanodrugs self-assembled from 9--octadecyl substituted berberine derivative for cancer treatment by inducing mitochondrial apoptosis pathways [J]., 2019, 294: 27-42.
[9] Cheng Y, Ji Y H. Mitochondria-targeting nanomedicine self-assembled from GSH-responsive paclitaxel-ss-berberine conjugate for synergetic cancer treatment with enhanced cytotoxicity [J]., 2020, 318: 38-49.
[10] Yang G L, Chen C, Zhu Y C,. GSH-activatable NIR nanoplatform with mitochondria targeting for enhancing tumor-specific therapy [J]., 2019, 11(48): 44961-44969.
[11] Tan L H, Wang Y F, Ai G X,. Dihydroberberine, a hydrogenated derivative of berberine firstly identified in, exerts anti-inflammatory effect via dual modulation of NF-κB and MAPK signaling pathways [J]., 2019, 75: 105802.
[12] 史晓佳. 和厚朴酚线粒体靶向衍生物的合成与抗肿瘤活性研究 [D]. 济南: 山东大学, 2020.
[13] 黄家喜, 李晶, 鲍翠玉. 和厚朴酚对高脂所致心肌细胞氧化应激损伤的保护作用及其与内质网应激-线粒体凋亡通路的相关性 [J]. 中国药理学通报, 2020, 36(6): 809-814.
[14] Ong C P, Lee W L, Tang Y Q,. Honokiol: A review of its anticancer potential and mechanisms [J]., 2019, 12(1): 48.
[15] 陈一桢, 张文娟, 唐兰如, 等. 和厚朴酚长循环脂质体的制备及药动学研究 [J]. 中草药, 2017, 48(18): 3720-3727.
[16] 孙强, 何曼, 张梦, 等. 小檗碱抗肿瘤作用机制的研究进展 [J]. 中草药, 2021, 52(2): 603-612.
[17] Zhu D W, Tao W, Zhang H L,. Docetaxel (DTX)-loaded polydopamine-modified TPGS-PLA nanoparticles as a targeted drug delivery system for the treatment of liver cancer [J]., 2016, 30: 144-154.
[18] 梁宇飞, 张欣欣, 许洁, 等. 星点设计-效应面法优化姜黄素-胡椒碱聚合物复方胶束的处方工艺研究 [J]. 中草药, 2020, 51(1): 43-50.
[19] 张喜武, 李秋晗, 刘美欣, 等. 星点设计-效应面法优化丁香苦苷聚乳酸-羟基乙酸纳米粒的制备工艺 [J]. 中草药, 2019, 50(17): 4108-4113.
[20] Kumar S, Jiang D W, Sun B Y,. Labeling of erythrocytes by porphyrin-phospholipid [J]., 2021, 1(1): 2000013.
[21] 宁双成, 周莉莉, 王敏, 等. 星点设计-效应面法优化斑蝥素纳米结构脂质载体处方工艺 [J]. 中草药, 2019, 50(17): 4114-4122.
[22] 易红, 高进, 杨华, 等. 几种注射用表面活性剂的质量标准及安全性概述 [J]. 中国实验方剂学杂志, 2010, 16(1): 115-119.
[23] 刁兆玉, 成朋, 王仲妮. 表面活性剂溶血作用的研究进展 [J]. 食品与药品, 2010, 12(3): 125-129.
[24] 万冬, 习钰晶, 李孙帆, 等. 基于肿瘤微环境的响应性纳米药物载体的研究进展 [J]. 化学工业与工程, 2021, 38(5): 80-87.
[25] Fang L, Zhang W, Wang Z,. Novel mitochondrial targeting charge-reversal polysaccharide hybrid shell/core nanoparticles for prolonged systemic circulation and antitumor drug delivery [J]., 2019, 26(1): 1125-1139.
Optimization of prescription process ofpolysaccharide-berberine micelle loaded with honokiol by central composite design-response surface method
WANG Bin-bin, LYU Bai, ZHANG Qi, WANG Ling-yu, ZHANG Xu, YU Chao, ZHOU Jian-wen, HAN Cui-yan
School of Pharmacy, Qiqihar Medical College, Qiqihar 161006, China
To optimize the prescription process ofpolysaccharide (ASP)-berberine (Ber) micelle loaded with honokiol (HNK) (ASP-SS-Ber/HNK) by central composite design-response surface method and investigate its formulation properties.The content of HNK was determined by HPLC; ASP-SS-Ber/HNK was prepared by thin film hydration method. On the basis of single factor experiment, particle size, drug loading and encapsulation rate were used as the evaluation index to screen the prescription process for drug loading ratio, hydration temperature and hydration time. Central composite design-response surface method was used to carry out three factors and three levels experiment, and the results were analyzed to get the optimal prescription process and verify it. The morphology, average particle size and ζ potential of ASP-SS-Ber/HNK were observed and determined by transmission electron microscope and particle size analyzer, and the drug delivery system was evaluated bydrug release and its stability was examined.The optimal preparation process was as follow: the dosage ofpolysaccharide- berberine carrier (ASP-SS-Ber) and HNK was 5.00 mg and 0.71 mg, the hydration temperature was 30 ℃, and the hydration time was 100 min. The compound loaded with HNK micelles prepared by the optimum formulation had the loading capacity of (9.22 ± 0.42)% and entrapment rate of honokiol was (71.77 ± 1.20)%; the average particle size of the micellar preparation was (44.38 ± 2.95) nm and the ζ potential was close to (−10.32 ± 1.26) mV. The cumulative release amount inrelease medium containing glutathione (GSH was 10 mmol/L) reached 80.2% in 72 h; the absorbance for 12 h was maintained at (0.29 ± 0.01)%, the particle size was stabilized at (45.14 ± 0.67)% for seven consecutive days, and the potential was stabilized at (−10.46 ± 0.60) mV.The model established by central composite design-response surface method had high accuracy and could be used to optimize the formulation of ASP-SS-Ber/HNK micelle preparations.
honokiol;polysaccharide; berberine; micelle; film hydration method; central composite design-response surface method
R283.6
A
0253 - 2670(2022)04 - 1021 - 09
10.7501/j.issn.0253-2670.2022.04.008
2021-09-14
齐齐哈尔市科技攻关项目(LHYD-2021001);国家自然科学基金项目(82174097)
王彬彬,硕士研究生。Tel: 18249277702 E-mail: 2076963831@qq.com
韩翠艳,教授,硕士生导师。Tel: (0452)2663822 E-mail: hcymuphar@qmu.edu.cn
[责任编辑 郑礼胜]

