五味子油联合莪术油防治肝纤维化的作用及机制研究
侯晓荣,赵 靖,赵 佳,丁凯欣,刘文龙,肖小河,湛小燕*,柏兆方*
• 药理与临床 •
五味子油联合莪术油防治肝纤维化的作用及机制研究
侯晓荣1, 2,赵 靖1, 3#,赵 佳1, 2,丁凯欣1, 4,刘文龙3,肖小河1, 4,湛小燕1, 4*,柏兆方1, 4*
1. 中国人民解放军总医院第五医学中心 肝病医学部,北京 100039 2. 成都中医药大学药学院,四川 成都 611137 3. 湖南中医药大学药学院,湖南 长沙 410208 4. 中国人民解放军总医院第五医学中心 全军中医药研究所,北京 100039
研究五味子油联合莪术油防治肝纤维化的作用及机制。采用蛋氨酸和胆碱缺乏及铁添加氨基酸饲料喂养小鼠构建非酒精脂肪肝炎伴肝纤维化模型,将112只C57BL/6小鼠分为对照组、模型组、扶正化瘀胶囊(585 mg/kg)组、五味子油单独给药组、莪术油单独给药组以及五味子油联合莪术油给药组;造模成功后,对照组和模型组ig 0.5%羧甲基纤维素钠溶液,各给药组ig相应药物,连续6周;采用酶标仪测定小鼠血清中丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST)活性;采用苏木素-伊红(HE)染色法观察各组小鼠肝组织病理变化;采用ELISA法检测小鼠血清中转化生长因子-β1(transforming growth factor-β1,TGF-β1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和肝组织中羟脯氨酸(hydroxyproline,Hyp)含量;采用qRT-PCR法检测小鼠肝组织中I型胶原()、和的mRNA表达情况。人肝星形LX-2细胞给予药物预处理,再加入TGF-β1因子,采用Western blotting法检测细胞Collagen I和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)蛋白表达情况。体内实验结果显示,与模型组相比,各给药组血清中ALT和AST活性均显著降低(<0.05、0.01、0.001),其中五味子油与莪术油联合给药高剂量组抑制小鼠ALT活性更为显著;肝脏颜色、光泽和质地都有明显改善,肝组织中脂肪空泡化改善、炎性细胞浸润减少;肝组织Hyp和血清TGF-β1、TNF-α含量均显著降低(<0.05、0.01、0.001),其中联合给药高剂量组改善小鼠肝组织Hyp含量更为显著;肝组织、和mRNA表达水平显著降低(<0.05、0.01、0.001)。体外实验结果显示,五味子油与莪术油联合给药组能下调TGF-β1诱导的LX-2细胞Collagen I和α-SMA蛋白表达。五味子油和莪术油均具有抗肝纤维化作用,且五味子油与莪术油联用的抗肝纤维化效应明显强于各药物的单独使用。
五味子油;莪术油;肝纤维化;LX-2细胞;转化生长因子-β/Smad3通路
肝纤维化是由多种原因引起的慢性肝病,包括乙型和丙型肝炎、自身免疫性肝炎、酒精性肝病和非酒精性脂肪性肝炎等[1-2]。肝脏损伤后会发生自我修复,此过程伴随着纤维化的发生。肝纤维化是一个动态过程,其特征是细胞外基质或疤痕的净积累和肝星状细胞的活化,导致慢性肝损伤[3-4]。虽然纤维化可以在消除损伤原因后逆转,但不加控制的慢性损伤会导致肝衰竭、肝硬化、肝癌,已成为一个日益严重的全球性健康问题[5-6]。近年来,逍遥散[7]、芍药苷[8]、人参皂苷[9]等中药在预防和治疗肝纤维化方面取得显著进展[10]。
五味子为木兰科植物五味子(Turcz.) Baill.的干燥成熟果实,习称“北五味子”,其味酸、甘,性温,归肺、心、肾经,有收敛固涩、益气生津、补肾宁心的功效,用于治疗久嗽虚喘、梦遗滑精、遗尿尿频、久泻不止、自汗盗汗、津伤口渴、内热消渴、心悸失眠[11]。五味子油可以经压榨和CO2超临界萃取得到,研究表明木脂素类成分是五味子的主要活性成分,具有保护肝脏、改善认知障碍、抗炎、调节免疫和抗肿瘤等作用[12-15]。莪术的主要活性成分如姜黄素、榄香烯、莪术醇、吉马酮治疗肝脏疾病疗效确切[16],莪术油是从莪术的根、茎中提取的挥发油,具有活血行气、化瘀消癥之功效。已有文献报道莪术油能够减轻血瘀证肝纤维化小鼠的肝纤维化程度[17-18]。肝星状细胞的活化是分泌基质蛋白的肌成纤维细胞的主要细胞来源,是肝纤维化的主要驱动力[2]。而转化生长因子-β(transforming growth factor-β,TGF-β)信号通路被认为是驱动肝星状细胞活化和诱导细胞外基质产生的关键纤维化通路[19-20]。本研究拟探讨五味子油以及联合莪术油能否通过TGF-β信号通路来实现抗肝纤维化的药效作用,并阐明其作用机制,为治疗肝纤维化提供一种有开发前景的天然活性药物组合物。
1 材料
1.1 动物
SPF级雄性C57BL/6小鼠112只,8~10周龄,体质量18~20 g,购自北京斯贝福生物技术有限公司,动物许可证号SCXK(京)2019-0010。小鼠饲养于标准的SPF级房间(室温21~25 ℃,12 h明暗交替照明)内分笼饲养,除禁食实验外,可自由进食饮水,适应性喂养1周后进行后续实验。动物实验均按照中国人民解放军总医院第五医学中心动物伦理委员会批准(批准号IACUC-2019-0013)的指导方针进行。
1.2 细胞
人肝星形LX-2细胞(批号YB-H3614)购自上海钰博生物科技股份有限公司。
1.3 药品与试剂
五味子油(批号20200407)、莪术油(批号190301)购自山东世博金都药业有限公司,符合《中国药典》2020年版标准;对照品五味子醇甲(批号JOT-10156)、五味子醇乙(批号JOT-10155)、五味子酯甲(批号JOT-10158)、五味子酯乙(批号JOT-10157)、五味子甲素(批号JOT-10160)、五味子乙素(批号JOT-10159)、五味子丙素(批号JOT-10307)购自成都普菲德生物技术有限公司,质量分数≥98%;蛋氨酸和胆碱缺乏及铁添加氨基酸饲料(MCD饲料)、对照饲料(MCS饲料)购自戴茨生物科技有限公司;扶正化瘀胶囊(批号201107)购自上海黄海制药有限责任公司;TGF-β1(批号AF-100-21C)购自美国PeproTech公司;DMEM培养基、1%青霉素(100 U/mL)、链霉素(100 μg/mL)购自北京中科迈晨公司;胎牛血清购自以色列BI公司;人源I型胶原(Collagen I)抗体(批号AF6220)购自美国R&D公司;人源α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(批号19245)购自美国CST公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号GTX100118)购自美国GeneTex公司;丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)试剂盒购自南京建成生物工程研究所;羟脯氨酸(hydroxyproline,Hyp)试剂盒购自武汉云克隆;小鼠TGF-β1、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒购自北京达科为生物技术有限公司;、、和引物由北京天一辉远生物公司合成;Trizol购自美国Ambion公司;蟛蜞菊内酯(批号HY-N0551)、SYBR Green qPCR Master Mix(Low Rox)、RT Master Mix for qPCR购自美国MCE公司;RIPA裂解液购自北京索莱宝科技有限公司。
1.4 仪器
Acquity超高效液相色谱仪(UPLC,美国Waters公司);CO2细胞培养箱、−80 ℃超低温冰箱(美国Thermo Fisher Scientific公司);控温离心机(美国Sigma公司);XS-205DU型万分之一天平(瑞士Mettler Toledo公司);Synergy H1多功能酶标仪(美国Bio-Tek公司);DMIL HC型倒置显微镜(德国Leica公司);转印电泳槽(美国Bio-Rad公司)。
2 方法
2.1 五味子油色谱分析
参照文献方法[21]采用UPLC测定五味子油中木脂素成分的含量。色谱条件为:Acquity BE1 C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为乙腈(A)-0.1%磷酸水溶液(B),梯度系统:0~2 min,5%~55% A;2~15 min,55%~67% A;15~20 min,67%~78% A;20~23 min,78%~95% A;23~30 min,95%~5% A;体积流量为0.2 mL/min;柱温为30 ℃;进样量为1 μL;检测波长为220 nm。
2.2 体内实验
2.2.1 动物分组及给药 将适应性喂养后的小鼠分为14组,每组8只,分别为对照组、模型组、扶正化瘀胶囊(585 mg/kg)组及五味子油低、中、高剂量(180、360、720 mg/kg)组及莪术油低、高剂量(4.5、9.0 mg/kg)组及莪术油低剂量(4.5 mg/kg)+五味子油低剂量(180 mg/kg)组、莪术油低剂量(4.5 mg/kg)+五味子油中剂量(360 mg/kg)组、莪术油低剂量(4.5 mg/kg)+五味子油高剂量(720 mg/kg)组、莪术油高剂量(9.0 mg/kg)+五味子油低剂量(180 mg/kg)组、莪术油高剂量(9.0 mg/kg)+五味子油中剂量(360 mg/kg)组和莪术油高剂量(9.0 mg/kg)+五味子油高剂量(720 mg/kg)组。模型组和各给药组小鼠给予MCD饲料(胆碱和蛋氨酸缺乏饲料)造模,对照组小鼠给予MCS对照饲料,造模6周;造模成功后,对照组和模型组ig 0.5%羧甲基纤维素钠溶液,各给药组ig相应药物,1次/d,连续6周。每周称定体质量1次,末次给药后禁食不禁水,24 h后眼球采血,颈椎脱臼法处死小鼠取肝脏,收集血清和肝脏标本,部分肝脏浸泡于10%福尔马林中,部分冻存于−80 ℃冰箱备用。
2.2.2 肝组织病理检测 肝脏组织经中性福尔马林固定后,常规石蜡包埋,切片厚4 μm,苏木素-伊红(HE)染色后,于光学显微镜下观察各组小鼠肝组织病理学改变。
2.2.3 血清ALT、AST活性和TGF-β1、TNF-α水平测定 取小鼠血清,按试剂盒说明书测定血清中ALT、AST活性和TGF-β1、TNF-α水平。
2.2.4 肝组织中Hyp水平测定 取50 mg小鼠肝组织于2 mL的无酶EP管中,加入1 mL的含蛋白酶抑制剂的RIPA试剂,用组织匀浆机制备肝匀浆液。采用BCA法进行蛋白定量后,按照试剂盒说明书测定组织匀浆液中Hyp水平。
2.2.5 肝组织总RNA提取以及qRT-PCR检测 取50 mg小鼠肝组织于2 mL的无酶EP管中,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。、、和引物序列见表1。
表1 引物序列
Table 1 Primer sequences
引物长度/bp序列(5’-3’) Collagen Ⅰ1919F: CTGGCGGTTCAGGTCCAAT R: TTCCAGGCAATCCACGAGC Smad32021F: TCTCCCCGAATCCGATGTCC R: GCTGGTTCAGCTCGTAGTAGG TGF-β12322F: CTTCAATACGTCAGACATTCGGG R: GTAACGCCAGGAATTGTTGCTA β-actin2120F: ATTCGTTGCCGGTCCACACCC R: GCTTTGCACATGCCGGAGCC
2.3 体外实验
2.3.1 细胞培养 LX-2细胞用含10%胎牛血清和100 U/L青霉素/链霉素的DMEM培养基,于37 ℃、5%的CO2培养箱中进行传代培养。
2.3.2 CCK-8试验 取对数生长期的LX-2细胞,以2×105/mL接种于96孔板,每孔100 μL,培养12~18 h后进行分组实验,空白组不接种细胞。分别称取五味子油或者莪术油溶解于二甲基亚砜(dimethyl sulfoxide,DMSO)中,配制质量浓度为50 mg/mL的母液。各组分别加入含等量DMSO的正常培养基(空白、对照)或不同质量浓度(1.25、2.50、5.00、10.00、20.00、40.00、60.00、80.00、100.00 μg/mL)的五味子油或莪术油,培养24 h后,弃去上清,加入CCK-8试剂,培养1 h,采用酶标仪测定450 nm处的吸光度()值,计算细胞存活率。
细胞存活率=(实验-空白)/(对照-空白)
2.3.3 Western blotting法检测细胞Collagen I和α-SMA蛋白表达情况 取对数生长期的LX-2细胞,加入0.05%胰酶,37 ℃消化1 min;将细胞以2.5×105/mL接种于24孔板,培养12~18 h至其贴壁,用无血清的DMEM培养基饥饿处理细胞6 h;采用换液的方式,加入用无血清DMEM培养基配制的不同质量浓度的五味子油(0、10、20、40 μg/mL)、莪术油(0、5、10、20 μg/mL)以及两者联合的药物和蟛蜞菊内酯(12.57 μg/mL),同时在空白孔和对照孔加入含等量DMSO的稀释液,每孔400 μL,药物处理6 h;采用补液的方式,加入TGF-β1刺激因子(用含5%海藻糖的PBS溶液稀释至20 μg/mL),终质量浓度为10 ng/mL,处理24 h;吸去上清后,每孔加入130 μL的RIPA细胞裂解液,迅速晃匀使裂解液充分裂解细胞,15 min后收集裂解液,提取蛋白,并用BCA法测定蛋白浓度,采用Western blotting法测定各组细胞Collagen I和α-SMA蛋白表达情况。
2.4 统计分析
实验数据用Graphpad Prism 6.0进行统计分析,数据以表示,组间比较采用单因素方差分析(One-way ANOVA)。
3 结果
3.1 五味子油色谱分析
经UPLC检测,五味子油中五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、五味子甲素、五味子乙素、五味子丙素质量浓度分别为16.67、4.54、1.16、1.84、3.67、5.33、0.65 mg/mL。
3.2 各组小鼠肝脏形态学以及组织病理学变化
如图1所示,对照组小鼠肝脏表面光滑红润,色泽鲜明,边缘锐利,质地中等,有弹性,HE染色结果显示对照组小鼠肝组织的肝细胞形态正常,结构完整。与对照组比较,模型组小鼠肝脏体积缩小且颜色泛黄,表面粗糙,边缘较钝,质地较硬,弹性差,肝组织中可见肝细胞体积增大,呈圆形,细胞质内有大量圆形空泡,将细胞核挤到一侧,同时有大量炎性细胞浸润。与模型组比较,各给药组小鼠肝脏颜色、光泽和质地都有明显的改善,肝组织中脂肪空泡化明显改善、炎性细胞浸润减少。
3.3 各组小鼠血清中ALT和AST活性
如图2所示,与对照组相比,模型组小鼠血清ALT和AST活性明显升高(<0.001);与模型组相比,除莪术油低剂量组外,各给药组血清ALT活性明显降低(<0.05、0.01、0.001);除莪术油各剂量组外,各给药组血清AST活性明显降低(<0.05、0.01、0.001)。
3.4 各组小鼠肝组织Hyp水平
如图3所示,与对照组相比,模型组肝组织Hyp水平明显升高(<0.001);与模型组相比,五味子油高剂量组、五味子油与莪术油联合给药组小鼠肝组织Hyp水平明显降低(<0.05、0.01、0.001)。
3.5 各组小鼠血清TGF-β1和TNF-α水平
如图4所示,与对照组相比,模型组血清TGF-β1和TNF-α水平明显升高(<0.001);与模型组相比,除莪术油低剂量组外,各给药组小鼠肝组织TGF-β1水平明显降低(<0.01、0.001);除五味子油低剂量组外,各给药组小鼠血清中TNF-α水平均显著降低(<0.05、0.01、0.001)。
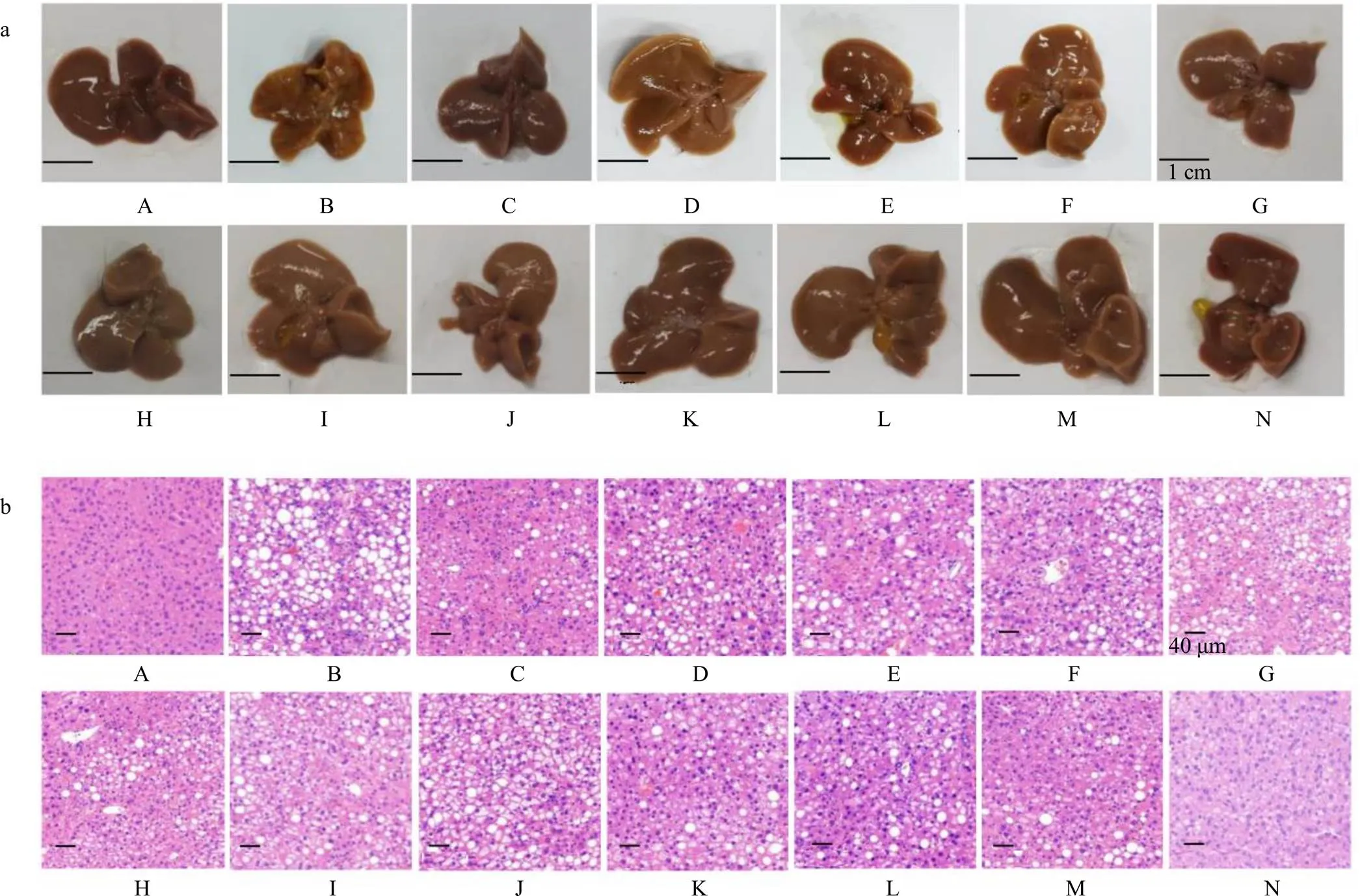
A-对照组 B-模型组 C-扶正化瘀组 D~F-五味子油低、中、高剂量(180、360、720 mg·kg−1)组 G、H-莪术油低、高剂量(4.5、9.0 mg·kg−1)组 I-莪术油低剂量(4.5 mg·kg−1)+五味子油低剂量(180 mg·kg−1)组 J-莪术油低剂量(4.5 mg·kg−1)+五味子油中剂量(360 mg·kg−1)组 K-莪术油低剂量(4.5 mg·kg−1)+五味子油高剂量(720 mg·kg−1)组 L-莪术油高剂量(9.0 mg·kg−1)+五味子油低剂量(180 mg·kg−1)组 M-莪术油高剂量(9.0 mg·kg−1)+五味子油中剂量(360 mg·kg−1)组 N-莪术油高剂量(9.0 mg·kg−1)+五味子油高剂量(720 mg·kg−1)组,图3~6同

与对照组比较:###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下图同

图3 各组小鼠肝组织Hyp水平(, n = 8)
3.6 各组小鼠肝组织Collagen Ⅰ、TGF-β1和Smad3 mRNA表达
如图5所示,与对照组相比,模型组小鼠肝组织、和mRNA表达水平明显升高(<0.001);与模型组相比,各给药组小鼠肝组织和mRNA表达水平明显降低(<0.001);除五味子油低剂量组外,各给药组小鼠肝组织mRNA表达水平明显降低(<0.05、0.01、0.001)。
3.7 五味子油和莪术油对LX-2细胞存活率的影响
如图6所示,与对照组相比,五味子油各剂量组细胞存活率均无显著差异,表明五味子油(≤100μg/mL)对LX-2细胞毒性小;莪术油(≤40 μg/mL)组LX-2细胞存活率无显著差异,莪术油(60.00、80.00、100.00 μg/mL)组LX-2细胞存活率显著下降(<0.001)。结合细胞存活率,本研究各选择3个不同质量浓度的五味子油(10.00、20.00、40.00 μg/mL)和莪术油(5.00、10.00、20.00 μg/mL)进行后续实验。

图4 各组小鼠血清中TGF-β1和TNF-α水平(, n = 8)

图5 各组小鼠肝组织Collagen I、TGF-β1和Smad3mRNA表达情况(, n = 8)

图6 五味子油和莪术油对LX-2细胞存活率的影响(, n = 3)
3.8 五味子油和莪术油对TGF-β1诱导的LX-2细胞Collagen I和α-SMA蛋白表达的影响
如图7所示,与对照组相比,TGF-β1刺激后,LX-2细胞Collagen I、α-SMA蛋白表达增加;五味子油(20、40 μg/mL)能抑制Collagen I和α-SMA蛋白表达;莪术油(10、20 μg/mL)能抑制Collagen I和α-SMA蛋白表达;五味子油(10、20、40 μg/mL)联合莪术油(10、20 μg/mL)能抑制Collagen I和α-SMA蛋白表达;与五味子油(10、20、40 μg/mL)、莪术油(10、20 μg/mL)的单独给药相比,联合给药后对LX-2细胞Collagen I和α-SMA蛋白表达的抑制作用更强。

A-对照组 B-模型组 C-蟛蜞菊内酯组 D~F-五味子油(10、20、40 μg·mL−1)组 G-莪术油(5 μg·mL−1)组 H~J-五味子油(10、20、40 μg·mL−1)+莪术油(5 μg·mL−1)组 K-莪术油(10 μg·mL−1)组 L~N-五味子油(10、20、40 μg·mL−1)+莪术油(10 μg·mL−1)组 O-莪术油(20 μg·mL−1)组 P~R-五味子油(10、20、40 μg·mL−1)+莪术油(20 μg·mL−1)组
4 讨论
肝纤维化是肝组织损伤后修复的进行性疾病,其特征是肝星状细胞活化、炎症反应激活、细胞外基质过度沉积以及纤维疤痕的形成等[22]。TGF-β是一种主要的促纤维化细胞因子,并以Smad2或Smad3依赖的方式驱动肝星状细胞激活[19,23-24]。活化的肝星状细胞迁移到损伤部位并分泌细胞外基质,产生纤维瘢痕[23]。因此,通过靶向TGF-β相关分子或信号通路来抑制肝星状细胞增殖与活化是防治肝纤维化的有效策略[25]。
MCD饮食诱导建立非酒精性脂肪性肝纤维化小鼠模型,已成为国内外建立肝纤维化动物模型的经典方法[26-28]。扶正化瘀胶囊被作为阳性药物广泛应用于抗肝纤维化研究中[29-31]。基于此,本研究采用MCD饮食诱导的肝纤维化模型,进一步探究五味子油联合莪术油的抗肝纤维化作用及机制。药效学结果表明,经五味子油、莪术油、五味子油与莪术油联合给药治疗后,小鼠血清ALT、AST活性和TGF-β1水平以及肝组织Hyp水平不同程度地降低,表明五味子油联合莪术油可抑制肝细胞损伤,具有明显的抗肝纤维化作用,且联合效果优于单药,其中以联合给药高剂量改善肝纤维化效果最佳。
α-SMA是肝星状细胞活化的标志物,Collagen I是肝星状细胞活化后释放的细胞外基质的主要成分,是纤维的重要来源。本研究进一步通过qRT-PCR法探究五味子油联合莪术油对小鼠肝组织中、和mRNA表达的影响,并通过Western blotting法探究其对LX-2细胞活化后Collagen I和α-SMA蛋白表达的影响,结果显示,给药后小鼠肝组织中、和mRNA表达均显著降低,LX-2细胞Collagen I和α-SMA蛋白表达也降低,提示五味子油联合莪术油可通过下调TGF-β1、Smad3蛋白表达,调节胶原蛋白的合成与沉积,抑制肝星状细胞的活化,从而实现抗肝纤维化的作用。
肝细胞损伤后会释放大量炎症介质,TNF-α是常见的炎症因子,与非酒精性脂肪性肝纤维化小鼠疾病严重程度相关。本研究表明,给药后小鼠血清中TNF-α水平显著降低,表明五味子油联合莪术油能够抑制炎症因子的释放来改善肝纤维化。
综上所述,五味子油联合莪术油对MCD饮食诱导的小鼠肝纤维化具有一定的改善作用,能减轻肝损伤、肝纤维化程度及炎症反应,其机制为通过抑制TGF-β1/Smad信号通路,抑制肝星状细胞活化,下调α-SMA表达,减轻胶原合成与沉积。本研究明确了五味子油与莪术油作为一种联合用药物组合物通过抑制TGF-β1肝纤维化信号通路来发挥显著的抗肝纤维化作用,为肝纤维化疾病预防和治疗提供一种有开发前景的天然活性药物组合物,也为组分中药五味子油与莪术油的开发和利用提供新的科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Bataller R, Brenner D A. Liver fibrosis [J]., 2005, 115(2): 209-218.
[2] Higashi T, Friedman S L, Hoshida Y. Hepatic stellate cells as key target in liver fibrosis [J]., 2017, 121: 27-42.
[3] Roderfeld M. Matrix metalloproteinase functions in hepatic injury and fibrosis [J]., 2018, 68/69: 452-462.
[4] Parola M, Pinzani M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues [J]., 2019, 65: 37-55.
[5] Kong Z Y, Liu R, Cheng Y R. Artesunate alleviates liver fibrosis by regulating ferroptosis signaling pathway [J]., 2019, 109: 2043-2053.
[6] Chang J L, Lan T, Li C Z,. Activation of Slit2-Robo1 signaling promotes liver fibrosis [J]., 2015, 63(6): 1413-1420.
[7] Zhou Y, Wu R, Cai F F,. Xiaoyaosan Decoction alleviated rat liver fibrosis via the TGFβ/Smad and Akt/FoxO3 signaling pathways based on network pharmacology analysis [J]., 2021, 264: 113021.
[8] Li X Y, Shen J L, Zhong Z R,. Paeoniflorin: A monomer from traditional Chinese medical herb amelioratesegg-induced hepatic fibrosis in mice [J]., 2009, 95(6): 1520-1524.
[9] Li X B, Mo N, Li Z Z. Ginsenosides: Potential therapeutic source for fibrosis-associated human diseases [J]., 2020, 44(3): 386-398.
[10] Zhang L J, Schuppan D. Traditional Chinese medicine (TCM) for fibrotic liver disease: Hope and hype [J]., 2014, 61(1): 166-168.
[11] 中国药典 [S]. 一部. 2020: 68.
[12] Zhou Y, Men L H, Sun Y X,. Pharmacodynamic effects and molecular mechanisms of lignans fromTurcz. (Baill.), a current review [J]., 2021, 892: 173796.
[13] Szopa A, Ekiert R, Ekiert H. Current knowledge of(Turcz.) Baill. (Chinesevine) as a medicinal plant species: A review on the bioactive components, pharmacological properties, analytical and biotechnological studies [J]., 2017, 16(2): 195-218.
[14] Nowak A, Zakłos-Szyda M, Błasiak J,. Potential of(Turcz.) Baill. in human health and nutrition: A review of current knowledge and therapeutic perspectives [J]., 2019, 11(2): 333.
[15] 王锐, 李娅兰, 李建月, 等. 共载HBx-siRNA与五味子油阳离子脂质体纳米粒的制备及其对乙型肝炎体外药效学研究[J]. 中草药, 2021, 52(15): 4519-4527.
[16] 赵铁建, 傅品悦, 刘露露, 等. 中药莪术几种活性成分对肝脏疾病防治作用的机制 [J]. 世界华人消化杂志, 2017, 25(27): 2433-2440.
[17] 刘露露, 吕贝贝, 彭岳, 等. 莪术油对血瘀证肝纤维化小鼠TGF-β1、Smad 2、Smad 3表达的影响 [J]. 时珍国医国药, 2019, 30(6): 1284-1287.
[18] 刘露露. 广西莪术油对血瘀证肝纤维化小鼠TGF-β1/Smads信号通路的影响 [D]. 南宁: 广西中医药大学, 2019.
[19] Dewidar B, Meyer C, Dooley S,. TGF-β in hepatic stellate cell activation and liver fibrogenesis-updated 2019 [J]., 2019, 8(11): 1419.
[20] Fagone P, Mangano K, Pesce A,. Emerging therapeutic targets for the treatment of hepatic fibrosis [J]., 2016, 21(2): 369-375.
[21] 翟欣然, 曲佳萌, 许华容, 等. UHPLC-DAD法同时测定五味子标准汤剂中4种木脂素类成分的含量 [J]. 沈阳药科大学学报, 2019, 36(10): 882-886.
[22] Kisseleva T, Brenner D. Molecular and cellular mechanisms of liver fibrosis and its regression [J]., 2021, 18(3): 151-166.
[23] Tsuchida T, Friedman S L. Mechanisms of hepatic stellate cell activation [J]., 2017, 14(7): 397-411.
[24] Xu F Y, Liu C W, Zhou D D,. TGF-β/SMAD pathway and its regulation in hepatic fibrosis [J]., 2016, 64(3): 157-167.
[25] 阎仕豪, 苗蕙, 黄镇林, 等. 金银花-连翘提取物组合对CCl4诱导小鼠肝纤维化的改善作用研究 [J]. 上海中医药大学学报, 2021, 35(2): 50-56.
[26] 覃碧艳, 刁娜, 白岚. 甲状旁腺激素相关蛋白加重蛋氨酸胆碱缺乏饲料诱导的小鼠非酒精性脂肪性肝病进展 [J]. 南方医科大学学报, 2021, 41(7): 1037-1043.
[27] Xiong F, Zheng Z, Xiao L Y,. Soyasaponin A2 alleviates steatohepatitis possibly through regulating bile acids and gut microbiota in the methionine and choline-deficient (MCD) diet-induced nonalcoholic steatohepatitis (NASH) mice [J]., 2021, 65(14): e2100067.
[28] Wang X J, de Carvalho Ribeiro M, Iracheta-Vellve A,. Macrophage-specific hypoxia-inducible factor-1α contributes to impaired autophagic flux in nonalcoholic steatohepatitis [J]., 2019, 69(2): 545-563.
[29] 肖准, 付亚东, 胡永红, 等. 扶正化瘀方抗肝纤维化主要成分的配伍研究 [J]. 世界科学技术—中医药现代化, 2021, 23(5): 1567-1578.
[30] 胡会芬, 刘雯, 谭林. 富马酸替诺福韦联合扶正化瘀治疗对乙肝肝硬化患者肝纤维化程度及免疫状态的影响 [J]. 河北医学, 2021, 27(4): 686-692.
[31] 林扬, 林翠英, 王艳娇, 等. 扶正化瘀胶囊联合恩替卡韦分散片治疗慢性乙型肝炎肝纤维化临床研究 [J]. 新中医, 2021, 53(6): 51-54.
Effect and mechanism ofoil combined with Zedoary Turmeric oil on liver fibrosis
HOU Xiao-rong1, 2, ZHAO Jing1, 3, ZHAO Jia1, 2, DING Kai-xin1, 4, LIU Wen-long3, XIAO Xiao-he1, 4, ZHAN Xiao-yan1, 4, BAI Zhao-fang1, 4
1. Department of Hepatology, The Fifth Medical Center of Chinese PLA General Hospital, Beijing 100039, China 2. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 3. School of Pharmacy, Hunan University of Traditional Chinese Medicine, Changsha 410208, China 4. China Military Institute of Chinese Materia, The Fifth Medical Centre of Chinese PLA General Hospital, Beijing 100039, China
To explore the effect and mechanism ofoil combined with Zedoary Turmeric oil on prevention and treatment of liver fibrosis.A mice model of nonalcoholic steatohepatitis (NASH) with liver fibrosis was constructed by methionine and choline deficiency and iron-supplemented amino acid diet. Totally 112 C57BL/6 mice were randomly divided into control group, model group, Fuzheng Huayu Capsules (585 mg/kg) group,oil group, Zedoary Turmeric oil group andoil combined with Zedoary Turmeric oil group. After successful modeling, mice in control and model group were ig 0.5% CMCNa, and other groups were ig corresponding drug for six weeks. The activities of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in serum were analyzed by microplate analyzer. The pathological changes of liver tissue were observed by HE staining. The contents of transforming growth factor-β1 (TGF-β1), tumor necrosis factor-α (TNF-α) in serum and hydroxyproline (Hyp) in liver tissue were determined by ELISA. The mRNA expressions of,andin liver tissue were determined by qRT-PCR. LX-2 cells were pretreated with drugs, and then TGF-β1 factor was added, protein expressions of Collagen I and α-smooth muscle actin (α-SMA) were detected by Western blotting.The results ofexperiments showed that compared with model group, ALT and AST activities in serum of mice in each administration group were significantly reduced (< 0.05, 0.01, 0.001), in which high-doseoil combined with Zedoary Turmeric oil group decreased ALT activity more significantly. The liver color, luster, texture and fat vacuolization of liver tissue in each treatment group were significantly improved, accompanied with the reduction of inflammatory cell infiltration. The contents of Hyp in liver tissue and TGF-β1, TNF-α in serum in each administration groups were decreased (< 0.05, 0.01, 0.001), among which the combination of high dose group improved Hyp content in liver tissues of mice more significantly. The mRNA expressions of,andin liver tissue were significantly down-regulated in different drug groups (< 0.05, 0.01, 0.001). The results ofexperiments showed thatoil combined with Zedoary Turmeric oil group could reduce the protein expressions of Collagen I and α-SMA in TGF-β1 induced LX-2 cells.Bothoil and Zedoary Turmeric oil have anti-hepatic fibrosis effect, and the anti-hepatic fibrosis effect ofoil combined with Zedoary Turmeric oil is significantly stronger than that of each drug alone.
oil; Zedoary Turmeric oil; liver fibrosis; LX-2 cells; transforming growth factor-β/Smad3 pathway
R285.5
A
0253 - 2670(2022)04 - 1059 - 09
10.7501/j.issn.0253-2670.2022.04.012
2021-10-27
国家“重大新药创制”科技重大专项(2017ZX09301022);国家自然科学基金重点项目(81930110)
侯晓荣,硕士研究生,研究方向为中药药理与毒理学。E-mail: houzhongyao184@163.com
柏兆方,副研究员,硕士生导师,从事中药药理与毒理研究。E-mail: baizf2008@hotmail.com
湛小燕,博士,助理研究员,从事细胞生物学研究。E-mail: xyzhan123@163.com
#共同第一作者:赵 靖,硕士研究生,研究方向为中药质量控制。E-mail: misteryman@163.com
[责任编辑 李亚楠]

