肠炎沙门氏菌SEF14 菌毛的表达及其对该菌的特异性检测研究
侯千禧,顾宣强,刘家奇,李雅倩,夏芃芃,段强德,朱国强
(扬州大学兽医学院江苏省重要动物传染病与人兽共患病协同创新中心,江苏 扬州 225009)
沙门氏菌有2 600 多种血清型,其中肠炎沙门氏菌在人和多种动物中具有广泛的宿主适应性,是导致人类食物中毒的主要病原菌之一[1]。禽产品是肠炎沙门氏菌的主要感染源,肠炎沙门氏菌引起人类食物中毒的同时也对畜禽养殖业产生了重大影响[2]。
SEF14 菌毛是肠炎沙门氏菌感染过程重要的毒力因子,是一种伴侣-推进(Chaperone-usher)菌毛,沙门氏菌sef14 操纵子位于一个较小的毒力岛上,完整的sef14操纵子基因由5 个基因组成,分别为sefA、sefB、sefC、sefD和sefR。其中,sefA编码SEF14菌毛的主要亚单位蛋白SefA,该基因已被克隆、测序,仅分布于部分血清D 群沙门氏菌中[3]。sefB编码伴侣蛋白,是一种转运蛋白,作用为避免SefA 主要亚单位蛋白的非活性聚集及其在组装前的酶降解。sefC编码推进蛋白,该蛋白位于外膜中,负责组织、装配菌毛亚单位并使其穿过外膜蛋白,以活性蛋白形式表达于细菌的表面。sefD编码SEF14 菌毛的顶端结构,为一种假定黏附素。sefR是一种反向调节基因,与sefD相连,其编码的AraC 样调节蛋白能够激活sef操纵子基因的转录[4-5]。
基于上述对SEF14 菌毛的探索,本研构建了重组菌pBR322-sef14/SE5000M,通过凝集试验、SDSPAGE、western blot 和透射电镜及免疫电镜检测,证明SEF14 菌毛在修饰的大肠杆菌SE5000M 中得到了表达。在凝集试验中,其可与肠炎沙门氏菌阳性鸡血清特异性结合,并能够在2 min 内用肉眼观察到清晰的凝集颗粒,证明了该重组菌能够用于肠炎沙门氏菌检测方法研究。上述研究结果为进一步探究SEF14 菌毛和建立特异性诊断技术提供了参考依据。
1 材料与方法
1.1 主要实验材料经过修饰的大肠杆菌SE5000M菌株由美国宾夕法尼亚大学兽医学院Dieter Schifferli博士惠赠,由本实验室保存;肠炎沙门氏菌标准株SE50336 购自中国兽医药品监察所;表达质粒pBR322 和限制性内切酶购自NEB 公司;SefA(SEF14菌毛的主要亚基)单克隆抗体(MAb)由本实验室制备;重组SefA 蛋白(包含6×His 标签)由本实验室制备;Phanta Max Super-Fidelity DNA 聚合酶购自南京诺唯赞生物科技股份有限公司;NC 膜购自中国夏普有限公司;辣根过氧化物酶标记的羊抗小鼠IgG(IgG-HRP)购自德国Novus 公司;胶体金标记的羊抗小鼠IgG 购自Sigma 公司;通用型DNA 纯化试剂盒购自天根生化科技(北京)有限公司;肠炎沙门氏菌、鸡白痢、鸡伤寒、鼠伤寒沙门氏菌阳性鸡血清由本实验室通过标准株按常规程序免疫SPF 鸡3 次后获取;O1 型、O2 型和O78 型大肠杆菌阳性SPF 鸡血清由扬州大学兽医学院高崧教授提供。
1.2 重组表达载体的构建与鉴定参照肠炎沙门氏菌标准株SE50336 基因序列,利用Oligo7 软件设计sef14操纵子基因扩增引物(表1),下划线标记分别代表SphI和SalI酶切位点。引物由南京擎科生物科技有限公司合成。利用上述引物,以提取的肠炎沙门氏菌标准株SE50336 DNA为模板,PCR扩增sef14操纵子基因,PCR产物经SphI和SalI酶切后,克隆于经同样酶切处理的pBR322载体中,经XbaI和SalI限制性内切酶酶切及测序鉴定,构建重组质粒pBR-sef14。

表1 sef14操纵子基因的PCR扩增引物Table 1 The primers used for PCR amplification of sef14
1.3 重组菌的凝集反应鉴定将pBR-sef14和空载体pBR322 分别电转化至经修饰且不含任何菌毛的大肠杆菌SE5000M,经氨苄青霉素抗性平板筛选,阳性重组菌分别命名为pBR-sef14/SE5000M 和pBR322/SE5000M。将重组菌接种于LB 肉汤培养基中37 ℃培养16 h,菌量调整为5×109cfu/mL,用无菌生理盐水洗涤3 次。取10 μL 菌液和等量SefA(SEF14 菌毛的主要亚基)MAb(1∶40),分别滴于干净的玻璃板上,使其混合,慢慢摇晃,在2 min 之内,肉眼观察有无凝集颗粒。
1.4 重组菌的透射电镜及免疫电镜观察将pBRsef14/SE5000M 和pBR322/SE5000M 接种于LB 肉汤培养基中37 ℃培养16 h后,取1 mL培养物,4 000 r/min离心10 min,弃上清,用等量PBS 洗涤3 次后重悬。取50 μL 菌液滴于蜡纸上,将含支持膜的铜网漂浮于液滴的表面,室温静置15 min;用滤纸吸尽铜网上多余的菌液,将铜网漂浮于2%磷钨酸染液液滴的表面(pH7.0);用滤纸吸尽铜网上多余的染液,倒扣于滤纸上,待干后对上述样品进行透射电镜观察[6]。
用上述同样的方法处理菌液,将含支持膜的铜网漂浮于菌液液滴的表面,室温静置15 min;吸尽铜网上残余菌液,用1%脱脂乳室温封闭10 min;吸尽残余液体后,先用SefA MAb(1∶1 000)室温孵育30 min,PBST 洗涤3 次,再用胶体金标记的羊抗小鼠IgG(1∶50)室温孵育60 min,PBST 洗涤3 次;吸尽残余液体,用2%磷钨酸负染3 min,待干后经免疫电镜观察[7]。
1.5 菌毛蛋白的提取将pBR-sef14/SE5000M 接种于LB 肉汤培养基中37 ℃培养12 h,采用改进的热萃取法提取SEF14 菌毛蛋白[8],其步骤为:菌液培养物在4 ℃,4 500 r/min 离心10 min,弃去上清,用无菌PBS 洗涤两次。加入75 mmol/L NaCl-0.5 mmol/L Tris-HCl(pH7.4)溶液,62 ℃水浴30 min,8 000 r/min离心20 min,转移上清液到新的离心管中,加入20%饱和硫酸铵沉淀过夜,14 000 r/min,离心30 min,弃去上清后,用无菌PBS 垂悬后备用。
1.6 菌毛蛋白的SDS-PAGE 及western blot 鉴定将1.5 所得SEF14 菌毛蛋白和重组SefA 蛋白(包含6×His 标签)经SDS-PAGE 后,利用Bio-RAD 转印系统将凝胶中的蛋白条带转移到NC 膜上,4 ℃,10%牛血清白蛋白封闭过夜。次日用PBST 洗涤3 次后,加入SefA MAb(1∶1 000)。37 ℃孵育1 h 后,用PBST洗涤3 次,加入羊抗小鼠IgG-HRP(1∶1 500),37 ℃孵育2 h,洗涤3 次,二氨基联苯胺染色,利用western blot 鉴定SEF14 菌毛蛋白[9]。
1.7 重组菌特异性靶向检测肠炎沙门氏菌依据1.3 所述方法制备pBR-sef14/SE5000M 作为凝集抗原,同时以pBR322/SE5000M 为阴性对照,检测重组菌pBR-sef14/SE5000M 与SPF 鸡阴性血清、肠炎沙门氏菌、鸡白痢沙门氏菌、鸡伤寒沙门氏菌、鼠伤寒沙门氏菌、O1 型、O2 型和O78 型大肠杆菌阳性SPF鸡血清(各10 份,共计80 份)的凝集反应性,从而检验重组菌pBR-sef14/SE5000M 对肠炎沙门氏菌的特异性靶向检测功能。
2 结果与讨论
2.1 重组质粒pBR-sef14的构建与鉴定以肠炎沙门氏菌标准株SE50336 为模板,SEF-UP/SEF-DO 为引物PCR 扩增sef14操纵子基因, PCR 产物经1%琼脂糖凝胶电泳检测。结果显示,在约4 300 bp 处出现目的条带,与预期大小一致(图1A)。将sef14克隆至pBR322 表达质粒中,对构建的重组质粒分别用XbaI 和SalI 酶切鉴定,结果显示目的片段大小约为8 200 bp,酶切结果与预期大小一致(图1B),表明正确构建了pBR-sef14重组质粒。

图1 sef14操纵子基因PCR扩增(A)及pBR322-sef14的酶切鉴定结果(B)Fig.1 The result of sef14 operon gene PCR amplification and restriction digestion of pBR-sef14 plasmid
2.2 重组菌与SefA MAb 凝集反应结果将重组菌pBR-sef14/SE5000M 和pBR322/SE5000M 分别与SefA MAb 混合,结果显示,重组菌pBR-sef14/SE5000M 能与SefA MAb 产生凝集反应,而pBR322/SE5000M 不与SefA MAb 发生反应。表明重组菌pBR-sef14/SE5000M能够表达SEF14 菌毛蛋白。
2.3 重组菌的透射电镜及免疫电镜观察结果在透射电镜及免疫电镜下观察重组菌pBR-sef14/SE5000M和pBR322/SE5000M,透射电镜结果显示,pBRsef14/SE5000M 表面有明显的菌毛结构,而阴性对照pBR322/SE5000M 表面无菌毛结构(图2)。在电镜观察的基础上,用SefA MAb 和胶体金标记的羊抗小鼠IgG 分别孵育后进行免疫电镜观察,结果显示,经过上述抗体孵育处理后,在pBR-sef14/SE5000M 的菌毛表面吸附有黑色胶体金颗粒,阴性对照pBR322/SE5000M 未观察到上述现象(图2),由此可初步断定表达的菌毛为SEF14 菌毛,表明重组菌pBR-sef14/SE5000M 能够表达SEF14 菌毛。

图2 重组菌pBR322-sef14/SE5000M和pBR322/SE5000M的透射电镜图(50 000×)及免疫电镜图(73 000×)Fig.2 Transmission electron microscope image(50 000×)and immunoelectron micrograph(73 000×)of pBR322-sef14/SE5000M and pBR322/SE5000M
2.4 菌毛蛋白的SDS-PAGE 和western blot 分析将菌毛蛋白经SDS-PAGE 和western blot 鉴定,结果显示,pBR-sef14/SE5000M 的表达产物大小约为14.3 ku(图3A),与菌毛的主要亚基SefA 的大小一致。本研究还使用了带有6×His 标签的重组SefA 作为对照,其大小约为15.2 ku(6×His 标签的大小约为0.9 ku)(图3B),表明重组菌能够表达SEF14 菌毛。SEF14 菌毛仅存在于D 群沙门氏菌中,Thorns 等首先在肠炎沙门氏菌和都柏林沙门氏菌分离株中检测到了SEF14 菌毛的表达[10],并报道了SEF14 菌毛仅表达于D 群沙门氏菌血清型中的肠炎沙门氏菌、都柏林沙门氏菌、非常罕见的布利丹沙门氏菌和莫斯科沙门氏菌[11]。Turcotte 等证实了类似的结论,他们发现sefA基因在鸡伤寒沙门氏菌和鸡白痢沙门氏菌中是保守的,但鸡伤寒沙门氏菌和鸡白痢沙门氏菌不表达SEF14 菌毛的具体原因尚不清楚[12]。
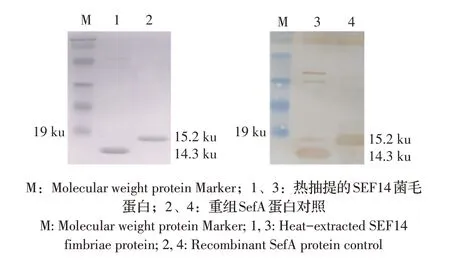
图3 SEF14菌毛蛋白的SDS-PAGE(A)和western blot(B)分析Fig.3 SDS-PAGE(A)and western blot(B)identification of SEF14 fimbriae protein
2.5 重组菌特异性靶向检测肠炎沙门氏菌利用pBR-sef14/SE5000M 和pBR322/SE5000M 对10 份阴性鸡血清和70 份不同病原菌人工感染的鸡血清进行了检测,结果显示,pBR-sef14/SE5000M 能够与10 份肠炎沙门氏菌阳性鸡血清发生凝集反应,与阴性鸡血清、鸡伤寒沙门氏菌、鸡白痢沙门氏菌、鼠伤寒沙门氏菌和大肠杆菌阳性鸡血清均不反应,敏感性为100%,特异性为100%,而对照重组菌pBR322/SE5000M 与所有血清均不反应,表明重组菌pBRsef14/SE5000M 可以用于特异性检测肠炎沙门氏菌感染。考虑到在D 群沙门氏菌中只有肠炎沙门氏菌能够表达SEF14 菌毛,因此可以采用血清学方法,利用SEF14 菌毛特异性检测家禽中的肠炎沙门氏菌感染,例如,利用SefA(分子量为14.3 ku)MAb 包被乳胶颗粒用于鉴别肠炎沙门氏菌[13]。Rajashekara 等改进了乳胶颗粒凝集试验方法,用SefA 重组蛋白代替MAb 包被的乳胶颗粒,但他们并没有检测肠炎沙门氏菌感染样品,也没有报道该方法的灵敏度[14]。
本研究克隆了肠炎沙门氏菌的sef14操纵子基因,并证明其能在SE5000M中良好表达,初步构建了肠炎沙门氏菌pBR-sef14/SE5000M-pBR322/SE5000M 检测系统,凝集试验显示,pBR-sef14/SE5000M可以与肠炎沙门氏菌阳性鸡血清特异性结合,能够在2 min内用肉眼观察到清晰的凝集颗粒,而pBR322/SE5000M 不能特异性识别肠炎沙门氏菌阳性鸡血清。本研究为进一步研究SEF14菌毛、建立肠炎沙门氏菌特异性检测方法和技术平台提供了实验依据。

