下调微小RNA-425-5p靶向第10号染色体同源缺失性磷酸酶-张力蛋白调控宫颈癌细胞侵袭和迁移的分子机制
李敏,赵妍丽,杜国波
作者单位:川北医学院附属医院肿瘤科,四川 南充637000
宫颈癌作为一种常见的恶性肿瘤,其分子发生机制十分复杂,宫颈癌发生与肿瘤组织中异常表达的基因有关[1]。研究报道表明,肿瘤中异常表达的基因可以通过影响肿瘤细胞生长、转移等生物学行为参与肿瘤进展,靶向基因治疗肿瘤是目前研究的重点[2]。微小RNA(miRNA/miR)是由19~24 个核苷酸组成的小分子RNA,miRNA 的产生需要经过细胞核内、细胞质等加工程序,并且每个miRNA 可能有成千上百个作用位点,在不同组织的不同生理进程中参与调控下游蛋白表达[3]。miRNA在物种间的表达具有时序性、保守型性以及组织特异性,参与细胞生长、病变等过程[4]。miRNA 与肿瘤的发生和转移有关,其参与调控肿瘤细胞恶性表型转化[5]。研究报道显示,miR-425-5p 在肾癌、胃癌等组织和细胞中表达上调,下调其表达可以抑制肿瘤细胞的侵袭和迁移[6-7]。目前已知miR-425-5p 在宫颈癌中表达上调,其高表达与宫颈癌病人肿瘤高分期以及淋巴结转移呈正相关,并且高表达miR-425-5p 的病人生存率较低,下调miR-425-5p 表达可以诱导宫颈癌细胞凋亡[8-9]。现阶段对于下调miR-425-5p 对宫颈癌细胞侵袭和迁移的影响还不明确。
2018 年12 月至2019 年11 月,本研究以宫颈癌Caski细胞为研究对象,通过转染miR-425-5p抑制剂(inhibitor)下调miR-425-5p 表达水平,探讨下调miR-425-5p对宫颈癌细胞侵袭和迁移的影响。
1 材料与方法
1.1 材料第10号染色体同源缺失性磷酸酶-张力蛋白(PTEN)抗体、神经钙黏素(N-cadherin)抗体购自北京百奥莱博科技有限公司;宫颈癌Caski 细胞购自上海沪震生物科技有限公司;上皮钙黏素(Ecadherin)抗体购自美国Proteintech Group;miR-425-5p inhibitor 和抑制剂对照(inhibitor control)由杭州泰禾生物技术有限公司构建合成;Lipofectamine 2000 购自美国Invitrogen;siRNA control、PTEN siR‑NA购自吉满生物科技(上海)有限公司。
1.2 细胞转染宫颈癌Caski细胞中分别转染miR-425-5p inhibitor 和inhibitor control,转染具体步骤参照Lipofectamine 2000 转染试剂具体操作说明书。设置没转染的Caski 细胞为Control 组,依次把转染miR-425-5p inhibitor、inhibitor control 以后的宫颈癌Caski细胞设置为Anti-miR-425-5p和Anti-NC组。
1.3 实时荧光定量逆转录聚合酶链反应(qRTPCR)测定miR-425-5p inhibitor 对细胞中miR-425-5p 表达影响收集转染24 h 以后的Control、Anti-NC、Anti-miR-425-5p 组细胞,添加Trizol 试剂,分别将各组细胞中的总RNA 提取并保存在−20 ℃。RNA 浓度测定用紫外分光光度计检测。取1 µg 的RNA,分别添加以下试剂,配制逆转录体系,添加试剂包括:1µL 的逆转录酶、1µL 的5×Buffer、1µL 的2.5 U/µL的多腺苷酸聚合酶,添加双蒸水至25µL,瞬时离心,按照37 ℃孵育60 min,85 ℃孵育5 min 的逆转录程序合成互补DNA(cDNA)。以cDNA 为模板,进行qRT-PCR 检测,配制反应体系如下:2µL 的miRNA qPCR Primer、10 µL 的2×All-in-one qPCR Mix、2 µL 的Vniversal Adaptor PCR、2 µL 的cDNA,添加双蒸水至20 µL,PCR 反应程序为:95 ℃,10 min;95 ℃,10 s;60 ℃,20 s;72 ℃,15 s。按照公式2−ΔΔCt计算miR-425-5p相对表达水平。
引物序列:miR-425-5p 正向5’-GGGGAGTTAG‑GATTAGGTC-3’,反向5’-TGCGTGTCGTGGAGTC-3’。
1.4 MTT 法测定miR-425-5p inhibitor 对细胞增殖影响按照Control、Anti-NC、Anti-miR-425-5p 组分组方法将宫颈癌Caski 细胞分别种植在96 孔板内,每孔中吸取100µL 细胞培养液(约含有5 000个细胞),放在37 ℃,饱和湿度,5%二氧化碳培养箱中培养24 h。取出培养板,用移液枪分别在每个孔内添加15µL 的MTT,将培养板继续放置在37 ℃环境下孵育4 h。吸弃上清溶液,添加二甲基亚砜(Di‑methyl sulphoxide,DMSO)各150 µL,观察结晶物完全溶解以后,调整酶标仪波长为470 nm,检测每个孔的吸光度,以此表示细胞增殖能力。
1.5 Transwell 小室方法分别检测miR-425-5p in⁃hibitor 对侵袭和迁移能力的影响Control、Anti-NC、Anti-miR-425-5p组细胞分别悬浮在无血清的培养液中(细胞密度为2×103个/毫升),吸取200µL 分别添加到Transwell 小室的上室中,加含血清细胞培养液500µL到下室,24 h后,擦掉多余的细胞,固定(4%多聚甲醛),染色(0.1%结晶紫)。分别计数各组细胞迁移数目。侵袭实验前需用基质胶将小室湿化。
1.6 蛋白质印迹法(Western blotting)分别测定Ncadherin、E-cadherin 蛋白表达Control、Anti-NC、Anti-miR-425-5p 组细胞培养24 h 以后常规方法提取细胞中的总蛋白。蛋白浓度定量用BCA 法,步骤完全按照试剂盒说明进行。灌制10%分离胶和5%的浓缩胶,在电泳槽中添加电泳缓冲液,每孔50µg样品,80 V 电泳30 min,120 V 电泳1.5 h。根据目的蛋白的数量和大小,将硝酸纤维素膜(NC 膜)裁剪,浸泡至甲醇中。转膜电流为200 mA,转膜装置放在冰上进行,转膜持续50 min。NC 膜放在新配置的5%脱脂奶粉中孵育2 h;NC膜与一抗、二抗孵育,用化学发光试剂ECL 显色。N-cadherin、E-cadherin一抗以1∶800 稀释,二抗以1∶2 000 稀释。利用Im‑age J 分析各组目的和内参甘油醛-3-磷酸脱氢酶(GAPDH)灰度值,比较目的蛋白的表达差异。
1.7 靶基因预测以及鉴定Targetscan 生物信息学软件预测miR-425-5p 靶基因,结果发现PTEN 和miR-425-5p 可能互为靶向关系。把突变型载体MUT[PTEN 3′非翻译区(UTR)端互补序列突变]、野生型载体WT(PTEN 3′UTR 端互补序列无突变),分别与miR-425-5p inhibitor、inhibitor control 共转染至宫颈癌Caski 细胞内,用荧光素酶活性检测试剂盒检测24 h 各组细胞中荧光素酶活性的变化。MUT 和WT 分别由南京科佰生物科技有限公司构建。
1.8 PTEN siRNA 影响下调miR-425-5p 的细胞增殖、侵袭和迁移检测用Lipofectamine 2000 分别将siRNA control、miR-425-5p inhibitor 和PTEN siRNA、miR-425-5p inhibitor 共转染到宫颈癌Caski 细胞中,分别命名为Anti-miR-425-5p+si-NC 和Anti-miR-425-5p+si-PTEN 组。MTT 法测定细胞增殖,Tran‑swell 小室测定细胞侵袭和迁移,蛋白质印迹法测定N-cadherin、E-cadherin、PTEN蛋白表达,步骤同上。
1.9 统计学方法利用SPSS 21.0 软件分析数据,计量资料满足正态分布,按照±s表示,两组之间的比较采用成组t检验,多组之间的比较采用单因素方差分析+LSD 法,P<0.05 表示差异有统计学意义。
2 结果
2.1 miR-425-5p inhibitor 对宫颈癌细胞增殖、侵袭和迁移能力的影响在宫颈癌细胞中转染miR-425-5p inhibitor,细胞中miR-425-5p 表达水平下降,吸光度降低,侵袭数目以及迁移数目减少,N-cad‑herin 蛋白表达减少,E-cadherin 蛋白表达增多(均P<0.05)。miR-425-5p inhibitor降低宫颈癌细胞增殖、侵袭、迁移和上皮间充质转化(EMT)水平。见图1,2;表1。
表1 miR-425-5p inhibitor转染前后宫颈癌细胞中miR-425-5p水平、吸光度、侵袭数目、迁移数目以及N-cadherin、E-cadherin蛋白水平比较/± s

表1 miR-425-5p inhibitor转染前后宫颈癌细胞中miR-425-5p水平、吸光度、侵袭数目、迁移数目以及N-cadherin、E-cadherin蛋白水平比较/± s
注:N-cadherin为神经钙黏素,E-cadherin为上皮钙黏素。①与Anti-NC组比,P<0.05。
组别Control Anti-NC Anti-miR-425-5p F值P值E-cadherin 0.28±0.03 0.29±0.05 0.65±0.07①144.47<0.001重复次数999 miR-425-5p 1.00±0.09 0.96±0.15 0.32±0.04①122.10<0.001吸光度0.45±0.06 0.47±0.05 0.23±0.04①62.18<0.001侵袭数目96.25±9.51 95.32±7.86 63.17±5.22①53.38<0.001迁移数目138.47±12.14 140.88±13.94 89.64±9.57①52.09<0.001 N-cadherin 0.60±0.05 0.59±0.04 0.30±0.04①137.48<0.001
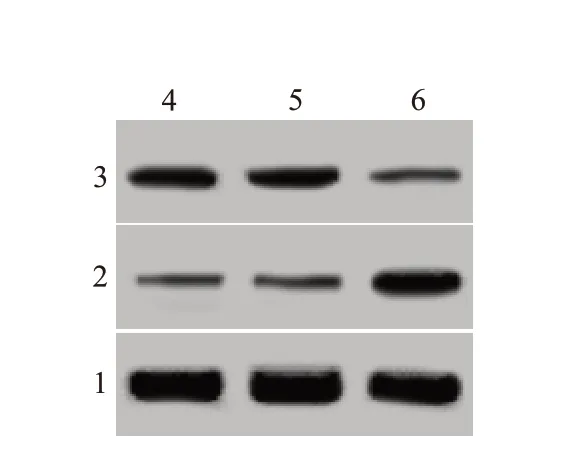
图2 蛋白质印迹法检测各组宫颈癌细胞N-cadherin、E-cadherin蛋白表达
2.2 miR-425-5p 和PTEN 靶向关系预测和鉴定生物信息学软件发现miR-425-5p 和PTEN 有互补结合位点,WT 和miR-425-5p inhibitor 共转染后的宫颈癌细胞荧光素酶活性升高(P<0.05),见表2。miR-425-5p和PTEN互为靶向关系。
表2 两组突变型载体MUT、野生型载体WT荧光素酶活性比较/± s

表2 两组突变型载体MUT、野生型载体WT荧光素酶活性比较/± s
组别Anti-NC Anti-miR-425-5p t值P值重复次数99 MUT 1.00±0.11 0.97±0.09 0.63 0.540 WT 1.00±0.13 2.68±0.23 19.08<0.001
2.3 下调miR-425-5p 对宫颈癌细胞中PTEN 蛋白表达影响Control 组、Anti-NC 组、Anti-miR-425-5p组宫颈癌细胞中PTEN 蛋白水平分别为(0.46±0.05)、(0.45±0.03)、(0.92±0.08),三组比较差异有统计学意义(F=198.61,P<0.001),宫颈癌细胞转染miR-425-5p inhibitor 以后,细胞中PTEN 蛋白表达水平升高(P<0.05),见图3。下调miR-425-5p 促进宫颈癌细胞中PTEN蛋白表达。
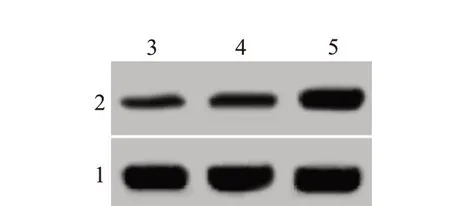
图3 蛋白质印迹法检测各组宫颈癌细胞PTEN蛋白表达
2.4 PTEN siRNA 对下调miR-425-5p 的宫颈癌细胞增殖、侵袭和迁移能力影响与共转染siRNA control、miR-425-5p inhibitor 比较,共转染PTEN siR‑NA、miR-425-5p inhibitor后的宫颈癌细胞吸光度、侵袭数目、迁移数目均升高,PTEN 蛋白水平降低,Ncadherin 蛋白水平则升高,E-cadherin 蛋白表达水平下降(P<0.05),见图4,表3。
表3 PTEN siRNA转染前后的下调miR-425-5p宫颈癌细胞吸光度、侵袭数目、迁移数目以及N-cadherin、E-cadherin、PTEN蛋白水平比较/± s
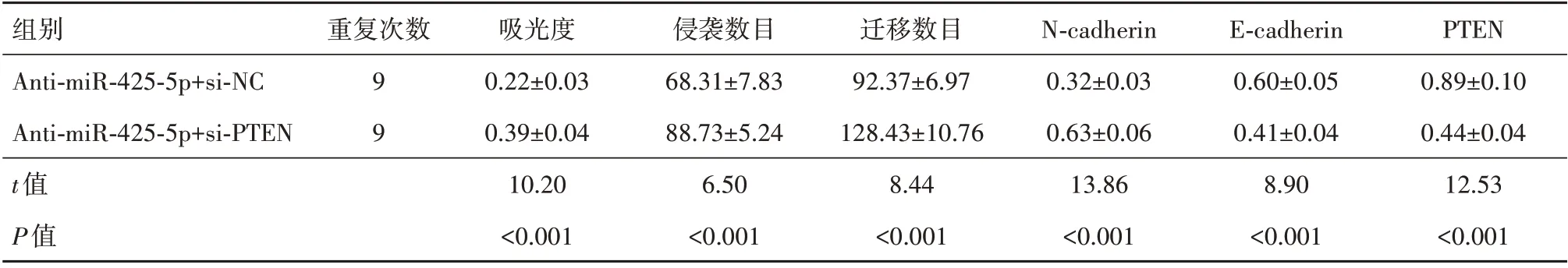
表3 PTEN siRNA转染前后的下调miR-425-5p宫颈癌细胞吸光度、侵袭数目、迁移数目以及N-cadherin、E-cadherin、PTEN蛋白水平比较/± s
注:PTEN为第10号染色体同源缺失性磷酸酶-张力蛋白,N-cadherin为神经钙黏素,E-cadherin为上皮钙黏素。
组别Anti-miR-425-5p+si-NC Anti-miR-425-5p+si-PTEN t值P值PTEN 0.89±0.10 0.44±0.04 12.53<0.001重复次数99吸光度0.22±0.03 0.39±0.04 10.20<0.001侵袭数目68.31±7.83 88.73±5.24 6.50<0.001迁移数目92.37±6.97 128.43±10.76 8.44<0.001 N-cadherin 0.32±0.03 0.63±0.06 13.86<0.001 E-cadherin 0.60±0.05 0.41±0.04 8.90<0.001

图4 蛋白质印迹法检测各组宫颈癌细胞PTEN、N-cadherin、E-cad‑herin蛋白表达
3 讨论
miRNA 是由其初始产物在细胞核内经过RNA聚合酶Ⅱ特异性作用而形成的[10]。miRNA 生物学功能较多,在不同的组织中表达水平不同,miRNA可能参与决定细胞以及组织的功能特异性[11]。miRNA 与肿瘤的关系十分密切,其在肿瘤进展中发挥类似癌基因或抑癌基因的作用,改变其表达可能是肿瘤治疗的途径[12]。miR-425-5p 在人体中作用广泛,与脂肪细胞分化、心肌纤维化等有关,miR-425-5p 通过调控细胞的增殖、分化等过程参与疾病进展[13-14]。miR-425-5p 在肾癌细胞和组织中高表达,miR-425-5p 在肾癌细胞恶性生长中发挥促进作用[6]。在胃癌等肿瘤中发现miR-425-5p能够正调控肿瘤细胞的侵袭和迁移,下调其表达能够降低肿瘤细胞的转移潜能[7]。既往的研究显示,miR-425-5p在宫颈癌中高表达与病人的淋巴结转移有关,下调miR-425-5p 诱导宫颈癌细胞凋亡[8-9]。本次研究显示,下调miR-425-5p 后的宫颈癌细胞增殖、侵袭和迁移能力均下降,提示下调miR-425-5p 抑制宫颈癌细胞转移潜能,这与以前的研究结果相符合,提示miR-425-5p在肿瘤转移中可能发挥促进作用。
N-cadherin 是间质细胞标志蛋白,E-cadherin 是上皮细胞标志蛋白,其表达水平的改变与细胞EMT水平有关[15]。另外,N-cadherin 是一个在肿瘤中高表达的癌基因,而E-cadherin 是在肿瘤中低表达的抑癌基因,二者表达改变与肿瘤的进展有关[16]。我们的实验结果表明,下调miR-425-5p 后的宫颈癌细胞中N-cadherin 蛋白表达水平下降,E-cadherin 蛋白表达水平升高,提示下调miR-425-5p 抑制宫颈癌细胞EMT。研究显示,肿瘤细胞EMT 发生在肿瘤转移之前,其EMT水平越高细胞转移能力也就越强[17-18]。本实验结果充分证实,下调miR-425-5p 可以降低宫颈癌细胞转移潜能。
研究报道显示,miRNA 的作用靶点有多个,其与蛋白质的调控因子不同,miRNA 能够在高层次影响细胞生物学行为,miRNA 在不同的生理或病理进程中调控的靶基因可能不同,这也是miRNA 功能多样的重要原因[19-20]。在乳腺癌中的研究显示,miR-425-5p 可以通过靶向调控PTEN 影响肿瘤进展[21]。我们的实验表明,miR-425-5p 能够负调控宫颈癌细胞中PTEN 蛋白表达,提示miR-425-5p 参与宫颈癌进展可能也与PTEN 有关。PTEN 是一个与细胞生长有关的抑癌基因,其在宫颈癌中表达下调,上调可以显著抑制肿瘤细胞的转移潜能[22]。本研究表明,降低PTEN 表达可以部分逆转抑制miR-425-5p抗宫颈癌细胞增殖和侵袭、迁移以及EMT 功能,下调miR-425-5p 影响宫颈癌细胞转移潜能作用机制与靶向调控PTEN 有关,这与上述研究结果相符合,说明下调miR-425-5p 对肿瘤影响的作用机制与PTEN有关。
总之,下调miR-425-5p 具有抑制宫颈癌细胞侵袭和迁移的作用,机制与PTEN 有关,miR-425-5p 可能促进宫颈癌转移。宫颈癌的分子发生机制较为复杂,今后会在多株宫颈癌细胞以及体内验证miR-425-5p的作用及下游调控机制。(本文图1见封三)

