榨菜根肿病常发地根际土壤微生物群落特征研究①
刘烈花,龚杰,皮静,董鹏,况觅,李姗蓉,袁国明,丁伟
1.西南大学 植物保护学院, 重庆 400715; 2.重庆市农业技术推广总站, 重庆 401121;3.重庆安邦农业发展有限公司, 重庆 400030
芸薹根肿病菌(PlasmodiophorabrassicaeWoronin)是原生动物界专性寄生菌, 最早于1737年在英国地中海西岸和欧洲南部发现, 其引起的十字花科根肿病造成全世界十字花科作物损失惨重, 目前已迅速蔓延至我国四川、 贵州、 云南等油菜产区, 并对榨菜、 甘蓝、 白菜、 萝卜等十字花科作物造成伤害. 近年来, 我国十字花科根肿病的发生面积逐年扩大, 危害程度逐年加重, 严重制约着十字花科作物产业的发展[1-3]. 根肿病的休眠孢子在土壤中具有极强的生命力, 存活20年仍能保持侵染活性[4]; 休眠孢子经十字花科植物的根际分泌物刺激萌发后侵染其根毛和皮层组织, 侵染率高, 造成根部组织膨大[5]; 休眠孢子可通过流水、 昆虫、 农事操作等多种途径进行传播, 防治难度较高. 目前国内外对根肿病的研究非常重视, 但进展缓慢, 其防治技术主要采取抗病品种筛选、 药剂防治和农事管理等措施, 防治效果均不够理想, 特别是药剂防治的弊端日渐突出[6-7]. 已有研究表明, 根肿病的休眠孢子与寄主植物根际微生物群落具有潜在的相互关系. 经验证土壤中存在多种有益菌, 能显著抑制根肿病菌, 例如枯草芽孢杆菌XF-1(Bacillussubtilis)[8-9], 木霉菌(Trichodermaspp.)[10-11], 链霉菌(Streptomycesplatensis)[12-13], 溶杆菌(Lysobacter)[14]等. 因此, 通过根际微生物群体控制土传病害, 即构建植物生物屏障体系来抵御病原物入侵的研究越来越受到重视[13,15].
土壤微生物群落是影响植物健康生长的重要因素, 合理的群落结构有助于植物对土壤中养分的吸收, 增强其对非生物胁迫的耐受性, 并保护宿主植物免受病原体的侵染[11,16]. 因此构建一个合理的根际微生物群落在植物和病原物的相互作用中将发挥至关重要的作用, 同时也为生物屏障的构建打下基础[17-18]. 植物构建生物屏障的作用机理主要包括: ①微生物互作过程中所产生的化合物对病原物的杀菌活性; ②与病原物在空间、 资源上的竞争作用; ③增强植物免疫反应, 更好地抵御病原物的入侵[19-20]. 近年来构建植物根际生物屏障防治各种土传病害已逐渐成为研究的热点[21]. 已有研究表明, 通过综合农业措施来调控植物根际土壤微生物的组成能有效抑制烟草青枯病[22-23]、 烟草黑胫病[24]、 棉花枯萎病[25]、 香蕉枯萎病[26]等土传病害的发生; 对甘蓝根肿病而言, 健康的根际土壤微生物群落组成随时间的变化而变化, 而根肿病的入侵也改变了根际土壤中微生物的群落结构[27]. 还有研究表明, 大白菜根肿病发病的根际土壤与健康的根际土壤在微生物群落结构和组成上显著不同, 并强调了根际微生态机制在防控根肿病中的重要作用[28].
为了进一步揭示榨菜根肿病发病植株(以下简称为病株)和健康植株(以下简称为健株)根际土壤微生物的群落特征, 本研究在重庆市涪陵区常年连作的榨菜种植区, 采集根肿病发生严重的病株和健株的根际土壤, 通过对细菌16S rDNA和真菌ITS的高通量测序, 分析病株和健株根际土壤中细菌和真菌的群落结构组成差异和互作关系特征, 揭示根际土壤微生物群落在维护植物健康中所发挥的重要作用. 本研究结果对于深入理解根肿病发生的根际微生态机制以及研发其综合防控技术具有重要意义.
1 材料与方法
1.1 样品采集
采样地位于重庆市涪陵区, 该区属中亚热带湿润季风气候区. 采样地块较为平整, 榨菜种植密度: 行距120 cm, 株距55~60 cm, 每667 m2平均种4 600株; 榨菜连作10年以上, 且根肿病高发. 在涪陵区榨菜根肿病发生严重的5个乡镇(江北街道、 南沱镇、 清溪镇、 珍溪镇、 百胜镇), 共设置10个采样基点, 每个基点选择3块地, 每块地采用5点取样法采集病株根际土壤, 混合均匀作为1个样品, 同时采用5点取样法采集健株根际土壤, 混合均匀作为1个样品, 得到病株和健株根际土壤各30个样品. 病株和健株根际土壤的采集方法: 将植物连根拔起, 稍加抖动后取附着在根部上的土壤放入自封袋中, 置于冰盒内短暂冷藏保存后带回研究室, 过2 mm筛后, 保存于-80 ℃超低温冰箱中, 用作土壤微生物群落特征分析. 本研究对病株和健株的根际土壤进行Illumina测序分析, 并对土壤样本进行理化性质测定. 有文献表明, 茎瘤芥根肿病根际土壤与健康根际土壤的pH无明显变化. 土壤导电率、 有机质、 碱解氮、 全氮含量在健株和病株根际土壤之间虽呈现出健株略高的趋势, 但除土壤导电率含量在健株的根际土壤之间差异有统计学意义外, 其余各土壤样品之间差异均无统计学意义. 然而, 有效磷、 全钾、 全磷含量却表现出与土壤导电率(EC)、 有机质、 碱解氮、 全氮含量不一致的变化趋势, 首先均表现出茎瘤芥根肿病病株显著低于健株的趋势, 其中以有效磷和全钾含量表现最为突出, 与健株之间差异有统计学意义. 因此得出, 茎瘤芥根肿病的发生导致茎瘤芥根际土壤 pH下降, 还导致包括有效磷、 全磷、 全钾养分含量的显著降低[29].
1.2 榨菜根际土壤微生物DNA提取
根据FastDNA SPIK Kit土壤试剂盒 (MP Biomedicals, Solon, OH, USA)说明书进行总DNA抽提. DNA浓度和纯度利用NanoDrop 2000进行检测, 利用1%琼脂糖凝胶电泳检测DNA提取质量. 细菌扩增引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和 806R(5′-GGACTACHVGGGTWTCTAAT-3′)[28]; 真菌扩增引物为 ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和 ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)[30]. 根据各引物对可变区进行PCR扩增, 扩增程序: 95 ℃预变性3 min, 27个循环(95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s), 最后72 ℃延伸10 min(PCR仪: ABI GeneAmp© 9700型). 扩增体系为20 μL, 4 μL 5*FastPfu缓冲液, 2 μL 2.5 mmol/L dNTPs, 0.8 μL引物(5 μmol/L), 0.4 μL FastPfu聚合酶; 10 ng DNA模板[31]. 使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA) 进行纯化, Tris-HCl洗脱, 2%琼脂糖电泳检测. 将纯化质量合格的PCR产物用于DNA文库构建, 采用二代测序技术(Illumina)进行微生物多样性测序.
1.3 数据处理和统计分析
原始Illumina fastq文件采用QIIME v1.7.0(微生物生态学定量分析)进行多路分解、 质量过滤和分析. 操作分类单元(OTUs)的阈值为97%的成对识别. 高可信度OTUs的识别标准: 任何样本的总体丰度大于20个读取片段, 按最小采样序列个数进行子采样. 利用基于taxa的OTUs计算细菌和真菌各门的相对丰度, 比较病株和健株根际土壤中微生物的总体分布. 根据OTU数据进行Alpha多样性和Beta多样性分析. 微生物群落Alpha多样性采用ACE 指数、 Chao1 指数和Shannon 指数表示, ACE 指数和Chao1 指数是用来估量样本内微生物的丰富度, Shannon 指数是涵盖物种丰富度及物种个体分布均匀度两个方面的多样性指标. 这3个指数越高, 代表样本内物种丰富度和多样性越高. 微生物群落β多样性采用PCoA(Principal Co-ordinates Analysis)分析并基于Bray_curtis矩阵进行作图[31].
将每个处理中平均相对丰度大于0.2%的细菌和真菌OTU进行筛选. 按照分子生态学网络分析流程(MENAP)进行在线分析(http: //ieg2.ou.edu/MENA/main.cgi), 完成在线分析后, 利用gephi软件进行网络构建.
2 结果与分析
2.1 榨菜根际土壤微生物测序深度评估
通过细菌16S rDNA和真菌ITS高通量测序分析, 60份样品(包括30个健株和30个病株根际土壤)共获得细菌3 347 272个有效序列读取数和13 253个OTUs, 平均读取长度为256 bp, 样本抽平后, 保留29 076个读数进行分析; 获得真菌4 226 818个有效序列读取数和3 767个OTUs, 平均读取长度为224 bp, 样本抽平后, 保留41 228个读数进行分析. 稀疏曲线(图1)表明, 测序数量基本合理, 其深度足以进行下游分析.
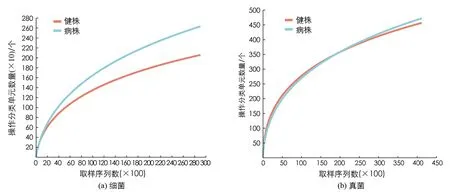
图1 根际土壤样本稀释曲线
2.2 土壤微生物Alpha多样性分析
健株和病株根际土壤测定的细菌覆盖率分别为97.46%和96.38%, 真菌覆盖率分别为99.65%和99.58%, 该数据足以代表根际土壤细菌的多样性, 并反映出真实环境中土壤微生物的群落结构. 对榨菜根肿病病株和健株的根际土壤微生物群落进行Alpha多样性分析(表1)发现, 无论是细菌还是真菌, 其病株的ACE 指数, Chao1 指数均高于健株, 而Shannon 指数就细菌而言并未达到统计学意义, 但真菌的Shannon指数健株显著高于病株. 结果表明, 病株根际土壤微生物群落丰富度较高, 而健株根际土壤微生物群落的均匀度较高, 亦即物种数量的分布更为均匀, 尤其是微生物中的真菌更为突出.
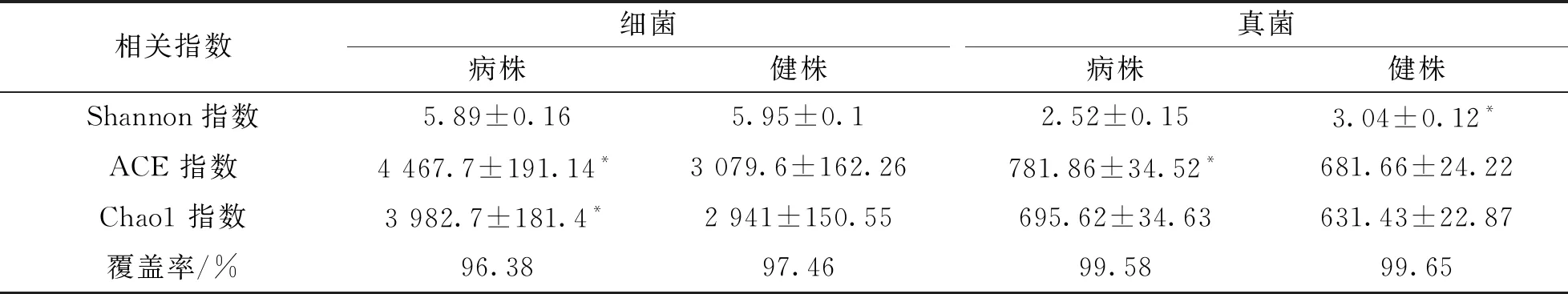
表1 根肿病病株和健株根际土壤Alpha多样性指数
2.3 土壤微生物群落组成分析
由图2a可知, 从榨菜植株根际土壤中检测出的细菌隶属于57个门, 155个纲, 326个目, 615个科, 1 346个属. 主要细菌门(相对丰度E≥5%)包括变形菌门(Proteobacteria)占42.65%, 放线菌门(Actinobacteria)占19.54%, 拟杆菌门(Bacteroidetes)占8.78%, 绿弯菌门(Chloroflexi)占8.18%和酸杆菌门(Acidobacteria)占5.28%. 对榨菜根肿病病株和健株根际土壤细菌进行门水平的比较(图2b)发现, 健株根际土壤中放线菌门的相对丰度比病株的高出了6.36倍, 而病株根际土壤中拟杆菌门的相对丰度比健株高出了4.19倍.
由图2c可知, 从榨菜植株根际土壤中检测出的真菌分别隶属于8个门, 30个纲, 99个目, 228个科, 484个属. 主要真菌门(相对丰度E≥10%)包括子囊菌门(Ascomycota)占46.35%, 接合菌门(Zygomycota)占17.75%, 壶菌门(Chytridiomycota)占17.5%, 担子菌门(Basidiomycota)占12.52%. 对榨菜根肿病病株和健株根际土壤真菌进行门水平的比较(图2d)发现, 病株根际土壤中壶菌门的相对丰度比健株高9.99倍, 健株根际土壤中担子菌门的相对丰度比病株高9.11倍.

*表示p<0.05, **表示p<0.01, ***表示p<0.001, 差异有统计学意义.
2.4 土壤微生物Beta多样性分析
榨菜根肿病病株和健株根际土壤中细菌和真菌群落的主坐标分析(PCoA)如图3. 细菌群落第1,2主坐标的贡献率分别为24.92%和8.54%, 真菌群落分别为18.85%和11.26%. 由图3看出, 无论是细菌群落还是真菌群落, 其健株根际土壤样本主要分布在2,3象限, 且较为集中, 而病株根际土壤样本主要分布在1,4象限, 且较为分散. 这说明各采样点健株根际土壤的微生物群落(包括细菌和真菌), 其结构大体相似, 而病株根际土壤微生物群落结构差异较大, 这也说明病株与健株的根际土壤微生物群落结构显著不同.
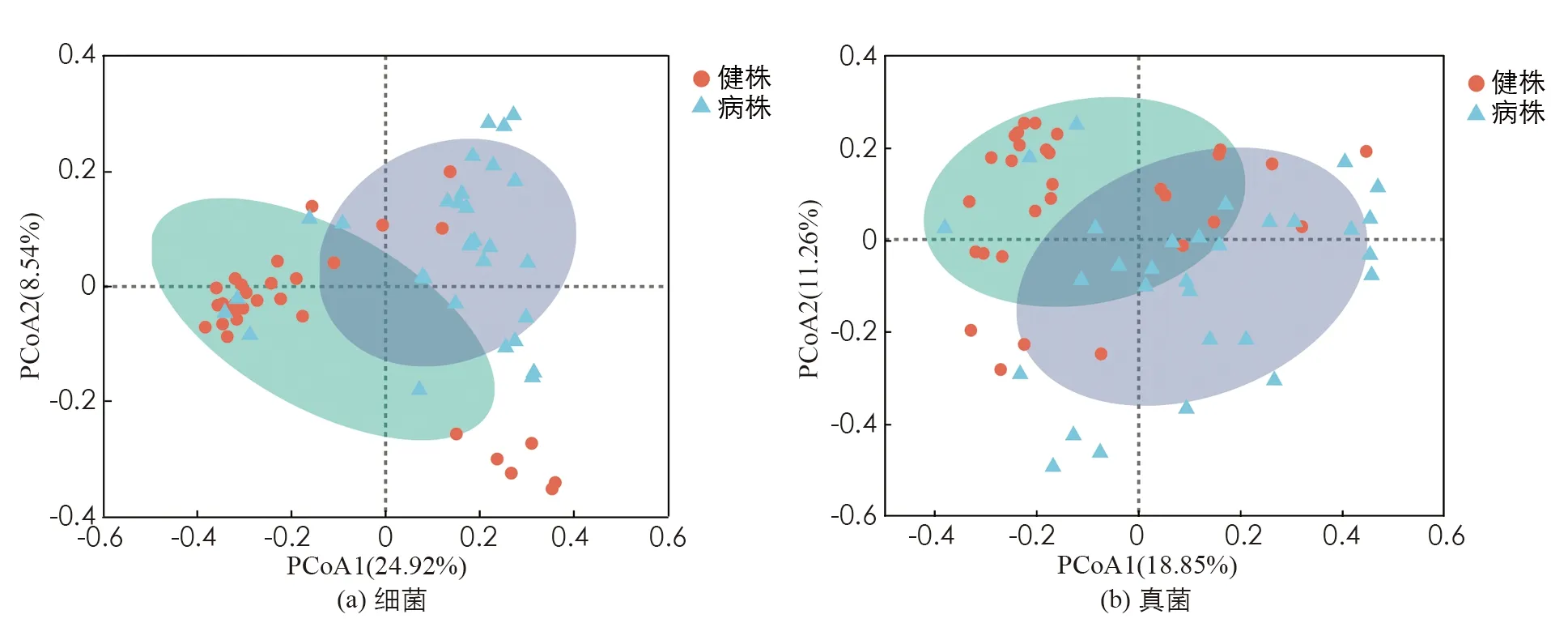
图3 病株与健株的基于bray-curtis距离的土壤微生物群落结构分析
2.5 土壤微生物网络拓扑分析
构建基于随机矩阵理论(RMT)网络分析图, 能阐明微生物群落中不同物种间的相互作用并寻找影响整个群落组成变化的关键物种. 由关联网络图可知, 健株根际土壤微生物群落网络图中各物种表现更为活跃, 构成的关联也较病株根际土壤多(图4). 其网络拓扑参数(表2)显示, 健株根际土壤细菌网络含有40个节点、 38个边缘, 而病株根际土壤中仅含有27个节点、 22个边缘; 健株根际土壤真菌网络含有78个节点、 171个边缘, 而病株根际土壤中仅含有45个节点、 71个边缘. 从连接度来看, 无论是细菌还是真菌, 健株均高于病株.
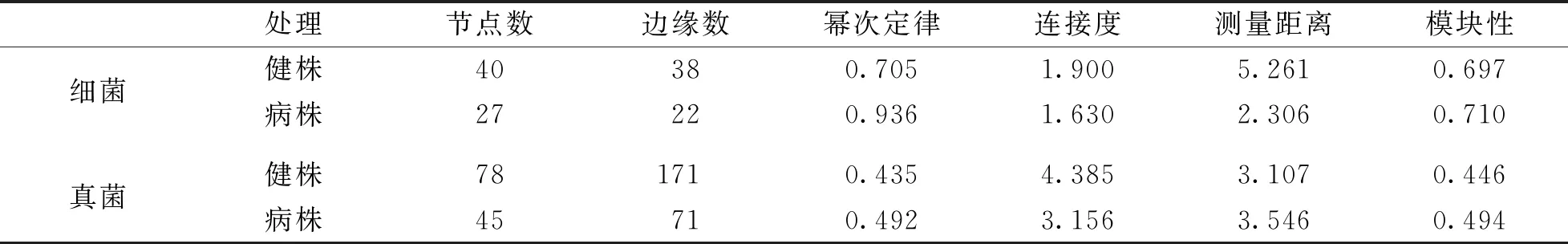
表2 病株和健株根际土壤微生物群落的系统发育分析生态学网络结构指标

每个节点代表1个OTU, 节点颜色是根据微生物所属门进行染色的. 较大的节点表示中间中心性,线表示节点之间的相关性, 绿线和红线分别表示正相关性和负相关性.
此外, 根据网络拓扑分析还筛选出, 最大中心性排名前10的微生物物种(OTU), 其中已被明确鉴定的细菌有Mucilaginibacter(OTU12403)和Variovorax(OTU11035), 真菌有Penicillium(OTU378,OTU1296)和Cryptococcus(OTU2623), 这些物种具有高度的中心性和相关性, 可能是维持微生物生态网络稳定和抑制根肿病发生的关键性微生物.
3 讨论
越来越多的研究认为植物根际土壤微生物群落是影响植物健康和抑制土传病害的重要因素. 一般来说, 较高的微生物群落多样性能缓冲病原物入侵的影响, 进而也改变了根际微生物群落的功能和组成[30,32]. 根际微生物群落多样性越高, 物种越丰富, 作物抗病性就越强[33-34]. 本研究通过Alpha多样性分析结果表明, 虽然反映群落物种丰富度的ACE指数和Chao1指数在病株根际土壤中比健株根际土壤更高, 但其反映群落多样性的Shannon指数却正好相反, 即健株根际土壤微生物群落的多样性高于病株根际土壤. Shannon多样性指数是群落物种丰富度和物种个体分布(均匀度)的测量指数, 因此这一结果也表明健株根际土壤微生物群落的丰富度(物种数)虽然较低, 但其每个物种的个体分布更均匀. 向立刚等[31]的研究也表明, 因病枯萎或者死亡的植株, 由于其根系分泌物的影响, 根际土壤微生物群落的丰富度大大增加. 但Wei等[35]报道认为, 青枯病菌的入侵导致番茄根际土壤微生物群落多样性和丰富度降低, 为病原物的再次入侵提供了更好的条件[35]. 因此, 如何求得土壤微生物群落结构的多样性、 群落稳定性以及植物抗病性三者最恰当的组合, 将是今后研究的一个重要课题.
Beta多样性利用各样本序列间的进化关系及丰度信息来计算样本间距离, 反映样本(组)间是否具有显著的微生物群落差异. 本研究采用主坐标分析(PCoA)对各采样点进行降维排序分析, 结果表明, 健株根际土壤微生物群落, 无论是细菌或真菌都比较集中, 主要分布在第2,3象限, 而病株的比较分散, 主要分布在第1,4象限. 这一结果反映出健株和病株根际土壤微生物群落在组成结构上存在一定的差异性, 健株根际土壤微生物的群落组成结构在各采样点上相似度较高, 而病株的差异较为显著, 进一步说明榨菜根肿病的发生影响了根际土壤微生物群落的组成结构.
有研究表明, 子囊菌门、 担子菌门、 壶菌门等是根际土壤中相对丰度较高的真菌门[36]. 本研究发现, 在健株根际土壤真菌群落中, 担子菌门的相对丰度显著高于病株土壤, 前人研究也表明担子菌门的微生物在抑病土壤中的丰富度较高[37]. 担子菌门的微生物是土壤碳循环中的重要分解者[38], 能把木质素、 纤维素等分解成小分子化合物, 因此健康根际土壤中相对丰度较高的担子菌门能促进土壤碳循环的利用[39], 从而可能在一定程度上抑制榨菜根肿病的发生. 也有研究表明, 某些特定的细菌类群是土壤发挥抑病作用的重要指标[40], 土壤根际微生物群落中变形菌门、 酸杆菌门、 放线菌门、 厚壁菌门等对维护植物健康发挥着重要作用[40-42]. 放线菌门的很多细菌能产生抗生素从而对病原物起到控制作用[43]. 本研究发现, 健株根际土壤细菌群落放线菌门的相对丰度显著高于病株根际土壤, 进而有助于抑制根肿病的发生.
土壤微生物群落网络互作中联系越多, 表明其稳定性越高, 抑制病原物入侵的能力也会越强[35,44]. 本研究根际土壤微生物群落网络拓扑图及其参数显示, 无论是真菌还是细菌, 其健株的节点数、 边缘数和连接度均大于病株, 表明健株根际土壤微生物群落内物种的相互作用更为紧密, 因此能更好地发挥生态效益, 抑制榨菜根肿病病原物的入侵. 此外, 本研究通过网络分析筛选出网络中心性值最大的, 亦即在群落中具有关键性作用的物种, 其中已鉴定出的细菌Mucilaginibacter在健康根际土壤中显著富集, 但其在土壤中所发挥的作用还有待探索[45]. 另一种已鉴定出的细菌Variovorax其某些株系所产生的次级代谢产物, 或者其产生的铁载体在维护植物健康中发挥着重要作用[46]. 有研究表明,Variovorax是土壤微生物群落的一类核心细菌属, 在维持土壤微生物-植物信号网络的复杂生态网络中发挥着重要作用[47]. 在已鉴定出的真菌中, 青霉菌属Penicillium大多数被认为是土壤腐生菌, 但对立枯丝核病原菌的拮抗作用也被广泛报道[48-49], 其生物学特性已经在生物技术领域中得到了广泛利用. 另一种鉴定出的真菌Cryptococcus同时对多种病原真菌禾谷镰孢菌(Fusariumgraminearum)、 扩张青霉病菌(Penicilliumexpansum)、 灰葡萄孢(Botrytiscinerea)和匍枝根霉(Rhizopusstolonifer)等表现出良好的拮抗活性[50-51], 其拮抗机制主要包含生态位竞争、 诱导植株抗病性和形成生物膜等[52]. 前人研究也表明在健康根际土壤中Cryptococcus具有较高的丰度, 它与病原物之间存在显著负相关[53-54]. 目前尚未探究评估所筛选出来的潜在拮抗微生物类群与根肿病之间的直接相关性, 以及其抑病效果及作用机制. 因此, 这些特定细菌类群的有益作用及对根肿病发生的影响将是未来进一步深入研究的内容.
近年来, 农业微生物生物防治的重点由单一微生物菌株转向微生物组的群体水平, 基于微生物组的合成功能菌群研究, 借以改变土壤微生物群落的组成和结构, 对抑制土传病害具有重要作用. Niu等[55]构建有7种有益微生物组成的群落对镰刀菌(Fusariumverticillioides)引起的土传病害具有很好的防控效果; 短小芽孢杆菌(Bacilluspumilus)、 枯草芽孢杆菌(Bacillussubtilis)及萎蔫短小杆菌(Curtobacteriumflaccumfa-ciens)组合对于提升黄瓜抵御不同病原菌的能力有显著效果[56]; 通过接种黄单胞菌(Xanthomonas)、 寡养单胞菌(Stenotrophomonas)和微杆菌(Microbacterium)可以提高作物对拟南芥真菌病原体的抵抗力[57]. 这些组合模型也为今后进一步研究通过有益合成功能菌群操纵榨菜根际微生物群落来防控根肿病提供了科学的理论依据和技术参考.

