山羊RPL26基因生物信息学分析及对肌内脂肪细胞分化的影响
张 浩,王 永*,李艳艳,罗 成,李 鑫,李志雄,朱江江,林亚秋*
(1.西南民族大学 青藏高原动物遗传资源保护与利用教育部/四川省重点实验室,成都 610041;2.西南民族大学畜牧兽医学院,成都 610041)
羊肉不但口味鲜美,风味独特,而且富含蛋白质和微量元素,是一种十分优质健康的肉类。羊肉作为食材,其口感和风味是决定其经济价值的关键,因此探究影响羊肉品质的因素也成为分子育种的关键。在影响肉质的多种因素中,肌内脂肪含量占据着极重要的地位,不但直接影响着肉类的市场价格[1],更直接影响到肉的风味和嫩度[2]。脂肪沉积决定了肌内脂肪含量,肌内脂肪细胞分化是肌内脂肪沉积的重要途径,脂肪细胞分化受多种基因和蛋白质共同调控,而核糖体蛋白作为核糖体的关键组成部分,不仅在基因的转录表达水平上发挥着重要作用,更决定着蛋白质表达水平,在生物学进程中发挥着关键作用。因此,明确山羊肌内脂肪细胞分化的分子机制对改善羊肉品质和风味具有重要意义。
核糖体是细胞蛋白质合成进程中的关键细胞器,由rRNA和核糖体蛋白(ribosomal protein,RP)组成,广泛存在于多种细胞中,在细胞生物体生命进程以及病理生理中发挥着重要作用[3]。核糖体蛋白发生突变时会导致先天性纯红细胞再生障碍性贫血[4]。现有研究发现,核糖体蛋白不仅在构成核糖体时发挥作用,同时还在细胞进程中发挥着多种生物学功能,如细胞增殖[5-7]、细胞凋亡[8]、DNA损伤[9]、细胞生长和分化等。李霞[10]发现,RPL9蛋白与SCD5(stearoyl-coA desaturase,SCD5)结合,有效地提高了SCD5的活性从而调节能量代谢。核糖体蛋白还通过直接影响蛋白质的生物合成发挥其生物学功能,RPL26作为核糖体蛋白的一员可受UFM1(ubiquitin fold modifier 1,UFM1)泛素化修饰,从而促进蛋白质的生物合成[11];同时,RPL26的泛素化修饰可以通过影响蛋白质分泌从而影响血红蛋白的产生[12];也有研究发现,核糖体蛋白会直接影响细胞周期,Li等[13]发现,在胰腺癌中干扰KRS表达使核糖体蛋白RPL26和RPL29的表达特异性上调,而干扰RPL26和RPL29的表达会诱导细胞阻滞在G0/G1期,活性氧生成也受到抑制,促使细胞凋亡;目前关于RPL26的研究主要集中在细胞增殖和细胞的功能缺陷,但RPL26可能在山羊肌内脂肪细胞分化过程中所发挥的生物学功能仍不明确。
因此,本试验利用RT-PCR等技术扩增山羊RPL26基因序列,并对其进行生物信息学分析,利用RT-qPCR检测其组织表达特性,并通过过表达山羊RPL26等手段明晰其在肌内脂肪细胞分化中的调控作用,为最终阐明脂肪沉积机制提供基础数据和新思路。
1 材料与方法
1.1 试验材料
DMEM-F12、FBS、双抗、TurboFect Transfection Reagent、RevertAid First Strand cDNA Synthesis Kit购自赛默飞;pMD-19T、TRIzol、TB GreenTMPremix Ex TaqTMⅡ、Hind III快切酶、EcoR I快切酶、T4连接酶购自TaKaRa;2×Rapid Taq Master Mix酶、凝胶胶回收纯化试剂盒购自南京诺唯赞;DL2000 DNA Mraker、核酸染料、DH5α感受态细胞、质粒提取试剂盒购自天根;氨苄购自Biosharp。
1.2 试验方法
1.2.1 山羊组织RNA获取及cDNA反转录 试验动物为3只健康且生长状态良好的1周岁简州大耳羊公羊,体重约50 kg,购自大哥大牧业。本试验取实验室前期冻存的心、肝、脾、肺、肾、背部皮下脂肪、腹部皮下脂肪、小肠、背最长肌、股二头肌和臂三头肌等组织,TRIzol法提取组织总RNA,电泳验证RNA完整性,测定RNA浓度及纯度,取1 μg 总RNA利用RevertAid First Strand cDNA Synthesis Kit反转录cDNA,5倍稀释后-20 ℃保存备用。
1.2.2 山羊RPL26基因克隆 根据NCBI山羊RPL26基因预测序列(XM_005693558.3),利用Primer Premier 5.0设计克隆及定量引物,由上海生工生物工程股份有限公司合成引物,引物信息见表1。以小肠组织cDNA为模板,PCR反应总体系25 μL:2×Rapid Taq Master Mix酶 12.5 μL,上、下游引物各1 μL,cDNA1 μL,ddH2O 9.5 μL;PCR反应程序:95 ℃预变性3 min;95 ℃ 变性15 s,50 ℃退火 15 s,72 ℃延伸 30 s,40个循环;72 ℃完全延伸 5 min;4 ℃保存。电泳鉴定后切取目标条带纯化回收,将回收片段连接到pMD-19T载体,连接体转化至DH5α感受态细胞:取100 μL转化产物转涂到含氨苄抗性的固体培养基中37 ℃培养10 h。挑取单一呈圆形的阳性菌落,菌液PCR鉴定单一正确的目的基因条带后,送至擎科生物科技有限公司测序。

表1 引物信息
1.2.3 山羊RPL26生物学特性分析 利用ORF Finder预测山羊RPL26的开放阅读框,结合SnapGene对山羊RPL26编码的氨基酸序列进行预测,NCBI对氨基酸进行同源性分析,并利用MEGA7.0构建系统进化树,分别用ExPASy、Net Phos3.1、NetNGlyc1.0Server和ExPASy Protscale对山羊RPL26蛋白质的理化性质、磷酸化位点、糖基化位点、疏水性进行预测,利用TMHMM、PSORTⅡ、SignaIP4.1 server、NPS@SOPMA、SWISS-MODEL对山羊RPL26蛋白质的跨膜区、细胞定位、信号肽、蛋白质的二级结构和三级结构进行预测,并利用STRING交互式数据库预测蛋白质互作关系。
1.2.4 qPCR检测山羊RPL26的组织表达特性 根据基因克隆得到的山羊RPL26基因CDS区序列设计qPCR引物(表1),qPCR反应体系见表2。取“1.2.1”中获得的组织cDNA样品作为模板(n=3),反应体系为20 μL:TB GreenTMPremix Ex TaqTMⅡ 10 μL,上、下游引物各1 μL,cDNA1 μL,ddH2O 7 μL;PCR程序:95 ℃预变性3 min;95 ℃变性30 s,退火15 s,72 ℃延伸15 s,40个循环;4 ℃保存。
1.2.5 山羊肌内脂肪细胞培养 取7日龄简州大耳羊公羊背最长肌,剪碎后用胶原酶消化,采用差速贴壁法分离山羊原代肌内脂肪细胞,梯度冷冻后液氮中保存。37 ℃水浴迅速复苏实验室液氮冻存山羊原代肌内脂肪细胞,离心弃去冻存液,用含10% FBS和1‰双抗的DMEM-F12培养基在37 ℃,50 mL·L-1CO2的培养箱中培养,此时作为F1代,每48 h换液,细胞融合度达80%~90%时传代,传至F3接种于培养板,12孔板每孔4×104个,24孔板每孔2×104个。
1.2.6 山羊RPL26过表达载体构建 根据山羊RPL26序列,利用SnapGen分析序列中所包含的酶切位点,选择Hind III和EcoR I作为酶切位点,设计包含酶切位点且克隆产物包含完整CDS区域的引物,引物见表1,以克隆获得包含完整RPL26序列的pMD19-T质粒为模板,PCR产物纯化后与pCMV-eGFP质粒分别酶切纯化,并将纯化产物利用T4连接酶16 ℃连接10 h,连接体转入感受态细胞,送至擎科生物科技有限公司测序。
1.2.7 山羊RPL26过表达载体转染 取构建成功的山羊RPL26过表达载体测量浓度,按照12孔板每孔过表达载体1 μg、opti 200 μL、转染试剂4 μL,24孔板减半,配置预混液,室温孵育15 min后加入孔板,设置转入pCMV-eGFP空载质粒作为对照组,转染12 h后换液为50 μmol·L-1油酸诱导液诱导分化,诱导分化2 d。
1.2.8 油红O染色、DAPI染色和Bodipy染色 24孔板弃去培养基,PBS清洗3遍,孔中加入200 μL油红染色30 min后PBS洗3遍后拍照,拍照后每孔加入1 mL异丙醇,吹打后转至96孔板测量490 nm OD值;DAPI每孔100 μL,染色10 min后PBS清洗3遍,加入200 μL Bodipy染色后拍照,Bodipy和DAPI染色严格避光。
1.2.9 qPCR检测RPL26过表达效率及成脂相关基因表达情况 12孔板弃去培养基后,PBS清洗3遍,利用TRIzol裂解细胞,提取RNA,验证RNA完整性并反转录,反转录样品5倍稀释后qPCR检测RPL26及成脂相关基因表达情况,反应程序及反应体系同“1.2.4”,引物信息和Tm值见表1。
1.2.10 数据统计分析 定量结果采用2-ΔΔCt法处理,以UXT为内参基因,数据以“Mean±SEM”表示,用SPSS 24.0中One-way ANOVA进行显著性分析,P<0.05认为差异显著,P<0.01认为差异极显著,利用Graphpad prism 9.0绘图。
2 结 果
2.1 山羊RPL26基因克隆
以小肠组织的cDNA为PCR模板,扩增得到的产物片段符合预期目的产物大小,电泳验证结果见图1A,目的基因RPL26的片段大小为544 bp,CDS区为438 bp(图1B)。
2.2 山羊RPL26基因序列分析
2.2.1 山羊RPL26氨基酸特性分析 通过Expaxy在线分析工具分析发现该基因编码145个氨基酸,其中赖氨酸(Lys)含量最高,占16.6%(图2A)。正电荷残基数量15个小于负电荷残基数量40个;不稳定系数为48.52;脂肪性指数为72.41;亲水性总平均值为-1.107(图2B),推测该蛋白质为带负电的不稳定亲水性蛋白质。利用SignaIP4.1 server对信号肽进行预测发现无信号肽。磷酸化位点预测发现,包含7个丝氨酸磷酸化位点,一个苏氨酸磷酸化位点和一个酪氨酸磷酸化位点;糖基化位点预测发现6个O糖基化位点和一个潜在的N糖基化位点。对山羊RPL26蛋白质的跨膜结构区域预测发现(图2C),RPL26蛋白质不具备跨膜结构。RPL26蛋白质在细胞内的定位分析发现该蛋白质有60.9%被预测在细胞核里,在细胞质里有17.4%,在细胞骨架上有13.0%,而在线粒体和分泌系统的囊泡里均为4.3%(图2D)。
2.2.2 山羊RPL26蛋白结构预测 通过NPS@SOPMA对山羊RPL26蛋白的二级结构进行预测(图3A),该蛋白的无规则卷曲比例最大,为39.11%,α-螺旋占31.28%,延伸链占21.79%,β-折叠占7.82%。通过SWISS-MODEL预测的山羊RPL26的三级结构结果(图3B)印证了二级结构的预测结果。
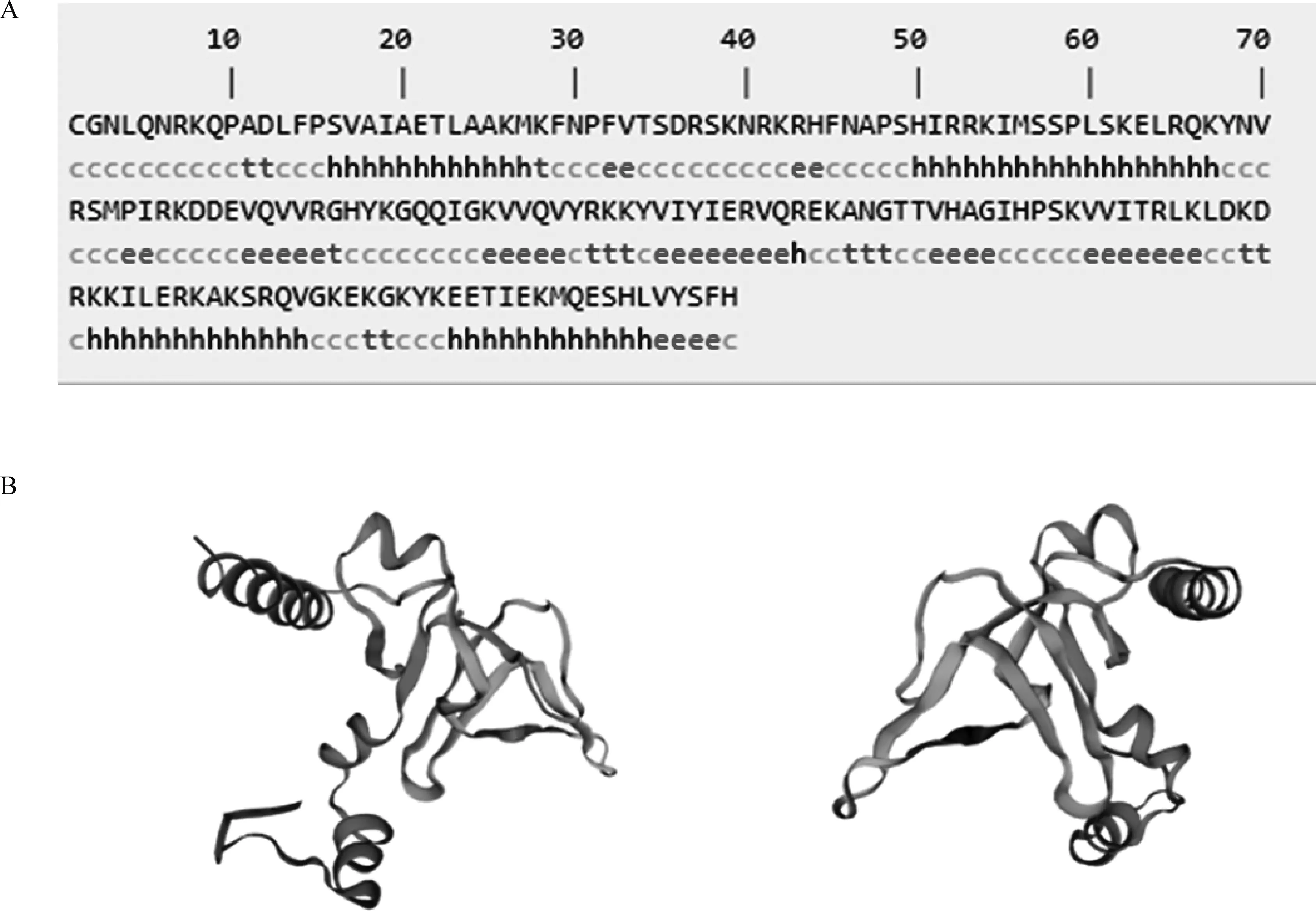
A.RPL26蛋白质二级结构预测(H代表α-螺旋;t代表β-转角;c代表无规则卷曲;e代表延伸链);B.山羊RPL26蛋白质三级结构预测
2.2.3 山羊RPL26蛋白质相互作用预测 通过STRING数据库预测山羊RPL26的蛋白质相互作用关系,显示RPL26主要与RPL家族成员相互作用,包括RPL5、RPL7、RPL14、RPL27、RPL30、RPL34、RPL37和RPL37A(图4)。

图4 RPL26蛋白质功能互作图
2.2.4 山羊RPL26的同源性比对及系统进化树分析 山羊RPL26氨基酸序列在NCBI 进行BLAST结果显示(图5A),其与野牦牛(XP_014333435.1)、白尾鹿(XP_020724730.1)、弯角大羚羊(XP_040099330.1)、虎鲸(XP_004266909.2)、人类(AAA60279.1)、倭狐猴(XP_012630788.2)、短嘴鸦(XP_008627221.2)、鼠兔(XP_004594815.1)、田鼠(XP_005356535.1)、狗(XP_038288783.1)、大灵猫(XP_028627957.1)、双峰驼(XP_010964263.1)、单峰骆驼(KAB1266413.1)、倭黑猩猩(XP_003828880.2)、矛尾鱼(XP_006000768.1)的相似性皆大于95%,由此可见,RPL26基因在各物种之间保守性较高。根据山羊RPL26氨基酸序列,利用MEGA7.0绘制系统进化树(图5B)显示,与山羊进化关系最近的是大羚羊和绵羊,符合反刍动物归类的规律;其次是水牛,关系最远的则是虎鲸。

A.山羊与其它物种之间的RPL26氨基酸序列同源性数据;B.RPL26氨基酸系统进化树
2.3 山羊RPL26基因组织表达差异性分析
对山羊不同组织中RPL26的mRNA表达水平进行相对定量分析作图(图6),山羊RPL26在各组织中均有表达,且表达水平不同。腹部皮下脂肪的表达水平最高,背部皮下脂肪略低于腹部皮下脂肪表达水平且不显著,腹部皮下脂肪和背部皮下脂肪极显著高于背最长肌等9种组织(P<0.01),臂三头肌、肺和肾的表达水平极显著低于背最长肌,股二头肌、心、肝(P<0.01)。

1.腹部皮下脂肪;2.背部皮下脂肪;3.背最长肌;4.股二头肌;5.心;6.肝;7.小肠;8.脾;9.臂三头肌;10.肺;11.肾
2.4 过表达RPL26促进山羊肌内脂肪细胞分化
过表达载体测序结果与山羊RPL26序列完全一致,转染后检测RPL26过表达效率约为67.4倍(图7B)。通过油红O染色与Bodipy染色观察过表达RPL26后山羊肌内脂肪细胞成脂情况(图7A),发现过表达山羊RPL26后,肌内脂肪细胞的脂滴明显增多;分别对过表达RPL26后的成脂分化标志基因和脂代谢基因的mRNA表达水平进行检测,结果发现过表达RPL26后,成脂分化标志基因Pref1表达水平极显著降低(P<0.01),C/EBPα、C/EBPβ、PPARγ的表达水平极显著上升(P<0.01),脂代谢基因LPL、AP2和FASN的表达水平极显著上升(P<0.01)。

A.Bodipy染色(400×)、DIPI染色(400×)、Merge(400×)、油红O染色(大图200×,小图400×);B.RPL26过表达效率;C.油红O染色OD值;D.过表达RPL26对成脂标志基因表达的影响;E.过表达RPL26对脂质代谢基因表达的影响
3 讨 论
脂肪组织作为生物体关键组成之一,发挥着供能保暖、分泌激素、减缓机械冲击等多种功能[14-16],同时,脂肪含量很大程度上决定了肉类的风味和嫩度,因此,关注肌内脂肪含量已成为改善肉质的关键,脂肪沉积过程其实质是脂肪细胞分化积聚脂滴的过程,因此,阐明脂肪细胞分化过程中的调控机制是改善肉质的关键环节。核糖体作为合成蛋白质生物合成过程中的关键细胞器,广泛存在于多种细胞中,同时与细胞的增殖和分化过程紧密相关[17-20]。核糖体蛋白是核糖体的关键组成,Warner和Mcintosh[21]认为,核糖体蛋白不仅仅可以通过作为核糖体组成原件发挥作用,还可以通过与非核糖体发生互作,从而调控细胞的生理功能,而这一过程并不会影响到蛋白质的合成。王家麒等[22]研究发现,SCD参与绵羊前体脂肪细胞分化,李霞[10]研究发现的人体RPL9基因编码的蛋白与硬脂酰辅酶A去饱和酶5结合能有效地提高SCD5的活性进而调节脂质代谢,这两者提示RPL26对脂肪沉积可能有着重要调控作用。本试验克隆得到山羊RPL26基因序列544 bp,其中CDS区全长为438 bp,共编码145个氨基酸。RPL26在山羊和羚羊、绵羊具有高度的同源性,与生物进化的规律相对应。除此之外,与其他动物同源性也高,也有研究指出RPL26在酿酒酵母中进化十分保守[23],表明该基因高度保守。山羊RPL26蛋白质预测发现它没有跨膜结构;亚细胞定位结果显示,RPL26多分布在细胞核中,少数分布在细胞质中,该蛋白没有信号肽,推测它不是分泌型蛋白质[24];蛋白质的结构预测发现,主要以无规则卷曲、α-螺旋、延伸链的形式存在,三级结构稳定。磷酸化位点预测发现,该蛋白包含7个丝氨酸磷酸化位点,1个苏氨酸磷酸化位点和1个酪氨酸磷酸化位点;糖基化位点预测发现6个O糖基化位点和1个潜在的N糖基化位点。
山羊RPL26组织表达谱显示,RPL26在各组织广泛表达,其中以腹部皮下脂肪和背部皮下脂肪表达量最高,极显著高于背最长肌等9种组织,臂三头肌、肺和肾的表达水平极显著低于背最长肌,股二头肌、心、肝。曾锦章等[25]在人的正常组织中检测RPL26蛋白表达情况时发现,其在大肠和心中表达量较高,在肌肉、小肠和肝中的表达量低于其他组织。这一研究结果与本研究结果存在相似及不同情况。在NCBI中猪的转录组测序数据(Gene ID: 100627662,)显示,猪RPL26在脾中表达量最高,皮下脂肪次之,小肠中表达量较低。表明RPL26可能存在着物种间的高度保守。
RPL26在山羊腹部皮下脂肪和背部皮下脂肪中显著高表达,提示山羊RPL26可能在脂肪组织中发挥着重要作用,为了明晰其在山羊肌内脂肪细胞分化中是否发挥作用。本试验过表达山羊RPL26后,发现肌内脂肪细胞脂滴明显增多、变大,并且成脂分化标志基因Pref1表达水平极显著下降,C/EBPα、C/EBPβ、PPARγ的表达水平极显著上升,脂代谢基因LPL、AP2和FASN的表达水平极显著上升。Pref1作为前脂肪细胞标志物,在成脂分化前期高表达并抑制脂肪细胞分化,在脂肪分化过程中呈下降趋势[26];PPARγ和C/EBPα作为经典的成脂分化标志基因,在成脂分化过程中起着关键作用[27-29],PPARγ在脂肪细胞分化过程中具有正向调控作用,且参与到机体的能量代谢以及胰岛素抵抗,具有脂肪细胞专一性[30-31],C/EBPα可以与多种脂肪分化相关基因相互作用,从而参与到细胞的增殖、分化和能量代谢等多个生物学进程,是脂肪细胞分化过程中的核心调控因子[32];C/EBPβ作为经典的成脂分化标志基因,可以激活C/EBPα和PPARγ并产生级联反应,快速激活成脂相关基因的表达[28];LPL的表达水平与脂质沉积息息相关[33-34],可以通过水解甘油三酯从而为机体提供游离脂肪酸[35],同时,LPLmRNA表达水平与肌内脂肪含量呈正相关[36]。AP2和FASN分别参与脂肪酸的转运以及甘油三酯水解过程[35,37-39],是脂肪细胞分化过程中的关键转录因子,在3T3-L1前体脂肪细胞中,青蒿琥酯可以通过抑制C/EBPα、AP2、FASN的表达水平及其磷酸化水平,从而抑制脂肪分化[40]。结合成脂分化标志基因和脂代谢基因mRNA表达水平的检测结果和细胞形态学观察结果,表明过表达RPL26促进山羊肌内脂肪细胞的脂质积累。但山羊RPL26调控山羊肌内脂肪细胞分化的分子机制尚需进一步利用转录组测序结合双荧光素酶系统来进行阐明,本实验室正在进行此部分研究。
4 结 论
本试验克隆获得了山羊RPL26基因序列544 bp,CDS区长438 bp,编码145个氨基酸,是一种定位于细胞核、没有跨膜结构和信号肽、亲水性且三级结构较为稳定的酸性蛋白质。山羊RPL26在各个组织中广泛表达,在腹部皮下脂肪表达量最高。过表达山羊RPL26促进肌内脂肪细胞的脂滴聚集,同时伴随着成脂相关标志基因Pref1、C/EBPα、C/EBPβ和PPARγ的表达水平发生相应变化。提示RPL26是山羊肌内脂肪细胞分化的正向调节因子。

