常规MRI 联合扩散峰度成像的影像组学模型对脑胶质瘤分级的预测
尹 娣,陈国丹,盛玉瑞,李继振,曾庆师
(1.山东大学齐鲁医学院,山东 济南 250012;2.空军军医大学唐都医院放射科/陕西省功能与分子影像重点实验室,陕西 西安 710038;3.山东第一医科大学第一附属医院放射科,山东 济南 250014;4.山东大学附属山东省精神卫生中心医学影像科,山东 济南 250014)
脑胶质瘤是成人中枢神经系统最常见的原发性恶性肿瘤,约占脑恶性肿瘤的80%[1],其中胶质母细胞瘤占胶质瘤的55.1%[2],复发率及致死率较高。在2016 年WHO 中枢神经系统肿瘤分类中,胶质瘤按组织病理学分为高级别胶质瘤(high grade glioma,HGG)与低级别胶质瘤(low grade glioma,LGG)[3],级别不同,治疗方式及预后也不同[4-5],因此准确的术前分级对选择治疗方案及评估预后具有重要意义[6]。本研究利用常规MRI 联合扩散峰度成像(diffusion kurtosis imaging,DKI),提取瘤体内反映肿瘤异质性的影像组学特征,通过支持向量机(support vector machine,SVM)算法建立多个预测胶质瘤术前分级的影像组学模型,分析并选取预测效能最高的影像组学模型,为临床提供更客观、准确的胶质瘤分级方法。
1 资料与方法
1.1 一般资料 回顾性分析山东大学齐鲁医院2014 年6 月至2021 年4 月经手术病理证实的51 例脑胶质瘤患者的临床及影像资料,其中LGG 17 例(LGG 组),男13 例,女4 例,平均年龄(41.47±10.27)岁;HGG 34 例(HGG 组),男22 例,女12 例,平均年龄(51.35±10.91)岁。以病理检查为胶质瘤分级的金标准。本研究已通过医院伦理委员会的批准。
1.2 纳入及排除标准
1.2.1 纳入标准 ①为原发性脑胶质瘤;②术后均经病理确诊;③术前均未接受放化疗等治疗。
1.2.2 排除标准 ①图像质量不佳或图像不完整,影响图像后处理;②复发性脑胶质瘤;③合并其他脑部疾病等。
1.3 仪器与方法 采用Siemens 3.0 T 超导型MRI成像仪,头颅8 通道相控线圈进行扫描。所有患者术前均行颅脑常规MRI 及DKI 序列扫描。扫描参数:T1WI TR 1 900 ms,TE 8.5 ms,视野220 mm×220 mm,矩阵256×256,层距1 mm,层厚6 mm;T2WI TR 4 000 ms,TE 93 ms,视野220 mm×220 mm,矩阵256×256,层距1 mm,层厚6 mm;T2FLAIR TR 6 600 ms,TE 94 ms,视野220 mm×220 mm,矩阵256×256,层距1 mm,层厚6 mm;T1WI 增强扫描(CE-T1WI),对比剂使用Gd-DTPA,剂量0.1 mmol/kg体质量。TR 1 900 ms,TE 4.92 ms,视野250 mm×250 mm,矩阵256×256,翻转角25°;DKI,TR 3 000 ms,TE 109 ms,视野256 mm×256 mm,矩阵128×128,层厚4 mm,激励次数2,b 值为0、500、1 000、1 500、2 000、2 500 s/mm2,每个梯度场施加30 个扩散敏感梯度场方向。
1.4 图像分析与后处理
1.4.1 ROI 分割与特征提取 将所有患者术前常规MRI 图像(包括T1WI、T2WI、T2FLAIR 及CE-T1WI)及由DKI 序列后处理得到的平均峰度(mean kurtosis,MK)参数图上传至放射组学云平台(慧影医疗科技有限公司)。以CE-T1WI 序列为参照,由2 名经验丰富的放射科医师对各序列手动勾画ROI,建立感兴趣容积后进行影像组学特征提取。
1.4.2 特征筛选 以胶质瘤病理分级为标签,将51 例患者进行5 折交叉验证分组。首先采用方差阈值法筛选方差>0.8 的特征进行下一步分析。其次通过单变量选择法对所选特征进行单变量分析,选择P<0.05 的特征,剔除其他特征。最后运用最小收缩与选择算子法(least absolute shrinkage and selection operator,LASSO),通过L1 正则化使得相关性较弱的特征系数为零,逐步得到最优特征集。
1.4.3 模型建立与验证 采用SVM 算法建立脑胶质瘤分级预测模型。通过5 折交叉验证的方法对预测模型进行验证,以避免模型过拟合,将纳入样本随机分为大小相等的5 个子集,训练集与测试集样本比例为4∶1,确保每个子集有一次机会作为测试集。绘制ROC 曲线,在约登指数最大时作为最佳截止值,得到预测模型的敏感度及特异度。模型预测效能以AUC 值进行评价,0.5<AUC≤0.7 为模型预测效能较低,0.7<AUC≤0.9 为预测效能中等,AUC>0.9 预测效能较高。在所有组合序列模型中选取最大平均AUC 值对应的模型为最佳预测模型。特征筛选、模型建立与效能评价均在Python3.85 软件中完成。
1.5 统计学分析 采用SPSS 25.0 软件进行统计学分析,计量资料以±s 表示,分类变量以百分比表示,组间比较采用χ2检验,以P<0.05(双尾)为差异有统计学意义。
2 结果
2.1 2 组一般资料比较 LGG 组平均年龄低于HGG 组,差异有统计学意义(P=0.03)。2 组的性别组成差异无统计学意义(P=0.40)。
2.2 不同影像组学模型的预测效能
2.2.1 单一序列影像组学模型的预测效能(表1,2)每个序列分别提取1 409 个影像组学特征。采用5 折交叉验证,分别进行特征筛选、模型建立与验证。从MK 序列筛选的特征建模在测试集中的预测效能最高,AUC 值为0.864,敏感度为0.800、特异度为0.857、约登指数为0.657(图1a)。有15 个特征在5 次交叉验证中出现3 次以上。
2.2.2 组合序列影像组学模型的预测效能(表1,2)将T1WI、T2WI、T2FLAIR、CE-T1WI 及MK序列分别进行组合,生成26 种组合序列模型。对所有组合序列模型采用5 折交叉验证,分别进行特征筛选、模型建立与验证。由T1WI+T2FLAIR+CE-T1WI+MK 构成的组合序列模型在测试集中的预测效能最高,AUC值为0.995,敏感度为0.867,特异度为0.905,约登指数为0.772(图1b)。有13 个特征在5 次交叉验证中出现3 次以上。

图1 平均峰度(MK)序列及最优组合模型的ROC 曲线 图1a MK 序列构建的脑胶质瘤分级预测模型测试集的ROC 曲线 图1b 组合模型(T1WI+T2 FLAIR+CE-T1WI+MK)构建的脑胶质瘤分级预测模型测试集的ROC 曲线。在每个图中,5 条彩色实线曲线分别代表了5 折交叉验证中各折的ROC 曲线,蓝色虚线为均值ROC 曲线
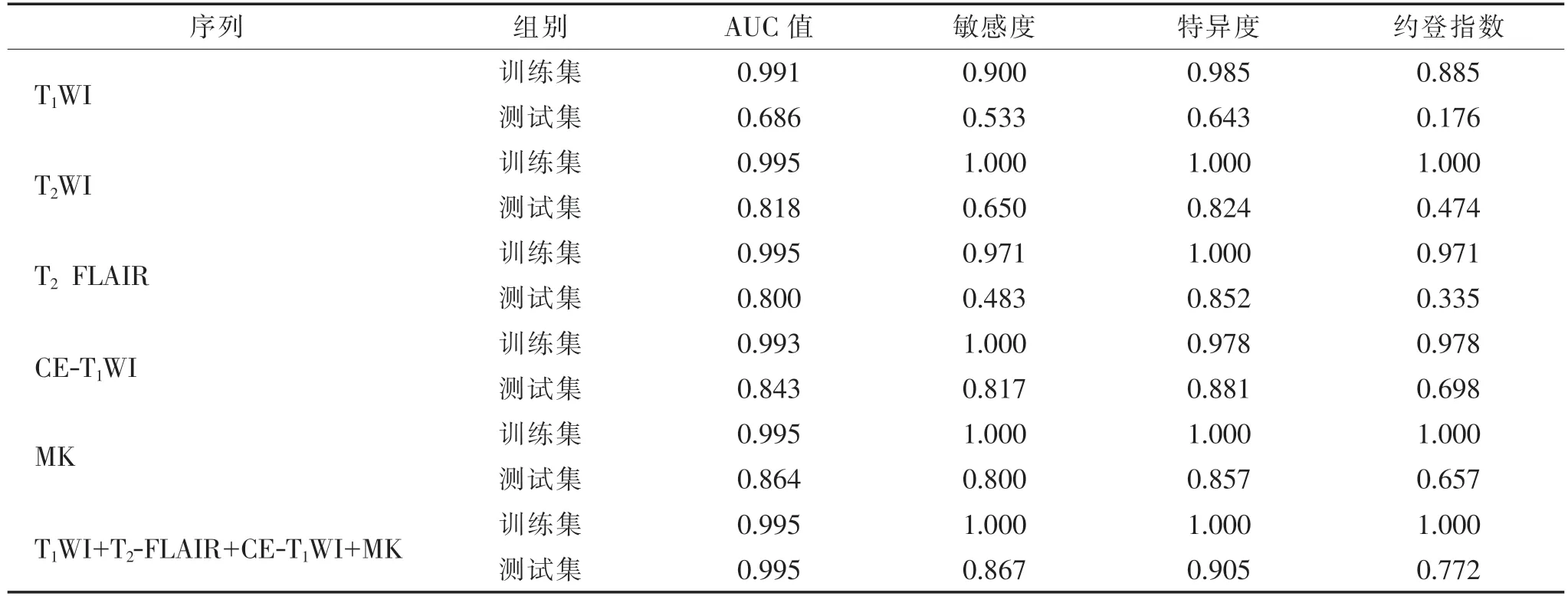
表1 不同预测模型在训练集、测试集中的性能
3 讨论
组织病理学检查是确定脑胶质瘤级别的金标准,但由于病理标本取样误差及观察者间主观性差异[7],其误诊率高达23%[8]。影像组学作为一种新兴的非侵入性诊断方法,基于医学图像中高维定量特征的提取,可提供视觉观察难以获取的病理生理信息[9]。目前已有大量临床研究将影像组学与常规MRI结合,用于脑胶质瘤的病理分级诊断[10-14]。

表2 MK 序列及最优组合模型影像组学特征筛选结果
既往脑胶质瘤的研究及临床诊断多基于T1WI、T2WI、T2-FLAIR 及CE-T1WI 等常规MRI 序列,以上序列可直观呈现病变的解剖结构、占位效应及血-脑脊液屏障破坏程度等。然而高低级别胶质瘤在常规MRI 序列往往有较多重叠征象,传统影像诊断模式对两者的鉴别诊断能力无法满足临床需求[15-18]。常规MRI 序列诊断脑胶质瘤准确率仅55%~83%[19]。Hsieh等[18]利用CE-T1WI 图像提取的全局和局部图像特征集,建立Logistic 回归分类器对肿瘤进行分级,结果显示模型的准确度高达93%,高于基于传统纹理特征预测模型的准确率(84%)。周晶等[20]提取DWI 图像特征,联合影像组学标签特征与病理结果构建评估脑胶质瘤高、低级别的预测模型,并采用诺模图反应测试模型,结果显示影像组学模型能较好地预测脑胶质瘤级别,且高于未利用影像组学的决策曲线。Wang 等[21]分别构建了基于SVM 算法的影像组学模型、基于临床资料和形态学特征构建的常规影像诊断模型,以及两者的联合模型,预测胶质瘤IDH1突变状态,结果显示基于SVM 算法的影像组学诊断模型(AUC=0.880)的预测效能高于常规诊断模型(AUC=0.842),提示影像组学可改善传统的胶质瘤诊断模式。
本研究在常规MRI 序列的基础上,引入功能序列DKI 的MK 参数,并与影像组学结合,从MK 序列图中提取了1 409 个影像组学特征,使用LASSO 算法筛选得到最优特征集,其中15 个特征在5 折交叉验证中出现3 次及以上,利用SVM 方法建立脑胶质瘤预测模型,得到的测试集中AUC 值为0.864,优于T1WI、T2WI、T2-FLAIR 及CE-T1WI。DKI 是DTI 的延伸,可反映肿瘤内水分子的非高斯扩散[22-24]。文献研究显示,MK 值的大小与组织微结构复杂程度相关,结构越复杂,MK 值越大[25-26]。HGG 胶质瘤细胞数量增多,细胞核异型性增强,血管增生和坏死增多,微环境比LGG 复杂,因而异质性增高,本研究结果显示MK 值可有效预测脑胶质瘤分级,这与Jiang等[23,27-28]结论一致。
相较于单一序列影像组学研究,本研究联合多序列建模,通过比较最大平均AUC 值筛选出最好的组合模型,将5 个序列所提取的所有影像组学特征进行5 折交叉验证,经LASSO 算法降维筛选出最优特征集,结果显示最优组合模型由T1WI+T2-FLAIR+CE-T1WI+MK 序列组成,在测试集得到AUC 值为0.995,敏感度0.867,特异度0.905,明显高于单一序列模型,提示联合多序列建模提取的影像组学特征能更全面反映肿瘤的异质性信息,可弥补不同序列的图像信息。笔者在筛选特征时,统计了单一序列模型及最优组合模型在5 折交叉验证中出现3 次及以上的特征,筛选出的组学特征由一阶统计量特征与纹理特征组成,其中90%以上为纹理特征,提示纹理特征更能反映胶质瘤内部异质性和病理生理方面的信息[29-30]。梅东东等[31]提取脑胶质瘤ADC 图的多阶纹理特征,使用Logistic 回归分析证实,区域熵与胶质瘤分级相关性最高,强调了纹理特征鉴别HGG 与LGG 脑胶质瘤的重要性。本研究对筛选的纹理特征进一步划分,发现灰度级形状矩阵(gray level size zone matrix,GLSZM)特征占比最大。GLSZM 特征是纹理特征的高级统计矩阵,通过量化病灶的复杂性及纹理粗细程度评估异质性,其值越大,表示异质性越高。Bogowicz 等[32]利用从CT 及PET 提取的放射组学特征建立头颈部鳞状细胞癌局部肿瘤控制的预测模型,结果发现CT 的GLSZM 特征增加时,肿瘤预后较差,提示GLSZM 特征可能包含细胞增殖及微血管密度等异质性信息。本研究虽未具体对纹理特征与胶质瘤级别的差异性进行统计学分析,但结果显示纹理特征尤其是GLSZM 特征对预测脑胶质瘤分级贡献了较高的价值。
本研究尚存在的局限性:纳入样本量较小,且均来自单一机构,研究的普适性不足,未来需进行多中心研究;ROI 均为手动标记,可能导致不同操作者间及不同序列间的主观性差异,未来有望开发自动或半自动ROI 划分,提高其勾画及特征提取的一致性。
综上所述,利用多参数MRI 序列提取大量影像组学特征,建立机器学习模型,提供了一种较传统影像学方法更为全面、客观的脑胶质瘤预测模型。
致谢本文所纳入的病例资料来自山东大学齐鲁医院放射科。特此感谢!

