超声结合WES对Treacher Collins综合征胎儿的产前诊断
李荣 林晓莹 吴晓昀 黄呈 毛邱娴 魏佳雪*
(1.广东省第二人民医院 产前诊断中心,广东 广州 510317;2. 广东省第二人民医院 检验医学部,广东 广州 510317)
Treacher Collins综合征(Treacher Collins syndrome,TCS;OMIM#154500)又称之为下颌面骨发育不全(mandibulo facial dysostosis,MFD),主要是颅面发育障碍[1,2]。这些特征包括颧骨发育不全、下睑裂、耳廓畸形、下颌骨发育不全、巨裂、具有特殊的“鱼样面”面容,发病率比较低,为1/50 000左右[3],该病约40%有家族史,而有60%的为散发病例[4]。TCS具有遗传异质,OMIM数据库将该病分为1~4型,大多数TCS患者(占78%~93%)是由TCOF1基因突变引起的TCS-1(OMIM#154500),与常染色体显性遗传性单倍体功能不全相关。由POLR1D基因突变引起的TCS-2(OMIM 613717)既可以是常染色体显性遗传,也可以是隐性遗传。由POLR1C基因突变引起的TCS被归类为TCS-3(OMIM#248390),该类型为常染色体隐性遗传[5-7]。而在最近的一项研究中,POLR1B被发现是一种新的致病基因,与一种新型的TCS-4(OMIM#618939)有关[8]。TCOF1基因所编码的核仁磷酸化蛋白Treacle在TCS发生中发挥着不可或缺的作用。Treacle蛋白致病机制主要在于,TCOF1基因突变使其截短,从而引起蛋白功能丧失。研究发现,下调Treacle表达将抑制核糖体DNA基因转录,在神经嵴融合时不能产生足够的核糖体RNA,从而引发的神经外胚层和神经嵴细胞增殖降低是畸形发生的直接原因[9,10]。本文对1例产前超声提示小下颌合并外耳异常胎儿实行产前基因检测,以明确其致病机理。
1 对象与方法
1.1 对象 孕妇,29岁,孕13周首诊。G1P0,平素月经规律,自然受孕。否认不良接触及近亲结婚和家族遗传病史。孕13周超声检查显示: 胎儿如孕13周,颈项透明层厚度 (nuchal translucecy,NT)1.8mm,胎儿颜面部正中矢状切面显示异常,小下颌畸形待排,如图1A。孕18周Ⅲ级产前超声检查显示:胎儿颜面部正中矢状切面显示下唇及颏形成的曲线失常,颏稍后,下唇后移,下唇较上唇位置稍后,面下部角(inferior facial angle,IFA)41°,双侧外耳形态异常,位置可疑偏低,考虑小下颌畸形,如图1B、C。
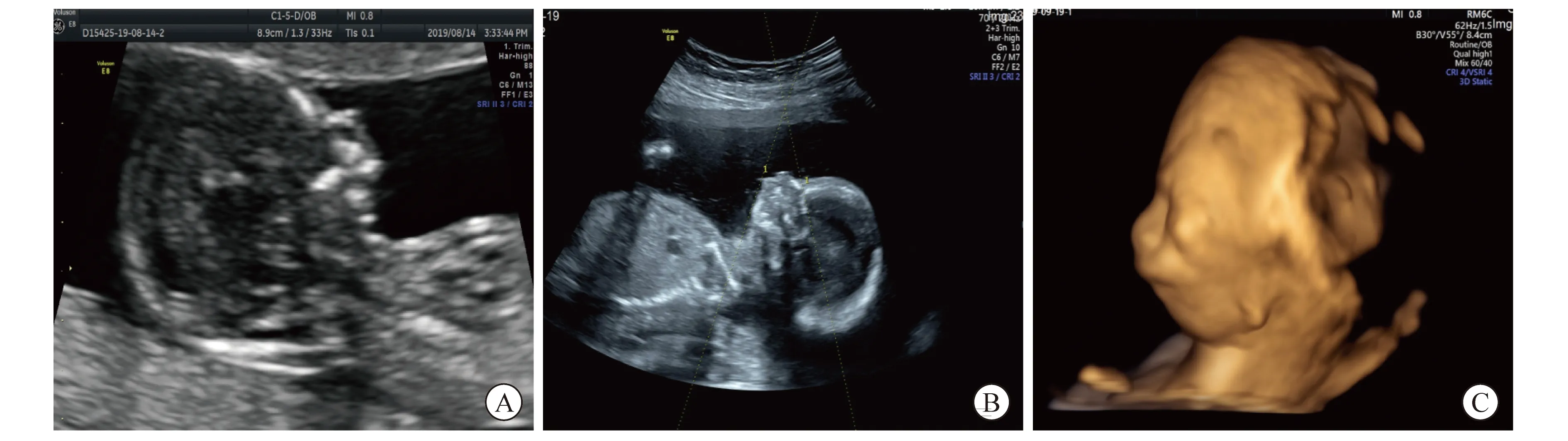
图1 病例超声图像
1.2 方法
1.2.1 多重定量荧光PCR(quantitative fluorescence PCR,QF-PCR)快速诊断 采用Devyser 13、18、21-三体和性染色体非整倍体检测试剂盒,通过荧光PCR毛细管电泳法进行分析。在提取羊水细胞基因组DNA并纯化后,采用试剂盒对DNA模板进行多重荧光PCR扩增,取扩增产物1μl加入甲酰胺9μl与内标GeneScan Rox-500 Size standard(ABI)0.2μl,将待测96孔板放入ABI3500遗传分析仪上进行片段分析,Genemapper 4.1系统进行定量分析。
1.2.2 染色体G显带核型分析 羊水细胞培养7d后进行传代培养,2d后视细胞生长状况进行收获以及染色体制备,在显微镜下计数20个核型,分析5个核型。染色体核型描述按照人类细胞遗传学命名国际体系(ISCN2016)。
1.2.3 染色体微阵列分析(chromosome microarray analysis,CMA) 采用QIAamp DNA Blood Mini Kid(德国QIAGEN公司)提取基因组DNA并测定其浓度和纯度,再通过限制性内切酶消化、加接头、PCR扩增、片段化、生物素标记来构建芯片文库。利用美国Affymetrix公司的CytoScanTM 750K芯片与生物素标记好的基因组DNA进行杂交检测羊水细胞全基因组不平衡现象,结果采用Chromosome Analysis Suits(ChAs)软件进行分析。
1.2.4 全外显子测序(whole exon sequencing,WES)
1.2.4.1 文库构建与测序 使用安捷伦(Agilent)的SureSelectHuman All Exon 50Mb平台制备检测样本,包括DNA片段化、末端修复、加接头、PCR扩增、探针杂交、磁珠捕获富集等步骤。构建文库使用安捷伦(Agilent)2200分析仪质控分析合格后采用illumina 550完成高通量测序。
1.2.4.2 生物信息学分析 利用FastQC软件对原始数据进行质控分析;利用BWA软件(v0.7.15-r1140)将所有过滤后的测序序列(reads)比对到参考基因组(GRCh37/hg19);利用Picard软件工具去除重复reads;利用GATK软件工具包(v3.7-0)完成单碱基变异和插入缺失变异的检出;利用Annovar及VEP等软件包进行注释。
1.2.4.3 致病性变异过滤与筛选 结合人群dbSNP数据库(SNP150)、千人基因组数据库等信息,去除最小等位基因频率(minor allele frequency,MAF)>0.01 (常染色体显性遗传病)或MAF>0.05(常染色体隐性遗传病)的高频变异。参考2020年广东省精准医学应用学会团体标准发布的《产前外显子测序遗传咨询和报告规范》,结合结合疾病基因变异数据库(Clinvar、HGMD数据库、OMIM数据库)信息、文献报道、功能试验、遗传模式、基因型-表型关联分析等综合判断,按照《ACMG遗传变异分类标准与指南》将变异分成致病、可能致病、意义不明确、可能良性、良性5类;并筛选出与先证者表型相关的可疑致病性变异进行sanger测序验证等进一步分析。
1.2.4.4 sanger测序验证及家系共分离分析 通过以上方法筛选出的可疑致病基因变异,利用Primer5软件设计引物进行PCR扩增及Sanger测序验证。利用chromas软件对测序数据分析。胎儿及父母家系DNA样本测序结果进行家系共分离分析。
2 结果
2.1 QF-PCR结果分析 未见21号、18号、13号及性染色体数目异常,STR位点分析提示未见母体DNA污染。
2.2 染色体G显带核型分析及CMA分析结果 胎儿羊水染色体分析结果为46,XN,未发现核型异常。经CytoScanTM 750K芯片扫描及数据分析结果为[hg19](1-22)×2,(XN)×1,未发现致病性拷贝数变异、杂合性缺失及单亲二倍体。
2.3 全外显子测序结果分析 一家三口全外显子测序(trio-whole exome sequencing,Trio-WES)检出胎儿携带TCOF1 基因NM_001135243.1: exon8: c.928_931del:p.T310fs 杂合致病变异,对于该个体亲本样本中该区域的全外显子测序分析未检测到该变异,该变异在胎儿中为新发变异。本例胎儿TCOF1基因第8外显子c.928-931del(p.T310fs)缺失突变尚未见文献报道,胎儿、母亲及父亲Sanger验证测序图见图2。
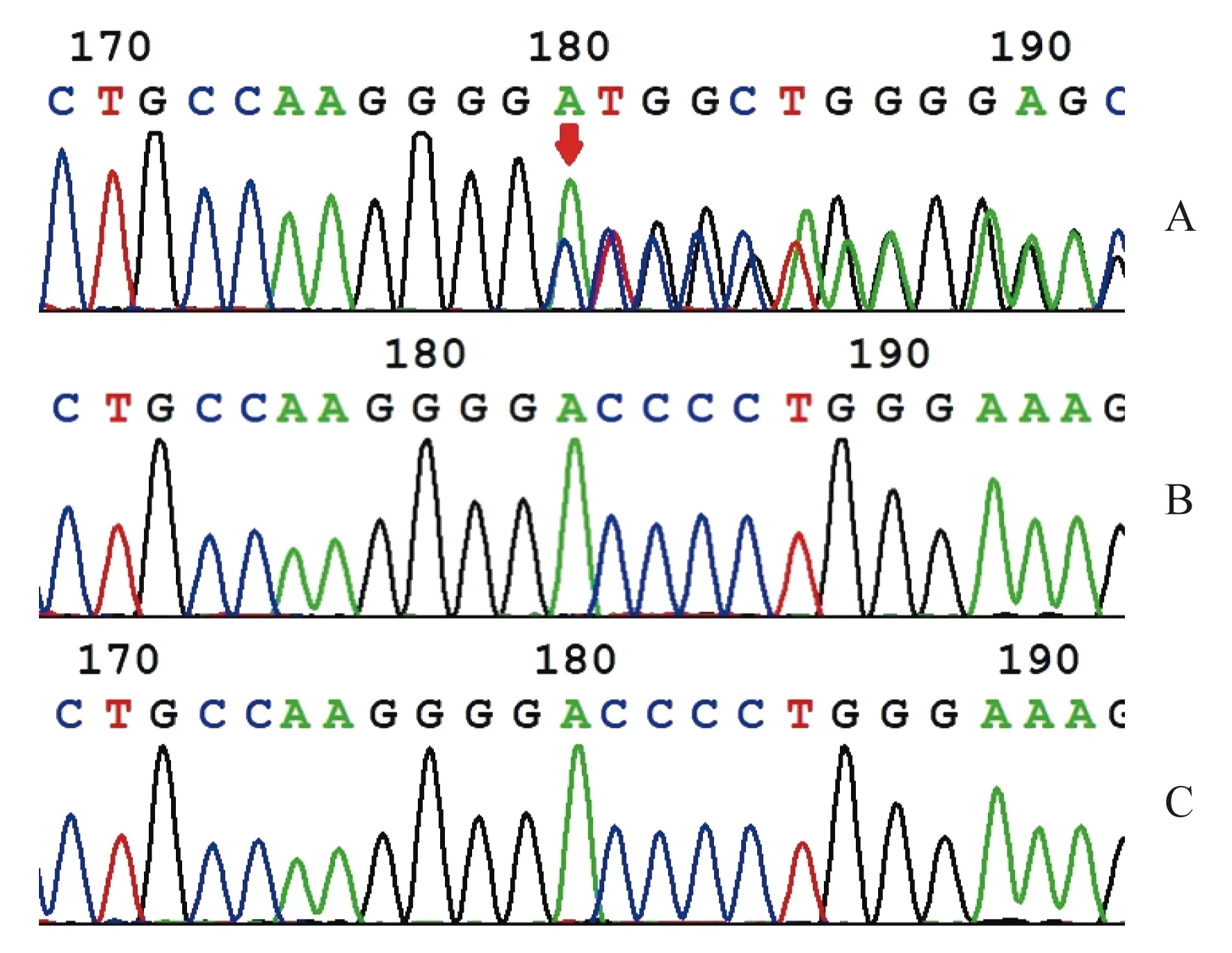
图2 TCOF1基因变异Sanger测序验证图
2.4 胎儿妊娠结局随访 产前遗传咨询后,孕妇选择终止妊娠,胎儿引产见图3。可见典型的小下颌、外耳畸形等Treacher Collins综合征症状。
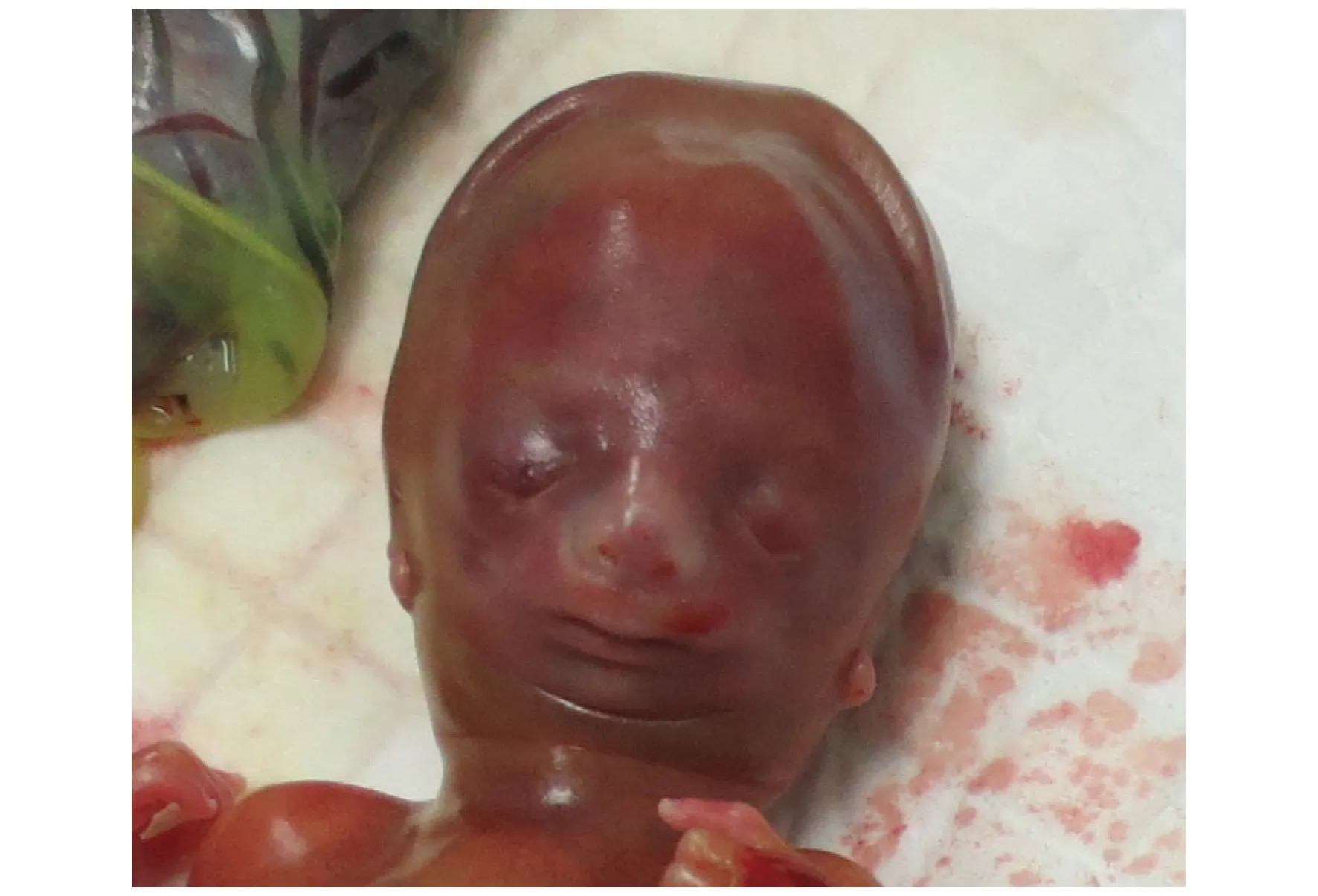
图3 胎儿引产后表型
3 讨论
TCS是一种以常染色体显性遗传为主的先天性脸颊骨及下颔骨发育不全疾病。TCOF1基因作为TCS主要致病基因(78%~93%),现已发现超过300种突变,它们既可自发产生,也可由遗传获得,没有明显的性别差异。TCS畸形与其他颅面部疾病不同,除一些软组织和骨骼外通常是双侧对称发病,累及部位自上而下主要包括眼及眶周、耳、颧骨颧弓和上下颌骨等,大脑、肾脏和四肢畸形很少见。颧骨复合体(81%)和上下颌骨(78%)发育畸形是TCS最明显的特征[11]。Vincent等[12]将TCS1患者的临床特征与文献报道的患者进行了比较。在70例患者中,眼睑裂向下倾斜(100%)、颧骨发育不良(99%)、传导性耳聋(91%)、下颌发育不良(87%)、外耳道闭锁(72%)、小耳(71%)、下睑缺损(65%)、不对称(53%)、头发向侧颊突出(48%)、腭裂(22%)、后鼻孔狭窄/闭锁(14%)、心脏畸形(12%)。可见该疾病的外显率比较高但表型差异很大,表型较轻者几乎未显现明显的临床特征,而表型较重者可因鼻后孔闭锁、舌后坠等原因导致通气障碍而死亡[13],这些因素给TCS患者,特别是产前胎儿的明确临床诊断和遗传咨询带来了困难。目前,产前TCS可以通过常规的二维超声或更精细的三维扫描来检测;但对于轻到中度的TCS,尤其是散发性TCS,很少有效[14]。因此,识别受累胎儿的致病基因对准确预防TCS具有重要意义。本文胎儿在孕早期13周超声检查即出现了疑似小下颌待排,继续超声监测在18周发现明显小下颌畸形、外耳形态异常、耳低位等面部发育不良。通过全外显子测序,发现胎儿TCOF1 基因第8外显子存在c.928-931del(ACCC)(p.T310fs)杂合突变,依据美国医学遗传学会(American College of Medical Genetics,ACMG)遗传变异分类标准与指南[15],致病变异标准可分为非常强(very strong,PVS1)、强(strong,PS1-4)、中等(moderate,PM1-6)、或辅助证据(supporting,PP1-5)。良性变异证据可分为独立(stand-alone,BA1)、强(strong,BS1-4)、或辅助证据(BP1-6)。其中,数字只是作为有助于参考的分类标注,不具有任何意义。每个类别中的数字不表示分类的任何差异,仅用来标记以帮助指代不同的规则。本例胎儿TCOF1 基因c.928-931del(ACCC)(p.T310fs)证据项为PVS1+PM2+PP4,判断该变异为致病变异,证据为,PVS1:当一个疾病的致病机制为丧失功能(loss of function, LoF)时,无功能变异(无义突变、移码突变、经典±1 或 2 的剪接突变、起始密码子变异、单个或多个外显子缺失)。PM2:ESP 数据库、千人数据库、EXAC 数据库中正常对照人群中未发现的变异(或隐性遗传病中极低频位点);人群频率:ESP6500:-,千人:-,EXAC:-,GnomAD:-。PP4:变异携带者的表型或家族史高度符合某种单基因遗传疾病。本文胎儿采用Sanger测序进行验证结果与WES一致,该突变使得终止密码子提前出现,可能会导致Treacle蛋白截短而丧失功能,这与单倍性不足的机制是一致的符合证据项PVS1;胎儿父母在该区域的全外显子测序分析未检测到该变异,该变异在胎儿中为新发变异,且该突变类型尚未见文献报道,符合证据项PM2;胎儿表型与TCS表型高度符合,判定为PP4证据项,综合上述证据项诊断本例胎儿TCOF1 基因c.928-931del(ACCC)(p.T310fs)变异是导致TCS的致病性变异。该TCS患儿的产前诊断为该家系的遗传咨询提供了重要信息。
目前为止,根据人类基因突变数据库(The Human Gene Mutation Database,HGMD)的数据,在TCS患者中已经报道了300多种不同的TCOF1基因突变。目前已发现的突变种类包括框移突变、剪切突变、无义突变和缺失突变等,多数突变都引入了一个终止密码子的过早插入。最常见的TCOF1基因变异是小缺失(60%)和重复(25%)导致的移码突变[16]。国外报道认为TCOF1基因的5个外显子(10、15、16、23和24)是TCOF1基因突变的热点区域(50%)[17],但其他外显子的致病变异均有报道。目前产前基因诊断TCS的报道极少,中国人产前TCS基因诊断目前仅报道1例胎儿为新的TCOF1基因第2~6外显子的大缺失,来源于胎儿父亲,胎儿父亲表现出明显的斜眼睑裂隙、眼睑缺损、颧弓发育不良,属于家系遗传[18]。而本文胎儿父母表型均无异常,仅依靠超声图像不能做出诊断,需要通过WES分析从分子水平明确胎儿的致病机制。
目前治疗TCS的首选方法仍是以改善患者外貌、提高患者生存质量的外科手术方法为主。但多学科的共同参与、有序的治疗时间安排和完善的术前设计才是手术成功的保障。除手术治疗外,p53基因治疗和抗氧化剂治疗也逐渐成为研究热点,具体应用于临床还需要更为完善的研究支持[19]。相较于手术治疗给社会和家庭带来的巨大经济负担以及在此期间疾病给患者造成的巨大心理伤害,TCS产前预防和筛查非常重要。在本文病例中,与其他具有不同突变的患者相比,我们并没有发现特殊的表型。仅靠超声筛查对TCS胎儿做出明确诊断仍具有挑战性。分子诊断在TCS患者产前和产后阶段发挥着重要作用,对遗传咨询的发展有着不可否认的影响。本文结合三维超声和全外显子组测序,成功地检测了TCS胎儿。在该家系中发现了一个新的TCOF1基因第8外显子c.928-931del(ACCC)缺失突变,扩大了HGMD数据库TCOF1基因的突变谱。本研究还表明,面对类似的产前颅面畸形病例,分子遗传学检测有助于明确诊断,指导产前诊断后续的遗传咨询。

