儿童异基因造血干细胞移植后细胞免疫重建的临床研究
宋 娜 孙 鸣 祁闪闪 王 卓 杨 李 卢文婕 吴 旻 夏 维 陈 燕 熊 昊
华中科技大学同济医学院附属武汉儿童医院血液肿瘤科(湖北武汉 430016)
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是目前治疗儿童恶性/难治性血液病、先天性遗传代谢性/免疫性疾病及某些实体瘤的有效方法,已在临床广泛应用。受者移植后早期免疫重建的缺失或延迟与移植后感染、复发以及移植物抗宿主病(graft versus host disease,GVHD)密切相关[1-2]。但目前国内对儿童allo-HSCT后免疫功能的监测报道甚少。本研究拟通过动态监测患儿接受allo-HSCT后第0、14、21、28、60及100 d淋巴细胞亚群水平,以了解儿童移植后早期免疫重建的规律,以及与急性移植物抗宿主病(aGVHD)发生的可能相关性,从而降低移植相关并发症的发生,进一步提高接受allo-HSCT患儿的生存质量。
1 对象与方法
1.1 研究对象
选择2019 年7 月至2020 年10 月在武汉儿童医院血液肿瘤科接受allo-HSCT 的患儿作为研究对象。纳入标准:①年龄6 个月~14 岁;②移植后满100 d;③临床资料完整;④接受移植的临床指征均符合国家卫建委临床疾病治疗指南[3],包括各种恶性血液病、重型再生障碍性贫血、β 地中海贫血、遗传代谢性疾病(黏多糖贮积症、异染性脑白质营养不良等)、免疫缺陷病(Wiskott-Aldrich 综合征、X-连锁高免疫球蛋白血症等)、难治的噬血细胞综合征等。排除标准:移植的临床指征不符合治疗指南。
根据患儿移植后是否发生aGVHD 分为nonaGVHD组(26例)和aGVHD组(16例)。
患儿接受移植前均由其家长或法定监护人充分知情并签署知情同意书。
1.2 方法
1.2.1 预处理方案 非恶性血液病[再生障碍性贫血(AA)13例,β-地中海贫血2例,Wiskott-Aldrich综合征(WAS)2例,范可尼贫血(Faconi)1例,黏多糖贮积症1 例,噬血细胞综合征(HLH)1 例,X-连锁高免疫球蛋白血症1 例,异染性脑白质营养不良(MLD)1 例]的预处理方案采用经典的白消安/环磷酰胺+抗胸腺细胞球蛋白(Bu/Cy+ATG)方案;恶性血液病[急性髓系白血病(AML)14 例,骨髓增生异常综合征(MDS)3 例,幼年型粒-单白血病(JMML)2 例,急性淋巴细胞白血病(ALL)1 例]采用亲缘单倍型清髓预处理+后置环磷酰胺(PTCy)方案。
1.2.2 GVHD及其预防 aGVHD指发生在移植后100 d以内,主要表现为皮肤、胃肠道和肝脏3个器官的炎性反应。aGVHD 的严重程度分度标准根据移植后非复发相关死亡的影响程度制定,采用皮肤、胃肠道和肝脏急性GVHD分别积分后再形成总的评分,其中临床最常采用改良Glucksberg 标准[4]。非恶性血液病预防aGVHD采用环孢素A(CsA)+霉酚酸酯(MMF)+短程甲氨蝶呤(MTX):移植后+1 d,MTX 15 mg/m2;+3、+6 d,MTX 10 mg/m2。预处理开始使用CsA 1.5 mg/(kg·d)持续静滴20 h,移植前-1 d改为3 mg/(kg·d)持续20 h静滴,血药浓度稳定后,如胃肠道能耐受改为口服。如患儿无GVHD,移植后6个月起逐渐减量,至移植后9~12个月减停。恶性血液病预防aGVHD采用PTCy方案:移植后+3、+4 d使用MTX 50 mg/(kg·d),+5、+6 d使用ATG 1 mg/(kg·d),+5 d使用CSA 3 mg/(kg·d)持续20 h静滴,如病情稳定,行外周血标本DNA 短串联重复序列分析PCR检查(short tandem repeat,STR-PCR),为完全植入则改为口服(口服剂量为静脉剂量的2.5倍),在3~6 个月内逐渐减停。MMF 和CsA 同时开始应用(或+1 d开始给药),移植成功或+30 d停用,30 mg/(kg·d),分2、3次口服。
1.2.3 感染预防 预处理开始至植入前静滴棘白霉素类药物预防真菌感染,植入后或没有侵袭性真菌感染改为氟康唑或者泊沙康唑口服至停用免疫抑制剂。预处理开始至回输前使用更昔洛韦预防巨细胞病毒(CMV)感染10 d,回输后+1 d开始使用阿昔洛韦预防病毒感染至停用免疫抑制剂后1 个月。植入后口服磺胺甲恶唑(SMZ)预防卡氏肺囊虫感染至停用免疫抑制剂后1个月。
1.2.4 供者外周血造血干细胞动员、采集及回输 供者应用粒细胞集落刺激因子(G-CSF)10 μg/(kg·d),皮下注射,连用5 d,d 5接受G-CSF治疗2 h后开始用COM.TEC 血细胞分离机(费森尤斯)进行供者外周血造血干细胞采集,通常采集1次,必要时于d 6再采集1次直到采集单个核细胞数达到预期量为止。采用Bu/Cy方案者单个核细胞数控制在(6~10)×108个/kg,CD34+细胞计数>2×106个/kg;采用PTCy方案者单个核细胞数>10×108个/kg,CD34+细胞计数>10×106个/kg。造血干细胞均经中心静脉回输给患儿。
1.2.5 淋巴细胞亚群检测 检测患儿移植前,移植当天,移植后14、21、28、60及100天外周血淋巴细胞亚群[CD3+T细胞、CD4+T细胞、CD8+T细胞、CD16+CD56+自然杀伤(NK)细胞、CD19+B细胞、CD4+CD25+调节性T细胞(Treg)细胞]的绝对计数。淋巴细胞亚群检测试剂盒(BD MultiTEST IMK Kit)和FACS Canto II型流式细胞仪均购自美国(Becton Dickinson and Company,BD Bioscience)。采集患儿外周静脉血 3~4 mL经乙二胺四乙酸二钾(EDTA -K2)抗凝后备用。取两支绝对计数管,1管用于检测T 细胞,加入CD 3-异硫氰酸荧光素(FITC)、CD 8-藻红蛋白(PE)、CD 4-别藻青蛋白(APC)、CD 45-多甲藻叶绿素蛋白(PerCP)混合抗体10 μL;另1 管用于检测B 细胞及NK 细胞,加入CD 3-FITC、CD16CD56-PE、CD45-PerCP、CD19-APC混合抗体10 μL,再分别对应加入抗凝全血50 μL,震荡3 s左右混匀,室温避光孵育15 min,然后各管分别加入1:10稀释的溶血素450 μL,震荡混匀,室温避光孵育10 min后上机检测。
1.2.6 移植物植入及造血重建判断 造血干细胞移植后粒系植入标准:中性粒细胞计数(ANC)植入连续 3 d ≥ 0.5×109/L的第1 天为植入日期;血小板(PLT)植入标准:血小板脱离输注情况下连续7 d ≥ 20×109/L的第1 天为植入日期。在患儿出仓前行外周血标本DNA STR-PCR 以判断基因型转变及植入成功。
1.3 统计学分析
采用 SPSS 25.0 统计软件进行统计学分析,采用GraphPad Prism 8.0.1棱镜科研绘图工具作图。非正态分布的计量资料以中位数(P25~P75)表示,组间比较采用Wilcoxon或Kruskal-Wallis H秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 移植效果及移植并发症
共75例接受allo-HSCT患儿,其中移植后满100 d,临床资料完整的42例纳入本研究,男20例、女22例,中位年龄5.4(2.8~9.3)岁。
全部患儿移植后均获造血重建,中性粒细胞≥0.5×109/L和血小板≥20×109/L 的中位时间分别为10.0(7.0~16.0)d和13.0(7.0~31.0)d。预处理期间无多器官衰竭、颅内出血、肝静脉闭塞综合征等严重并发症发生。移植后CMV 感染15 例,EB 病毒(EBV)感染7例,肝静脉阻塞5例,出血性膀胱炎6例。
42例患儿中发生aGVHD 16例,男8例、女8例,aGVHD 发生的中位时间为20.0(6.0~36.0)d。初始疾病为急性髓细胞性白血病(AML)7例,JMML 2例,MDS 2例,WAS、Faconi、AA、MLD、HLH各1例。移植方式:亲缘半相合11例、非亲缘5例。预处理方式:PTCY 10例、Bu/Cy+ATG 4例、Bu/Cy 1例、氟达拉滨(Flu)+ATG+CTX 1 例。发病部位及分度:皮肤Ⅰ~Ⅱ度1例、Ⅱ度2例、Ⅱ~Ⅲ度1例、Ⅲ度4例,胃肠道Ⅱ~Ⅲ度1例、Ⅲ度1例,肠道Ⅳ度2例,皮肤、肠道Ⅰ度1例、Ⅲ度1例、Ⅳ度1例,皮肤Ⅱ度、胃肠道Ⅲ度1 例。因Ⅳ度aGVHD(肠道Ⅳ度)死亡1 例,其余随访至2020年10月仍存活。
2.2 移植前后早期淋巴细胞亚群变化
移植前后不同时间点患儿 CD3+T细胞、CD4+T 细胞、CD 8+T 细胞、CD 16+CD 56+NK 细胞、CD19+B细胞、CD4+CD25+Treg细胞水平以及D4+/CD8+比值的差异均有统计学意义(H=99.15~188.10,P<0.05)。
其中CD16+CD56+NK细胞恢复最快,在移植后21 d基本可以达到移植前水平,28 d后超过移植前水平。CD3+T细胞在移植后60 d基本可以达到移植前水平,CD8+T 细胞恢复早于CD4+T 细胞,到移植后60 d已超过移植前水平,而CD4+T 细胞恢复表现出明显延迟,到移植后100 d尚未恢复到移植前水平,与之对应CD4+/CD8+比值到移植后21 d开始持续倒置。CD19+B细胞恢复速度较慢,在移植后100 d接近移植前水平。CD4+CD25+Treg细胞恢复最慢,到移植后100 d尚未达到移植前水平。淋巴细胞亚群变化趋势见图1。
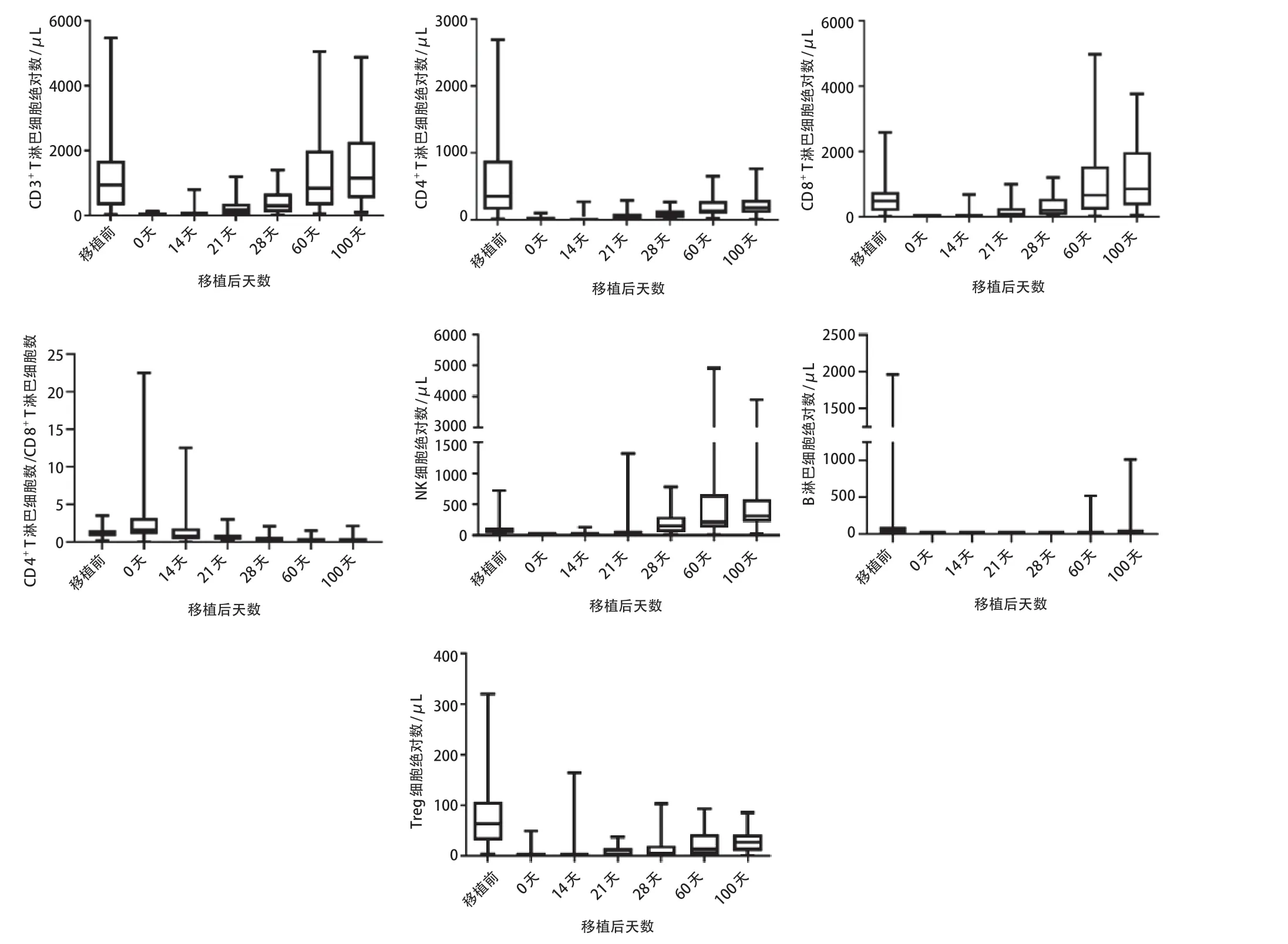
图1 患儿移植后外周血淋巴细胞亚群绝对计数变化
2.3 non-aGVHD 组与aGVHD组淋巴细胞亚群绝对计数比较
移植后28 d 和60 d,aGVHD 组CD 16+D 56+NK细胞绝对计数低于non-aGVHD 组;移植后60 d,aGVHD 组的CD4+CD25+Treg细胞绝对计数低于non-aGVHD 组;移植后100 d,aGVHD 组CD4+T细胞绝对计数低于non-aGVHD 组;差异均有统计学意义(P<0.05)。见表1、2。
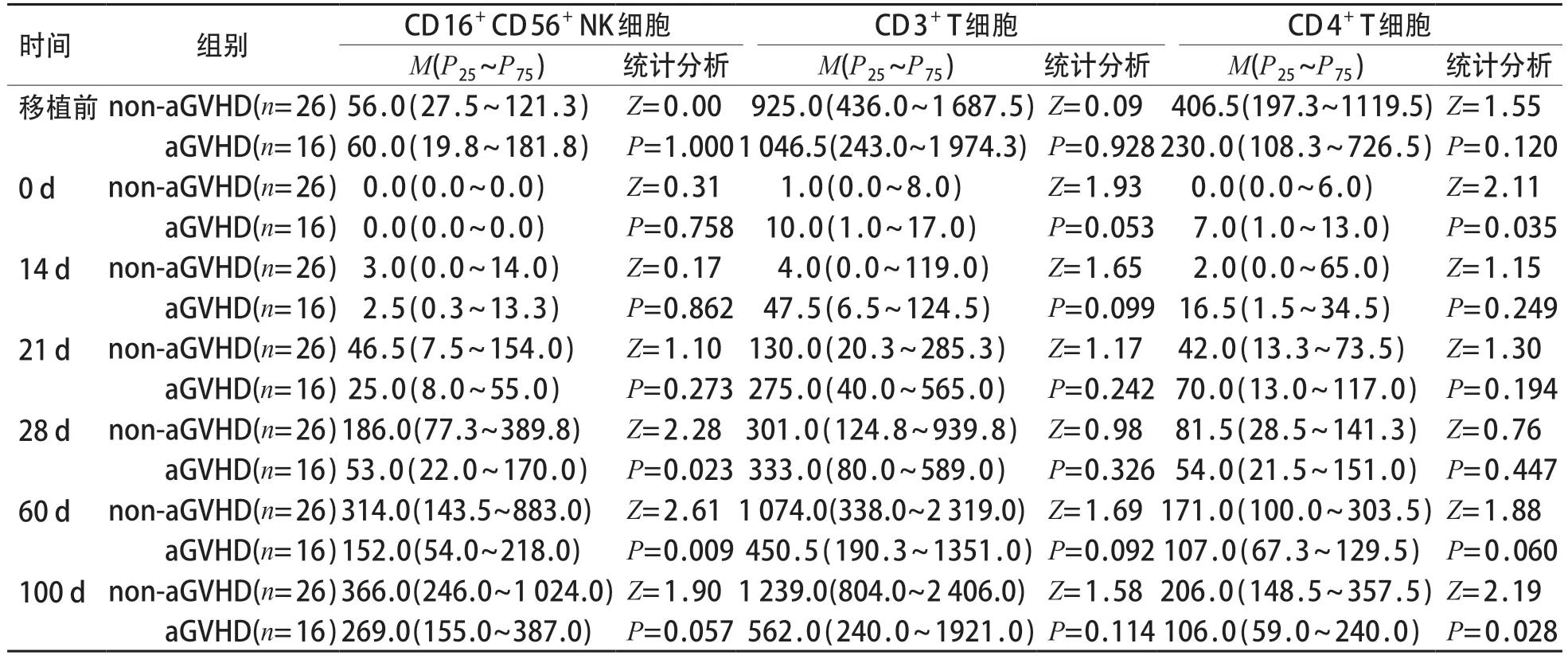
表1 aGVHD 组和non-aGVHD 组移植前后CD16+ CD56+ NK、CD3+T、CD4+T细胞绝对计数比较

表2 aGVHD 组和non-aGVHD 组移植前后CD8+ T、CD19+ B、CD4+CD25+ Treg细胞绝对计数比较 (个/μL)
3 讨论
随着移植技术不断改进,非复发死亡率/移植相关死亡率不断下降,allo-HSCT在儿科已成为治疗复发难治性恶性血液病、先天性免疫缺陷/遗传代谢性疾病的重要方法。虽然移植后中性粒细胞和血小板容易获得成功植入,但是移植后免疫活性细胞的重建迟于造血重建,且过程复杂,受到受者年龄、干细胞来源、移植预处理方案等多重因素的影响[5]。移植后非特异性免疫细胞恢复最早,依次为单核细胞、粒细胞、巨噬细胞、NK细胞[6-7],而特异性免疫细胞,包括T、B 淋巴细胞重建相对滞后,存在发生感染和肿瘤复发的可能性。移植后的免疫重建是患儿长期生存的关键因素,因此对移植后患儿免疫细胞恢复的监测十分必要。
NK细胞属于机体固有免疫系统,具有早期识别并清除病毒感染细胞和肿瘤细胞的功能,同时也是连接固有免疫和适应性免疫的桥梁。本研究中NK细胞是儿童allo-HSCT后最早恢复的细胞,从移植后14 d开始恢复,21 d就可达到移植前水平。这可能与NK 细胞的发育成熟依赖骨髓微环境而不是胸腺有关[8]。NK细胞移植后早期恢复有利于巩固移植物的植入,减少GVHD,并发挥移植物抗白血病(GVL)作用[9]。相关研究发现,接受allo-HSCT的儿童患者中,移植32 d NK细胞数量>120/μL的患儿有较高的3年无病生存率、较低的3年复发率和移植相关死亡率[10]。
本研究中,CD3+T细胞在移植后60 d左右基本可达到移植前水平,其中杀伤性T细胞(CD8+T细胞)恢复早,辅助性T细胞(CD4+T细胞)恢复则显著延迟。而CD4+/CD8+T细胞比值倒置是T细胞重建的最早特征之一[11]。CD8+T细胞早期恢复有利于形成针对如EBV、CMV 等病毒的特异性免疫,减少移植后此类病毒的再激活。因此如果监测到早期CD8+T细胞延迟恢复可能预示移植后感染病毒的风险会大大增加。由于移植前后胸腺损伤,导致移植后很长一段时间CD4+T细胞持续缺乏,这种发生较晚的T细胞重建,由供者来源的淋巴祖细胞或造血干细胞在受者胸腺发育,经历免疫耐受诱导最终形成的T淋巴细胞不仅对受者自身组织耐受(发生GVHD 风险低),而且具有较强的GVL 效应[12],实现持久稳定的细胞免疫重建,所以改善和促进胸腺功能的恢复是加速T淋巴细胞重建的一个重要策略[13]。调节性T细胞(CD4+CD25+Treg细胞)的免疫抑制功能是免疫耐受机制中的重要组成部分,它能抑制各淋巴细胞亚群的增殖以及各种细胞因子的分泌,从而维系自身耐受和免疫应答的平衡稳态[14]。本研究中CD4+CD25+Treg细胞恢复相对较晚,可能与积极使用CD25单抗预防GVHD有关。
在成人,移植后B淋巴细胞的恢复较慢,直到移植后1~2年才会完全重建[15]。B细胞的延迟恢复影响抗体的产生,低水平的免疫球蛋白也是原发性肿瘤复发及并发其他肿瘤的重要因素。因此,移植后应积极补充丙种球蛋白以减少体液免疫的不足,预防相关感染。本研究中B 淋巴细胞的数量在移植后100 d恢复到移植前水平,比成人早,这一结论还需要后续更大的样本量来证明。
aGVHD 是造血干细胞移植后在受者体内植活的供者淋巴细胞对宿主器官发生的以免疫性损伤为主要特征的免疫性疾病,是造血干细胞移植后的严重并发症之一。目前,aGVHD的诊断仍主要依赖临床表现,在临床上有时很难将皮肤和肠道aGVHD与药物性皮疹、炎症性肠病等临床表现与aGVHD相似的疾病区分开,往往需要进行有创性的病理活组织检查以辅助诊断,因此,临床上需要找到能够早期诊断或者预示aGVHD 发生的指标以便及时采取相应的防治措施[16]。
本研究中,aGVHD 组NK 细胞计数低于nonaGVHD组,且从移植后28 d开始两组存在显著差异,提示早期NK细胞延迟恢复可能与aGVHD发生密切相关。有学者监测70例白血病患者在allo-HSCT后淋巴细胞计数情况,发现移植后30 d NK细胞与Ⅱ-Ⅳ度aGVHD 发生率和总生存率有关,低水平NK 细胞预示更高的Ⅱ-Ⅳ度aGVHD发生率和更低的总生存率[17-18]。allo-HSCT过程中供者来源NK细胞与配体结合,在受者体内异源性激活,活化信号占主导时,通过杀伤受者来源的抗原呈递细胞阻断aGVHD 关键性启动环节,从而发挥抗aGVHD作用[19-20]。
目前,对allo-HSCT后免疫重建的研究主要在成人病例,儿童比较少见,特别是国内甚少报道。本研究42例儿童allo-HSCT后淋巴细胞重建顺序依次为CD16+CD56+NK细胞、CD8+T细胞、CD19+B细胞、CD4+T细胞、CD4+CD25+Treg细胞。其中NK细胞重建与aGVHD的发生密切相关,移植后动态监测NK细胞可作为早期诊断或者预示aGVHD发生的实验室指标。对于进一步细化NK细胞预测aGVHD发生的阈值,早期监测到NK细胞低下的患儿;提升NK 细胞计数和活性,是否能有效预防aGVHD 尚需要进一步开展多中心大样本的临床研究。

