炎症环境下线粒体自噬与大鼠骨髓间充质干细胞成骨分化相关性研究*
刘 倩 关淼升 王潇宇 许荣宸 刘 琳 刘 振 李鸿波
炎症环境对骨组织再生修复的介导效应是生物组织工程领域的关键问题[1]。作为生物体对外界创伤、肿瘤侵袭以及免疫排斥等刺激的应答作用,刺激起始阶段损伤部位所形成的低浓度炎症环境能够激发细胞外基质和多细胞因子的聚集,调控损伤附近的间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)向成骨细胞分化,促进骨组织的再生修复[2]。然而,随着炎症反应的加剧和持续,间充质干细胞的活性及成骨分化能力受到抑制,导致骨组织缺损难以自我修复,甚至产生进一步破坏[3]。
线粒体是干细胞成骨分化的能量来源与结构基础。因此,维持间充质干细胞中线粒体结构、数量和功能的稳定是实现干细胞骨向分化的必要条件[4,6]。“线粒体自噬”作为一种控制线粒体质量与数量的主要保护形式,在实现线粒体正常生理功能与生物学行为中发挥重要作用。相关研究发现,线粒体自噬可能是炎症及骨相关疾病的潜在治疗靶点[7、8]。由此我们推测,线粒体自噬能力的改变可能是导致炎症环境下成骨分化抑制的原因,线粒体自噬的能力受炎性环境的影响而减弱,从而导致了过多受损线粒体的积累,进一步抑制了干细胞成骨分化的能力。
因此,本研究通过构建体外高浓度炎症微环境,拟探究炎症环境对线粒体自噬的影响,同时结合BMSCs 成骨分化结果,分析线粒体自噬与BMSCs 成骨分化间的相互作用,为实现精准调控BMSCs 成骨分化能力提供思路。
1.材料与方法
1.1 材料 SPF 级雄性SD 大鼠(2~3 周龄、斯贝福,中国);完全培养基(L-DMEM(gibco)+10%FBS(gibco)+1%penicillin Streptomycin (gibco));成骨诱导培养基(L-DMEM(gibco)+10%FBS(gibco)+50mg/ L L-抗坏死血酸(sigma)+10mmol/ L β-甘油磷酸钠(sigma)+1%penicillin Streptomycin(gibco));成脂诱导培养基(广州赛业);Anti-LC3ABantibody、Anti-SQSTM1/ P62 antibody、Anti-ALP antibody、Anti-OPNantibody、Anti-PINK1antibody、Anti-Parkin antibody 购自Abcam;FITC 抗兔二抗(碧云天);MitoTrackerDeep Red FM(CST);Alexa FluorTM488 Phalloidin (invitrogen);碱性磷酸酶试剂盒(南京建成);CCK8(碧云天);茜素红(sigma);氯化十六烷基吡啶(sigma)。
1.2 SD 大鼠骨髓间充质干细胞分离培养与鉴定 提取2~3 周龄SPF 级雄性SD 大鼠的骨髓间充质干细胞。提取方法:采用颈椎脱臼法处死SD大鼠,75%乙醇溶液浸泡10min 后放置于超净台内,无菌条件下解剖分离大鼠双侧股骨,暴露骨髓。收集骨髓悬液至50ml 离心管中,使用滤网过滤后接种培养。48h 后首次换液,之后每隔两天换一次液。倒置显微镜下观察并记录细胞形态,待其融合度达到80%~90%后,使用0.25%胰酶进行消化,以1∶2 进行传代,传至P3 代进行流式细胞表面标志物鉴定、成骨诱导分化及成脂诱导分化鉴定。
1.3 实验分组 第一部分构建炎症模型,以成骨诱导培养基作为基础培养基,将实验分为对照组和炎症组。连续培养7d,用于后续实验,每次实验重复三次。
1.3.1 第二部分按照1.3 分组成功验证炎症微环境后,以成骨诱导培养基作为基础培养基,将实验分为T 组(TNF-α 100ng/ ml 组)、T+促进剂组(TNF-α 100ng/ ml+Rapamycin 组)与T+抑制剂组(TNF-α 100ng/ ml+3-MA 组)。连续培养7d,用于后续实验,每次实验重复三次。
1.4 大鼠骨髓间充质干细胞在TNF-α 刺激下细胞增殖与成骨分化能力
1.4.1 CCK-8 检测 将P3 代细胞以2×103个/孔的密度接种于96 孔板中,每组设6 个副孔,待细胞贴壁后,每隔2 天换一次液,分别于1、3、5、7d 取出对应96 孔板,每孔加入10μl CCK-8试剂,于培养箱培养2h,使用酶标仪在450nm 波长下检测每孔的吸光度。
1.4.2 ALP 检测 将P3 代细胞以5×104/ ml密度接种于6 孔板中,每隔2 天换一次液,连续培养7d,去上清,每孔加入300μl 裂解液(0.1%TritonX-100),裂解30min 后,收集各组裂解液。通过BCA 法测定蛋白浓度,按照ALP 试剂盒说明,使用酶标仪在520nm 波长下检测各孔吸光度OD 值。
1.4.3 茜素红染色 将P3 代细胞以5×104/ ml密度接种于12 孔板中,每隔2 天换一次液,连续培养14d,去上清,PBS 清洗,4%多聚甲醛固定30min 后,使用1%茜素红溶液进行染色,PBS 冲洗,加入10%氯化十六烷基吡啶,使用酶标仪在562nm 波长下检测各组吸光度OD 值,计算各组钙离子浓度定量分析。
1.5 免疫荧光检测 Mito-tracker 分别与Factin、LC3 共定位情况 将P3 代rBMSCs 以1×104/ ml 密度接种,使用500 nM MitoTrackerDeep Red FM 染色,4%多聚甲醛固定,PBS 洗涤,5%BSA 封闭。F-actin 标记各组取足量Alexa FluorTM488 Phalloidin 工作液覆盖细胞内表面,室温避光染色90min,PBS 洗涤,DAPI 染核,观察。LC3 标记各组使用一抗LC3A/ B(1∶200)4℃孵育过夜。去除一抗,FITC 抗兔二抗室温孵育1小时,PBS 洗涤,即用型DAPI 染核,置于激光共聚焦显微镜下观察。使用Image J 分析。
1.6 炎症微环境下大鼠骨髓间充质干细胞成骨分化与线粒体自噬相关性
1.6.1 RT-PCR 检测成骨相关基因及线粒体自噬相关基因表达 将细胞以5×104/ ml 密度接种于6 孔板中,刺激7d 后,采用Trizol 法收集细胞总RNA,使用First Strand cDNA Synthesis Kit(New England Biolabs)反转录,按照SYBR Select Master Mix(Thermo Fisher Scientific)说明建立RT-PCR 体系,检测成骨相关基因及线粒体自噬相关基因表达情况。通过NCBI 在线引物设计系统对目的基因引物进行设计。使用2-△△Ct方法计算结果。引物设计如下:

1.6.2 Western Blot 检测成骨相关蛋白及线粒体自噬相关蛋白表达 将细胞以5×104/ ml 密度接种于6 孔板中,刺激7d 后,收集细胞裂解。预冷离心机至4℃,12000rpm 离心30min 取上清蛋白,BCA 法测定,12%SDS-PAGE 凝胶中进行电泳后转膜,5%脱脂奶粉室温封闭1h。按照抗体使用说明以1∶1000 对一抗进行稀释,4℃下孵育24h,TBST 洗膜后二抗(1∶1000)孵育2h,TBST 洗膜后进行发光。将蛋白质表达水平相对于β-actin 标准化。Image J 软件对条带进行半定量分析。
1.7 统计方法 采用Graphad9.0 进行数据统计分析,定量数据以均数±标准差表示,数据符合正态分布与方差齐,两组间比较采用独立样本t 检验,多组间的比较采用单因素方差分析。P<0.05具有显著差异。置信区间95%。
2.结果
2.1 SD 大鼠分离培养与鉴定 光镜下观察P3代rBMSCs 形态均一、平行排列,呈长梭形,多角形,漩涡样、集落样生长。流式细胞术鉴定结果显示,细胞的分子表型中CD73(95.9%)、CD90(98.6%)和CD105(96.2%)表达呈阳性,CD31(1.26%)、CD34(0.51%)和CD45(0.63%)表达呈阴性。成骨诱导14d,茜素红染色光镜下可见大量红色矿化结节;成脂诱导14d 油红O 染色,光镜下可见大量脂滴形成。因此实验所分离提取的细胞符合间充质干细胞的特性(图1)。
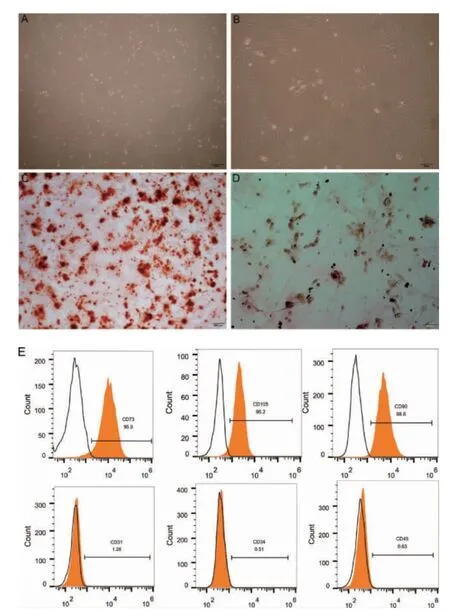
图1 大鼠骨髓间充质干细胞培养与鉴定
2.2 大鼠骨髓间充质干细胞炎症微环境的构建与验证 CCK-8 结果显示,炎症诱导第1 天对照组OD 值(0.3646±0.0073),炎症组OD 值(0.3579±0.0088)二者相比无明显统计学差异(P>0.05)。随着时间增加,炎症组rBMSCs 增殖能力呈明显下降趋势(P<0.05)。证实TNF-α 100ng/ ml 诱导的炎症环境对rBMSCs 增殖起到抑制作用(图2)。成骨诱导14d 茜素红染色,大体照观察可见炎症组钙结节明显少于对照组。定量分析结果显示炎症组显著少于对照组(P<0.05)。碱性磷酸酶活性检测结果显示,与对照组相比,炎症组ALP 活性降低(P<0.05)(图3)。RT-PCR 结果显示(图4),与对照组相比,炎症组ALP 与OPN 相对表达量显著下降(P<0.05)。Western Blot 结果证明(图5),炎症组ALP 与OPN 蛋白表达量显著低于对照组(P<0.05)。激光共聚焦显微镜观察,线粒体与肌动蛋白F-actin 共定位结果显示(图6)对照组大鼠骨髓间充质干细胞线粒体形态呈线状,F-actin 标记细胞骨架微丝结构清晰。炎症组线粒体网状结构明显破坏,碎片化程度加深,点状线粒体增多,F-actin标记细胞骨架微丝结构紊乱,正常骨架的微丝结构明显减少。因此TNF-α 100ng/ ml 成功构建体外炎症微环境模型。
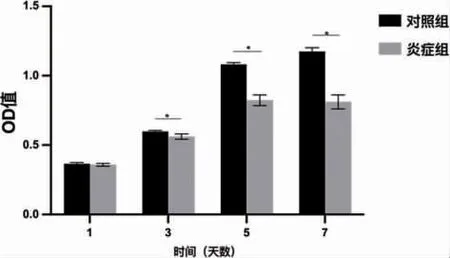
图2 CCK-8 检测细胞增殖情况(*P<0.05)
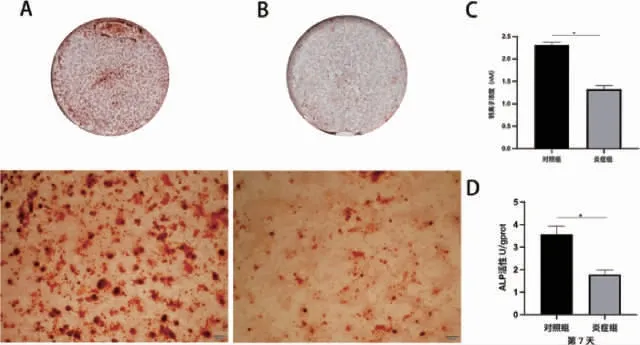
图3 炎症微环境对rBMSCs 成骨分化的影响
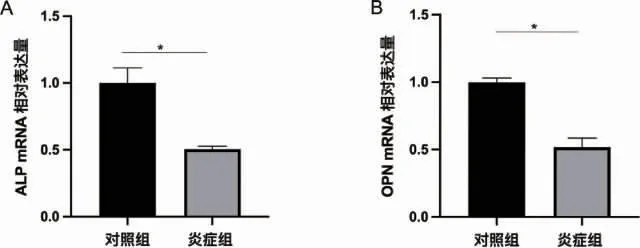
图4 RT-PCR 检测炎症微环境下第7 天成骨相关基因表达情况
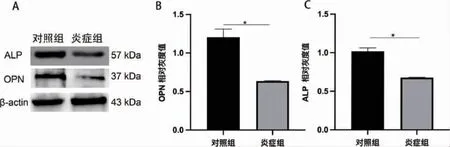
图5 Western Blot 检测炎症微环境下第7 天成骨相关蛋白表达情况
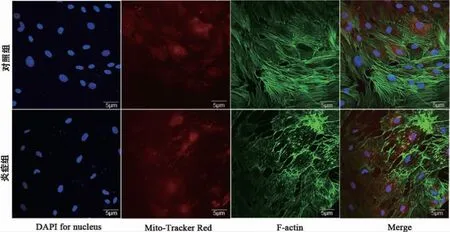
图6 激光共聚焦显微镜观察Mito-tracker 与F-actin 共定位情况(400×)
2.3 炎症环境下线粒体自噬对大鼠骨髓间充质干细胞的增殖及成骨分化影响 通过添加线粒体自噬抑制剂与促进剂后,激光共聚焦线粒体与LC3共定位(图7)二者荧光共定位的结果为:T 组PCC=0.47±0.01,T+促进剂组PCC=0.77±0.06,T+抑制剂组PCC=0.32±0.04(P<0.05)。CCK8 结果显示,刺激加入第一天,T 组OD 值为0.3559±0.0038、T+促进剂组OD 值为0.3683±0.0027、T+抑制剂组OD 值为0.3505±0.0037,三者相比无统计学差异(P>0.05)。随着时间的增加,与T组相比,T+促进剂组rBMSCs 增殖能力呈明显上升趋势(P<0.05),T+抑制剂组则呈明显下降趋势(P<0.05)(图8)。说明在炎症环境下,线粒体自噬能力的变化会影响rBMSCs 增殖能力。成骨诱导14d 茜素红染色,大体照观察可见T+促进剂组钙结节明显多于T 组,T+抑制剂组则少于T 组,定量分析结果同样验证了此现象(P<0.05)。碱性磷酸酶活性检测结果显示,与T 组相比,T+抑制剂组ALP 活性降低,T+促进剂组ALP 活性增强(P<0.05)(图9)。
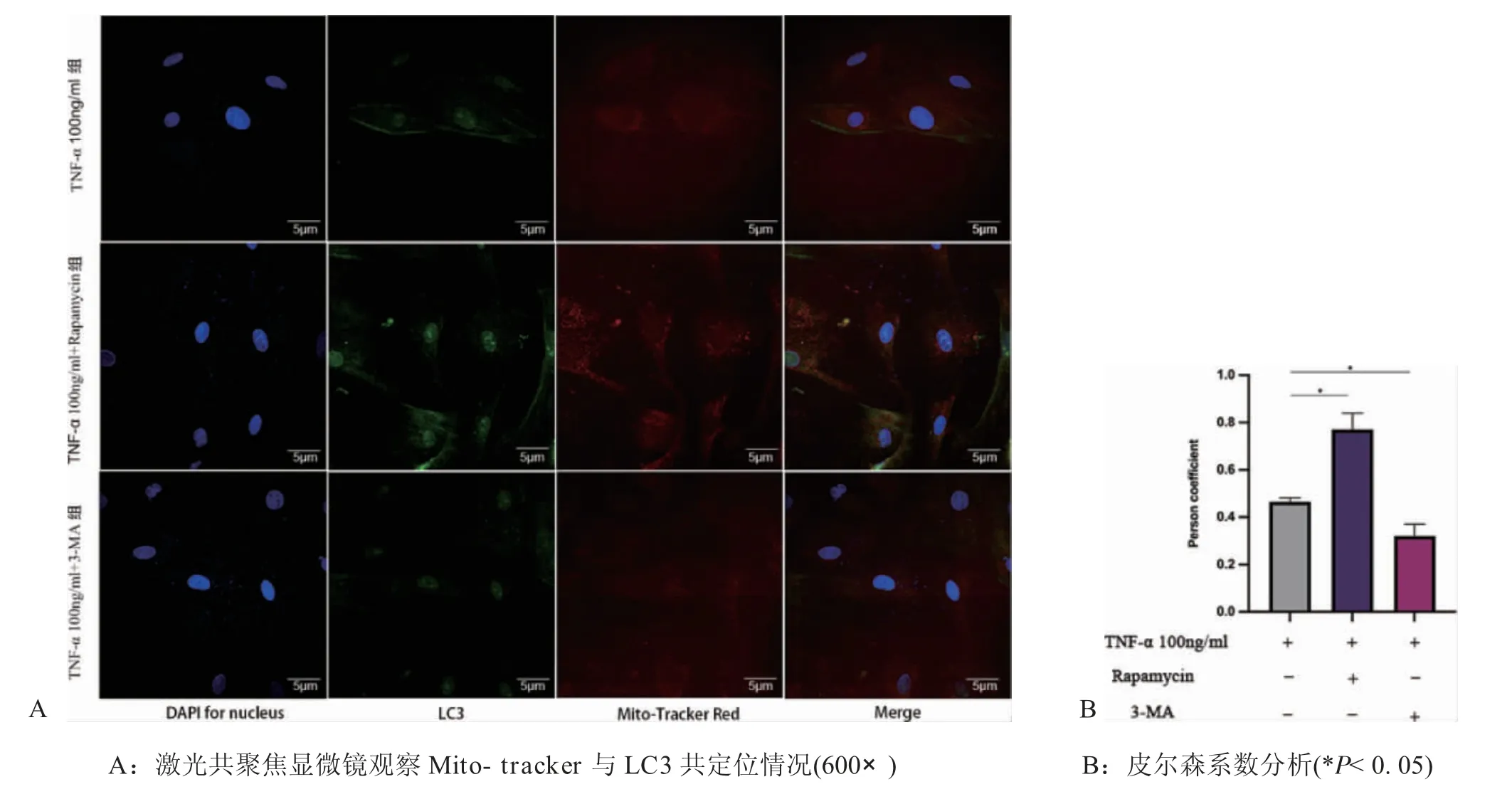
图7
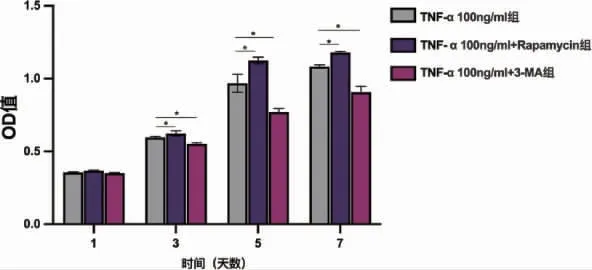
图8 CCK-8 检测添加抑制剂与促进剂后细胞增殖情况(*P<0.05)
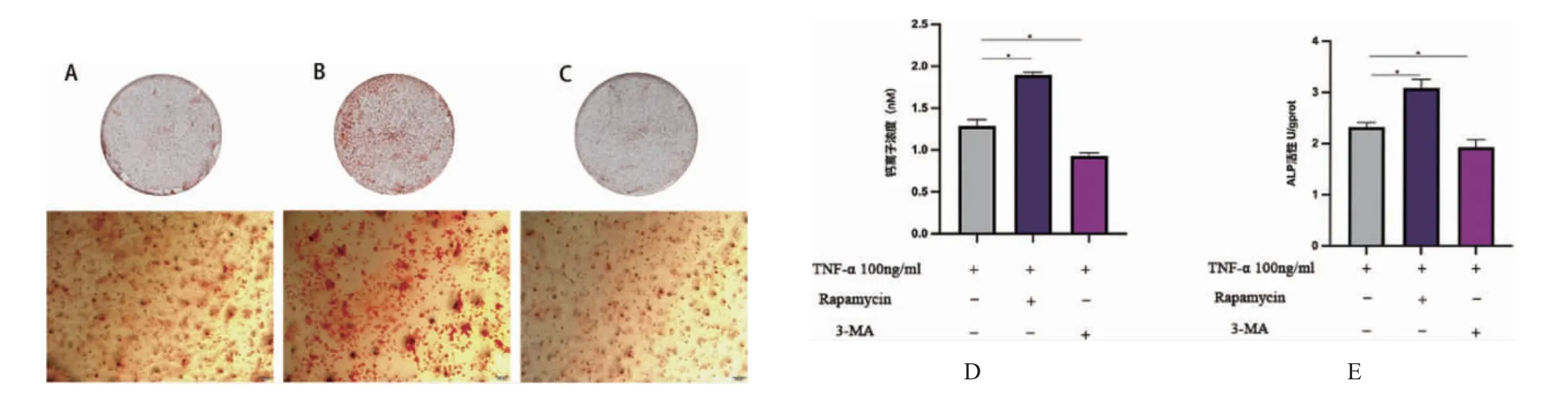
图9 炎症微环境下线粒体自噬对rBMSCs 成骨分化的影响
2.4 炎症微环境下成骨相关指标及线粒体自噬相关指标表达情况 从蛋白层面验证结果显示(图10),与T 组相比,T+促进剂组成骨相关蛋白ALP与OPN 相对表达量显著升高(P<0.05),线粒体自噬相关蛋白PINK1、Parkin 和LC3II/ LC3I 相对表达量升高(P<0.05),P62/ SQSTM1 相对表达量降低(P<0.05)。T+抑制剂组与T 组相比,成骨相关蛋白ALP 与OPN 相对表达量显著降低(P<0.05)。线粒体自噬相关蛋白PINK1、Parkin 和LC3II/LC3I 相对表达量降低(P<0.05),P62/ SQSTM1 相对表达量升高(P<0.05)。
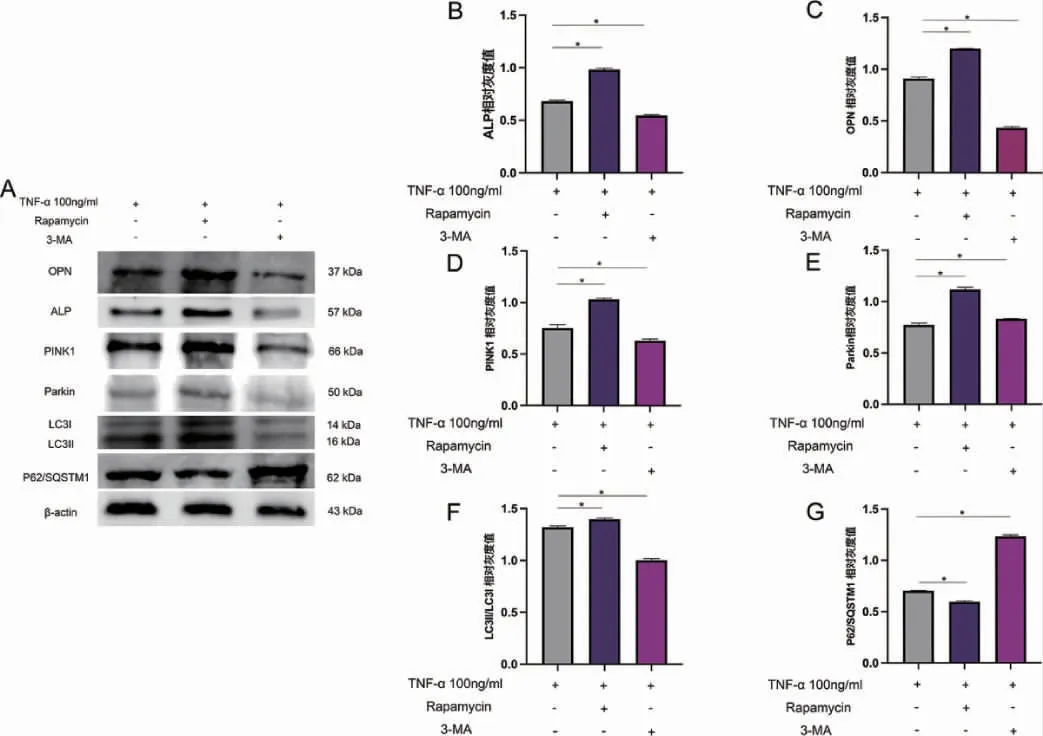
图10 Western Blot 检测炎症环境下分别加入雷帕霉素(10nM)与3-MA(5mM)后7d 后成骨相关蛋白与线粒体自噬相关蛋白表达情况
从基因层面验证可发现(图11),与T 组相比,T+促进剂组成骨相关基因ALP 与OPN 相对表达量显著升高(P<0.05),线粒体自噬相关基因LC3II/LC3I 相对表达量升高(P<0.05),P62/ SQSTM1 相对表达量降低(P<0.05)。T+抑制剂组与T 组相比,成骨相关基因ALP 与OPN 相对表达量显著降低(P<0.05)。线粒体自噬相关基因LC3II/ LC3I相对表达量降低(P<0.05),P62/ SQSTM1 相对表达量升高(P<0.05)。
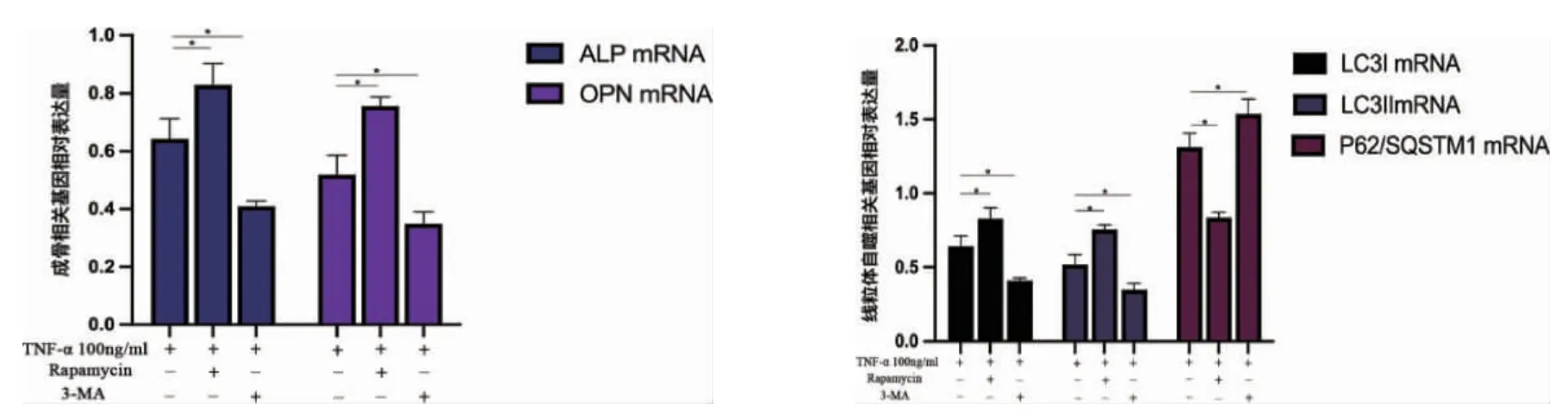
图11 RT-PCR 检测炎症环境下分别加入雷帕霉素(10nM)与3-MA(5mM)后7d 后成骨相关蛋白与线粒体自噬相关基因表达情况(*P<0.05)
因此在炎症条件下,随着雷帕霉素诱导线粒体自噬能力增强,成骨分化能力增强。随着3-MA抑制线粒体自噬能力的减弱,成骨分化能力减弱。
3.讨论
如何维持骨稳态与促进骨再生一直是口腔医学与骨研究领域关注的重点问题之一。间充质干细胞(MSCs)作为一种具有自我更新和多向分化潜能的干细胞,可以通过体外诱导定向分化为成骨细胞。Feng 等研究发现线粒体裂变可增强线粒体自噬从而促进rBMSCs 的干性与多向分化的能力[9]。目前对于线粒体自噬与成骨分化的相关性研究较少,具体机制仍不明确[10]。
应用肿瘤坏死因子TNF-α 诱导体外炎症微环境是目前常规使用的一种炎症诱导方式[11]。相关研究表明不同浓度及不同刺激时间下TNF-α 诱导的炎症微环境会对细胞的成骨分化产生不同的影响[12]。本研究中选择TNF-α 100ng/ ml 进行体外诱导刺激[13],成功构建体外成骨抑制炎症模型。
间充质干细胞分化阶段,细胞骨架的变化影响成骨标志物的水平,与成骨之间存在直接相关性[14、15]。纤维状肌动蛋白F-actin 作为细胞骨架的主要部分,其与细胞的聚集、解聚、粘附、延伸和迁移直接相关[16]。同时相关研究表明,细胞肌动蛋白丝可促进自噬体与溶酶体的融合,完成自噬过程,是自噬产生的基础[17]。本研究中,通过激光共聚焦观察线粒体与F-actin 共定位可看出,在rBMSCs 正常分化过程中细胞微丝结构整齐,线粒体网络结构通过管状连接;而TNF-α 100ng/ ml诱导的炎症环境下的细胞线粒体状态发生显著变化,细胞微丝结构紊乱,且数目明显减少,线粒体网状结构明显破坏。结合这一现象,本研究进一步添加线粒体自噬抑制剂与促进剂,通过CCK8、ALP 活性检测、茜素红染色、RT-PCR 与Western Blot 来验证线粒体自噬与成骨的相关性。
雷帕霉素通过抑制mTOR 蛋白激酶活性,从而诱导线粒体自噬的发生[18]。3-MA 作为一种线粒体自噬抑制剂,主要在自噬小体的形成与发展过程中发挥作用[19]。结合激光共聚焦观察线粒体与LC3共定位的情况,进一步验证雷帕霉素与3-MA 对自噬的强弱表达[20]。通过分析线粒体自噬相关指标PINK1、Parkin、LC3、P62/ SQSTM1,从而对线粒体自噬能力进行评价。LC3 主要参与自噬小体的形成。LC3II 是在自噬相关基因Atg 的作用下与磷脂酰乙醇胺(PE)偶联形成,结合于自噬体内外膜并与溶酶体融合后,外膜上的LC3II 被Atg4B 切割,产生LC3I 循环利用,内膜上的LC3II 则被溶酶体降解。因此在蛋白层面上通常使用LC3II/ LC3I 比值的大小来估计自噬水平的高低。LC3II/ LC3I 比值升高,自噬增强。反之,则下降[21]。NusChke A等研究发现在自噬处于激活状态时,LC3II 蛋白的积累促进了干细胞的分化[22]。这与本研究中,通过添加线粒体自噬促进剂进一步促进成骨分化相一致。P62/ SQSTM1 作为连接泛素化与LC3II 的接头蛋白,在胞浆中以散在点状或聚集形式存在,可在胞质与细胞核中转运,与底物结合的P62/ SQSTM1转运至自噬溶酶体中被蛋白水解酶降解而释放,因此P62/ SQSTM1 蛋白的表达量与自噬活性呈负相关[23]。最新研究发现,PINK1/ Parkin 介导的线粒体自噬与单细胞群分化呈正相关[24]。PINK1 作为一种蛋白激酶是启动线粒体自噬的关键调节因子,主要位于线粒体内膜上,Parkin 则位于级联信号下游。PINK1 可识别损伤的线粒体并在其表面积聚集,与Parkin 及泛素共同促进线粒体上多种外膜蛋白泛素化,最终在接头蛋白的P62/ SQSTM1的作用下转运至自噬溶酶体中降解[25]。使用雷帕霉素对炎症环境下rBMSCs 进行干预,结果显示雷帕霉素可明显恢复炎症环境所抑制的干细胞成骨分化与PINK1 及Parkin 的表达。而经3-MA 处理后,炎症下rBMSCs 线粒体自噬相关指标PINK1及Parkin 的表达进一步被抑制,同时成骨分化能力也进一步下降。炎症环境下,抑制剂与促进剂对线粒体自噬能力的调控,影响了成骨分化能力,说明线粒体自噬在保护细胞成骨分化过程中的重要性。
研究结果表明线粒体自噬能力的减弱可能是炎症环境抑制细胞成骨分化能力不可或缺的因素之一。推测提升炎症环境下线粒体自噬能力是促进炎症环境下rBMSC 成骨分化能力的有效策略。

