EZH2 影响炎症状态下人牙周膜干细胞成骨分化能力的研究*
王鹏程 田 欢 张 正 王左敏
牙周膜干细胞是从拔除牙齿牙根周组织分离培养而获得的种子细胞,可与支架材料和生长因子复合增殖分化而实现牙周组织再生[1]。在牙周再生治疗过程中,炎症环境会影响PDLSCs 的成骨能力[2],因此,在炎症环境下改变PDLSCs 的成骨能力显得尤为重要。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌外膜的主要毒力因子,与牙周炎的免疫反应有关[3],LPS 刺激后的牙周膜细胞可以被诱导产生一系列促炎细胞因子、趋化因子和基质金属蛋白酶,它们会导致牙周组织的炎症浸润和组织破坏[4-6]。同时有研究表明,在受到LPS 刺激之后的牙周膜干细胞,其分化、增殖的潜能也会受到影响[7]。LPS 介导炎症发生、降低牙周膜干细胞成骨能力,并且可以刺激牙周膜干细胞来模拟炎症环境[8]。
EZH2 是一种多梳蛋白,通过使组蛋白H3 第27 位赖氨酸(H3K27)三甲基化修饰,达到抑制靶基因转录的作用,进而出现细胞分化和增殖异常,引起一系列疾病的产生。有研究发现,在骨质疏松症动物模型中通过抑制EZH2,可以促进间充质干细胞的成骨分化能力[9],而EZH2 是否是PDLSCs成骨分化的靶点还不得而知。本研究使用LPS 刺激模拟炎症环境,靶向敲低PDLSCs 中EZH2,检测其成骨能力变化,探讨EZH2 对炎症状况下PDLSCs 成骨能力的影响,以期为临床提供参考。
1.材料与方法
1.1 PDLSCs 的分离、培养与鉴定 选自首都医科大学附属北京世纪坛医院口腔科阻生齿拔除患者中获得健康磨牙(已通过首都医科大学附属北京世纪坛医院医学伦理委员会批准)。分离牙周膜组织,用0.2%胶原酶(Gibco,美国)在37℃处理2h后用0.25%胰蛋白酶消化30min。然后将单细胞悬液在含有100μg/ ml 链霉素(Beyotime,中国)、100U/ ml 青霉素(Beyotime,中国)的α-MEM 培养基(Gibco,美国)中在37℃和5%CO2条件下孵育。将第3-5 代细胞用于后续实验。
取第三代牙周膜干细胞使用PBS 洗1 遍,常规胰酶消化,最终调整细胞密度(1×106/ ml),分装至无菌EP 管中(1.5mL)。分别加入Alexa Fluor 647、FITC 或PE 直接荧光标记的抗人Stro-1,CD14 和CD45 抗体(Santa Cruz,美国)。利用同型抗体进行对照。冰上避光孵育1.5h,1000rpm 离心3min,小心弃掉上清,应用PBS 洗涤3 遍,加入含3%胎牛血清的PBS 重悬,应用流式细胞仪进行检测。选取对数生长期的牙周膜干细胞,使用胰酶消化之后制成细胞悬液,稀释为1×106、5×106、5×107个/ L 的单细胞悬液,将每种浓度的悬液选取1ml 均匀铺平在直径为10cm 的培养皿中,随后放入37℃、5%CO2培养箱中培养,每隔3 日换一次液。14d 后终止培养,PBS 清洗3 遍后使用4%多聚甲醛固定30min,使用PBS 再次清洗3 遍后使用0.2%结晶紫进行染色,染色15min 后使用PBS 再次冲洗,室温下干燥。镜下,以大于等于50 个细胞作为一个集落进行观察。
1.2 siRNA 的合成与转染 实验参照Lipofectamine 2000(Invitrogen,美国)细胞转染说明书进行。细胞消化分孔(6 孔板),两个离心管分别加入100ul RPMI-1640(Gibco,美国),1 号离心管加入Lipofectamine 2000,2 号离心管加入1ug DNA(100pmol siRNA)。将脂质体稀释液加入至2 号离心管,RPMI-1640 过洗一遍转染的细胞,加入RPMI-1640 0.8ml/ 孔。siRNA 转染设置空白对照组和阴性对照,过表达转染设置空白对照和空载转染组。将DNA-脂质体(siRNA-脂质体)混合物加入培养皿,放入37℃,5%CO2温箱中孵育。5h后,换10%FBS-RPMI1640 培养液,继续培养48小时后进行后续实验。
1.3 siEZH2 效率验证 Western Blot 检测三组牙周膜干细胞EZH2 转染后siEZH2-1、siEZH2-2、siEZH2-3 转染效率,选取其中转染效率最高的一组进行下一步实验。
使用LPS 刺激牙周膜干细胞、空转牙周膜干细胞siNC 和已敲减EZH2 的牙周膜干细胞siEZH2,验证在LPS 刺激情况下EZH2 基因的转染抑制是否受到影响。
1.4 Western Blot LPS 模拟炎症环境时PDLSCs 中EZH2 表达的变化:使用不同浓度LPS刺激牙周膜干细胞48h,细胞分组:1.牙周膜干细胞组;2.牙周膜干细胞+LPS 刺激组(1μg/ ml);3.牙周膜干细胞+LPS 刺激组(5μg/ ml);4.牙周膜干细胞+LPS 刺激组(10μg/ ml),Western Blot检测EZH2 表达变化,筛选出LPS 的最适浓度。
使用最适浓度的LPS 刺激牙周膜干细胞不同时间,细胞分组:1.牙周膜干细胞组;2.牙周膜干细胞+LPS 刺激(12h)组;3.牙周膜干细胞+LPS刺激(24h)组;4.牙周膜干细胞+LPS 刺激(48h),Western Blot 检测EZH2 表达变化,筛选出LPS的最刺激时间进行后续实验。
检测成骨蛋白表达时分组如下:①对照组:牙周膜干细胞;②实验组:siNC+LPS;③实验组:siEZH2+LPS。实验组空转和转染EZH2 后的牙周膜干细胞在使用方法1.2 得出的LPS 浓度和时间刺激后,在成骨诱导14d 后裂解细胞进行Western Blot 检测。
各组常规裂解细胞,取上清液进行蛋白定量(Beyotime,中国),进行10%SDS-PAGE(Solarbio,中国)凝胶电泳,转移至PVDF 膜(Millipore,美国),TBST 液洗涤印迹膜5 min 3 次。5%脱脂奶粉室温封闭1h。加入EZH2(CST,# 5246)、Runx2(Abcam,ab236639)、ALP (Abcam,ab133602)、OCN(Abcam,ab133612)和GAPDH(Cell Signaling Technology,美国)抗体,4℃过夜。弃一抗,TBST 洗涤15min 3 次。加二抗抗体,室温1h。最后ECL 显色(Beyotime,中国)评估蛋白质条带。
1.5 茜素红染色 实验分组:(1)对照组:牙周膜干细胞;(2)实验组:siNC+LPS;(3)实验组:si EZH2+LPS。
按照厂商说明书(Cyagen,美国)进行,牙周膜干细胞培养于含10%胎牛血清、100 U/ ml 青霉素、100 U/ ml 链霉素的a-MEM 培养基中,在恒温培养箱中以5%CO2、37 ℃以及饱和湿度条件下松盖培养,每1~2d 换液一次,当细胞长至80%铺满时再消化传代。
成骨诱导培养液:地塞米松10nmol/ L,B-甘油磷酸钠10mM/ L,抗坏血酸50μg/ ml,双抗,a-MEM 培养基,10%FBS。每3d 换液一次(半换液),21d 后吸去培养液,用PBS 清洗两次,用4%多聚甲醛固定30min。用去离子水清洗1 次,之后2%茜素红染色液染色20min~30min,拍照。在拍照之后进行脱色处理(每孔加300ul 5%的高氯酸溶液,在摇床上温和摇床15min,然后在吸取100ul脱色液到96 孔板,用酶标仪进行读数,记下OD值,检测波长490nm)。
1.6 统计分析 SPSS 19.0(IBM Corp.) 统计软件用于数据分析,GraphPad Prism V(GraphPad Software,Inc.) 用于图像编辑。测量数据表示为平均值±标准差,并使用非配对t 检验进行比较。使用单向方差分析和Tukey 事后检验确定多个组之间的差异。P<0.05 被认为表明有统计学显着差异。
2.结果
2.1 牙周膜干细胞的分离、培养与鉴定 本实验采用改良组织块法进行原代培养,培养至8~10天时镜下观查可见长梭形、成纤维样细胞在组织块周围较密集排列(图1)。

图1 原代培养牙周膜干细胞(×40)
镜下观察使用结晶紫染色的牙周膜干细胞呈长梭形集落样生长,细胞体积较小,排列紧凑,细胞簇中心细胞密度越大(图2)。
图2 牙周膜干细胞克隆形成(×100)
流式细胞术检测结果表明原代培养的牙周膜干细胞阳性表达间充质干细胞标志物stro-1,阴性表达单核巨噬细胞标志物CD14、造血干细胞表面标志物CD45(图3)。证实了本实验培养的克隆化细胞来源于间充质干细胞。
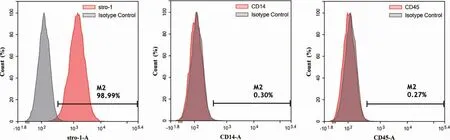
图3 流式细胞术检测牙周膜干细胞表面相关抗原
2.2 不同浓度与时间的LPS 对PDLSCs 刺激后EZH2 的表达变化 LPS 浓度为10μg/ ml 时EZH2 表达显著升高,有统计学差异(P<0.05),选择10μg/ ml LPS 进行下一步研究(图4)。LPS刺激48h 后EZH2 表达显著升高,有统计学差异(P<0.01)(图5)。
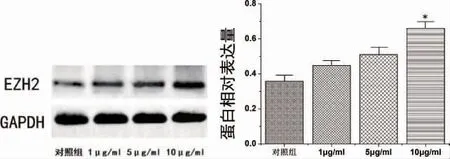
图4 不同浓度(1μg/ ml、5μg/ ml 和10μg/ ml)LPS刺激后PDLSCs 中EZH2 表达变化(*P<0.05)

图5 LPS 刺激PDLSCs 不同时间(12h,24h 和48h)后EZH2 表达变化(**P<0.01)
2.3 EZH2 敲低后PDLSCs 中EZH2 的表达为了研究EZH2 的作用,用siRNA 转染抑制EZH2表达。通过Western Blot 检测发现siRNA 转染后PDLSCs 中EZH2 的蛋白水平显着降低,有统计学差异(P<0.05),尤其是在si-EZH2-3 中,差异最为显著(P<0.01)(图6),根据Western Blot 检测结果灰度分析:三组的EZH2 蛋白水平的表达率分别为68%、73%、41%,选择siEZH2-3 进行后续实验。
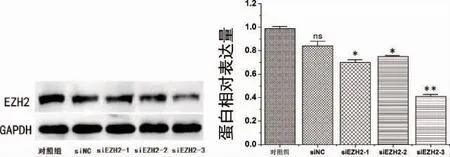
图6 EZH2 敲低后PDLSCs 中EZH2 表达水平变化(*P<0.05,**P<0.01)
siNC 组在LPS 刺激后EZH2 表达显著升高,有统计学差异(P<0.01),敲低EZH2 后显著抑制LPS 诱导的EZH2 表达的上调,有统计学差异(P<0.05)(图7)。

图7 LPS 刺激EZH2 敲低后PDLSCs 中EZH2 表达水平变化(*P<0.05,**P<0.01)
2.4 EZH2 敲低对LPS 刺激下PDLSCs 中成骨蛋白Runx2、ALP、OCN 表达影响 各组加刺激并成骨诱导14d 后,Western Blot 检测结果显示LPS 显著抑制PDLSCs 中RUNX2、ALP 和OCN 水平,有统计学差异(P<0.05,P<0.01);与LPS 组相比,EZH2 敲低后PDLSCs 中Runx2、ALP 和OCN 表达水平显著提高,有统计学差异(P<0.05)(图8)。
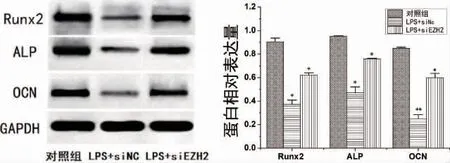
图8 LPS 刺激EZH2 敲低后PDLSCs 中Runx2、ALP 和OCN 表达水平变化(*P<0.05,**P<0.01)
2.5 EZH2 敲低后LPS 刺激下PDLSCs 茜素红染色 茜素红染色结果表明,成骨诱导28d 后,LPS+siNC 组较对照组深红色矿化结节减少,说明LPS 刺激后牙周膜干细胞成骨能力降低;siEZH2组较siNC 组深红色矿化结节显著增多,说明EZH2敲低后炎症状态下牙周膜干细胞成骨能力增强。再次验证EZH2 敲低后可以减轻炎症状态PDLSCs的成骨抑制(图9)。
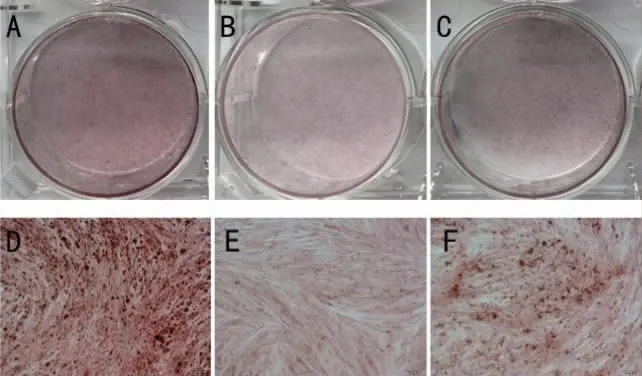
图9 EZH2 敲低后LPS 刺激下PDLSCs 茜素红染色对照组肉眼观(A)及对照组镜下观(D);LPS+siNC 成骨诱导茜素红染色肉眼观(B)及镜下观(E);LPS+siEZH2 成骨诱导茜素红染色肉眼观(C)及镜下观(F)
3.讨论
PDLSCs 是牙周组织工程中理想的牙周再生种子细胞,有学者从炎症的牙周组织中分离出间充质干细胞后[10],大大增加了种子细胞的来源。在临床应用阶段,种子细胞在牙周组织再生的过程往往也伴随着一定程度的炎症。细菌的定植和随后伴随的宿主免疫反应形成了一个特定的炎症微环境,这通常会影响PDLSCs 的功能[11]。有研究表明,不同牙周致病菌分泌的细菌上清液会诱导PDLSCs 产生一系列的细胞因子,从而导致局部牙周组织破坏,在这些病原体存在的情况下,PDLSCs 的迁移、增殖和成骨功能都会受到影响[12]。本实验采用改良组织块法进行PDLSCs 原代培养,通过流式细胞术鉴定干细胞表面抗原,证实了本实验培养的克隆化细胞具有间充质来源[13]。
表观遗传调控包括DNA 甲基化、微小RNA修饰、组蛋白乙酰化和长链非编码RNA 修饰,越来越多研究表明牙周炎与表观遗传修饰有关[14]。EZH2是PRC2 复合物的核心催化亚基,在调节广泛的生物过程中起着关键作用,包括恶性肿瘤发展、干细胞更新和发展、免疫反应和细胞衰老,它通过催化基因启动子区域内组蛋白H3 上赖氨酸27 的三甲基化来介导基因沉默[15]。EZH2 对于干细胞的维持和分化很重要。在间充质干细胞分化方面,EZH2 抑制成骨并促进脂肪生成。细胞周期蛋白依赖性激酶1(CDK1)对EZH2 的抑制导致间充质干细胞分化为成骨细胞[16]。同样,还有研究表明,使用EZH2化学酶抑制和shRNA 敲低也是间充质干细胞成骨的调节剂[17]。
在本实验中我们使用LPS 模拟炎症环境,使用1μg/ ml、5μg/ ml 和10μg/ ml 浓度的LPS 分别刺激牙周膜干细胞,EZH2 表达随浓度升高表达增强,并且以时间依赖性趋势表达逐渐增强,这与Cheng 等[18]的体外研究结果相似,最终我们选取了10μg/ ml 浓度的LPS,刺激时间为48 小时进行下一步的实验。为了进一步研究在炎症环境下EZH2对牙周膜干细胞成骨分化能力的影响,我们通过脂质转染抑制了牙周膜干细胞中EZH2 的表达,再次使用LPS 刺激后,EZH2 水平显著降低,说明siEZH2 可以抑制因为LPS 刺激而进引起牙周膜干细胞中EZH2 升高。
成骨分化能力是牙周膜干细胞的重要特性,炎症环境会影响牙周膜干细胞的功能。本实验中,我们发现使用10μg/ ml 的LPS 对牙周膜干细胞刺激后,牙周膜干细胞Runx2、ALP、OCN 表达均有降低。Runx2、ALP、OCN 是衡量成骨功能的重要因子,在成骨细胞分化的早期,Runx2 不仅是起决定性作用的关键转录因子,还是体内成骨的必需转录因子。有研究显示将小鼠的Runx2 基因敲除后将无法形成矿化的骨骼系统,从而导致在围产期发生死亡现象[19]。ALP 是由成骨细胞分泌的一种酶,它的表达是成骨细胞分化的一个非常明显的特征之一。骨钙素OCN 是一种由成骨细胞和骨细胞合成的小蛋白,是骨骼中含量最丰富的非胶原蛋白之一[20,21]。
EZH2 会影响牙周膜干细胞的成骨功能,这可能与EZH2 对H3K27me3 的甲基化作用有关,有研究证实[22]:LPS 刺激牙周膜干细胞后不仅Runx2基因表达下调,并且LPS 对Runx2 的这种抑制作用与基因启动子上H3K27me3 的富集增加有关。H3K27me3 在Runx2 基因启动子上的占据似乎在成骨过程中起关键作用,因为H3K27me3 的组蛋白甲基转移酶和去甲基化酶均调节成骨细胞分化。
在本实验中,我们抑制EZH2 后,再次使用LPS 刺激牙周膜干细胞,其成骨蛋白ALP、Runx2、OCN 表达较shNC 组显著升高,说明抑制EZH2后恢复了因为炎症环境引起的牙周膜干细胞成骨能力的下降,茜素红染色也再次验证了这一点。因此我们猜测是否是因为EZH2 影响了LPS 介导的某条通路的关键蛋白,降低了LPS 对牙周膜干细胞成骨功能的抑制。
4.结论
靶向敲低EZH2 后,可以减少因LPS 刺激所引起的牙周膜干细胞中Runx2、ALP、OCN 蛋白表达下降和成骨能力降低。

