基因编辑猪中条件性基因修饰系统的研究进展*
刘晓艺 金 琴 王可品 赖良学**
(1)中国科学院广州生物医药与健康研究院,广州 510530;2)三亚猪种质资源创新研究院,三亚 572000;3)海南省实验动物研究中心,三亚 572000)

家猪(Sus scrofa domesticus),不仅在农业生产中具有重要的经济价值,也是生物学领域不可或缺的大动物模型以及潜在的异种器官移植供体来源。
动物模型是研究人类基因功能、疾病发展机理及开发新治疗手段的重要工具,在生命科学研究的发展过程中,小鼠是应用最为广泛的哺乳动物模型。但小鼠并不适合所有生命科学研究,在肿瘤模型的检测中常用的X光、超声检查,受限于小鼠的体型难以应用;在肿瘤药物试验中,约95%在小鼠上有非常明显作用的药物,在临床疗效甚微,甚至无效[1];在基因功能的研究中,有些基因突变可导致人出现严重的疾病症状[2],但在小鼠上表型不明显,甚至没有表型[3]。具有传统农业经济价值的猪,在生物医药领域,由于其体型、解剖结构、器官大小、生理代谢、免疫系统都与人类更加相似,使其在异种器官移植[4]、疾病模型[5]、脑科学[6]、生物反应器[7]、代谢模型[8]上的研究发展迅速。2012 年完成了猪的全基因组测序,发现猪全基因组与人有很大的相似性,不仅有112个位点的氨基酸序列完全相同,并且这些位点中大部分异常都会导致人相应的疾病[9]。此外,在蛋白质表达类型上,与小鼠相比,猪与人有更多的相似性,例如人胰腺α和β细胞表达MAF亮氨酸拉链转录 因 子B (MAF bZIP transcription factor B,MAFB),猪也表达,而小鼠却不表达[10]。凭借以上优势,猪不仅非常适合作为由于基因突变导致的人类疾病的动物模型[11-12],在异种器官移植领域也具有潜在的应用前景。2022 年1 月10 日,世界首例成功植入基因编辑猪心脏的手术完成,并延长了患者2个月的寿命,开辟了基因编辑猪在异种器官移植领域的新时代[13]。
基因修饰通常是在基因组中插入或删除某些基因,从而获得理想的表型特征。在技术层面,基因修饰猪最开始主要依赖显微注射来获得,通过将多拷贝的DNA 注入到受精卵的核中,至少有一个拷贝的DNA 整合到受精卵的基因组中,才能成功获得转基因猪[14]。而后,随着体细胞核移植技术(somatic cell nuclear transfer,SCNT)的兴起,可以将发生了基因修饰的体细胞核移植到去核的卵母细胞中,再移植到代孕动物的输卵管中,分娩后即可获得基因修饰动物[15],显著提高了培育基因修饰猪的效率。其中,获得基因修饰体细胞是该技术关键环节之一,早期主要依赖转基因和自然发生的低概率同源重组[16]分别建立转基因细胞系和基因打靶细胞系,但由于体细胞在体外的增殖能力有限,基因修饰效率极低;随着慢病毒转染[17]、转座子[18]、RNA 干扰[19]、位点特异性重组酶[20]的出现,在一定程度上提高了获得基因修饰细胞的效率;直到ZFN[21]、TALEN[22]、CRISPR/Cas9[23]等人工核酸酶的出现,基因编辑领域发生了革命性的变化,这些核酸酶不仅能在基因组特定位置切割,极大地提高了同源重组的频率和精确性,还将基因编辑的类型从敲除和敲入拓展到无痕编辑、多基因同时突变、条件性基因编辑(图1)。
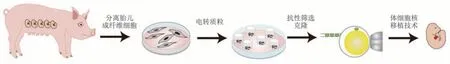
Fig.1 Schematic of the methods on generating genetically modified pigs图1 制备基因修饰猪的方法示意图
上述技术的发展使研究人员能够高效快速地制备表达外源基因或敲除内源基因的基因修饰猪模型。然而,在生命体生长发育过程中,有相当一部分基因只在特定时期或特定组织中起功能,还有一部分基因敲除致死[24]。此外,即使是广泛表达的基因,根据研究目的,也需要在特定时期调控其表达。因此,为了更加全面深入地研究基因的功能,条件性基因修饰系统应运而生。
条件性基因修饰系统在小鼠[25]、果蝇[26]、斑马鱼[27]等模式动物中发展成熟且应用广泛,尤其是小鼠胚胎干细胞体系非常成熟,使小鼠成为条件性基因修饰系统首选的哺乳动物模型。然而,部分小鼠基因的表达位置与时间和人存在差异,导致基因突变小鼠无法模拟人出现的表型。人类亨廷顿舞蹈症是由于HTT基因1 号外显子CAG 重复导致蛋白质错误折叠和聚集,在基因修饰猪上出现了与人类似的神经退行性特征[28],在小鼠模型上则没有明显症状[29];cftr基因突变小鼠肺部没有明显病理变化[30],但CFTR突变的猪出现了典型的肺部缺陷[31]。基因修饰猪是不可或缺的动物疾病模型。由于很多致病基因直接敲除致死,因此构建能在特定时间、特定空间调控基因表达的基因修饰猪模型,将为研究人类基因功能、疾病发展机理及开发新的治疗手段提供更加理想的大动物模型。
条件性基因修饰是相对于直接基因修饰的一个概念,本文按照条件性基因修饰导致的结果以及研究中的主要应用,简单地将其分为条件性基因缺失系统和条件性基因过表达系统。
1 条件性基因缺失系统
1.1 Cre/loxP系统
自1998 年冷泉港会议上宣布“Cre works.”,Cre/loxP重组酶系统成为基因功能研究中广泛应用的工具。其不仅能实现基因的删除、倒置,更重要的是突破了时间和空间的限制,加速了基因功能研究与基因修饰动物模型的建立[32]。 Cre(cyclization recombinase)重组酶来源于P1噬菌体,属于酪氨酸位点特异性重组酶的整合酶家族[33],能够特异性识别两个长度为34 bp的DNA序列并介导两个位点之间的序列重组,被识别的特异性序列称为loxP(locus of x-over,P1),这34 bp的序列中包含8 bp 的核心序列以及两侧倒置和回文13 bp,单个Cre重组酶分子与loxP位点每个回文的一半结合,形成四聚体,使两个loxP位点结合在一起,目的基因两侧插有两个同向的loxP,通过在特定时期给予Cre,就能实现特定阶段目的基因的精确删除[34];当目的基因两侧插有两个反向的loxP,Cre能够介导二者之间基因的倒置。此外,将Cre置于组织特异性启动子下,待基因开始表达可实现Cre的组织特异性表达,进而实现特定组织中目的基因特异性敲除,为研究早期胚胎发育中的重要基因尤其是一些致死基因提供了可能。小鼠凭借成熟的体外胚胎干细胞培养体系,已经产生多种Cre/loxP的品系[35-37]。在小鼠上利用Cre/loxP通过控制不同时间节点的敲除来研究基因功能时,需要将目的基因两侧插有loxP位点的DNA注入小鼠的胚胎干细胞,通过控制其后代与能表达Cre的小鼠交配时间即可实现时间性特异敲除;当需要在特定组织或器官中特异性敲除目的基因时,只需要将控制Cre表达的组成型启动子换成组织特异性启动子,就能获得特定组织器官敲除目的基因的小鼠。然而,条件性基因敲除小鼠的制备路线在猪上很难实现。首先,猪没有成熟的体外胚胎干细胞培养体系,无法通过向胚胎干细胞注射DNA 制作嵌合体来获得后代,其次猪的妊娠期大约114 d,周期相对较长,成本高昂,此外有研究发现Cre对于猪早期胚胎发育有一定的毒性[38],因此,利用Cre/loxP 制备条件性基因敲除猪非常困难(图2)。

Fig.2 Principles of Cre/loxP system and application in gene-editing pigs图2 Cre/loxP条件性系统原理图及在基因修饰猪中应用
目前鲜有先通过制备目的基因两侧含有loxP位点的基因修饰猪,再通过与表达Cre的转基因猪交配来获得条件性基因修饰猪模型的报道。作为经典且应用广泛的条件性基因修饰系统,研究人员探索了在猪上应用Cre/loxP系统的可能。在猪上应用Cre/loxP 的前提是验证Cre 在转基因猪体内的活性及功能。2009 年,Li 等[39]通过构建loxP-stoploxP-CMV-EGFP 的猪成纤维细胞系并利用体细胞核移植技术获得了Cre功能验证的报告猪品系,利用表达Cre的腺病毒感染报告猪成纤维细胞后表达绿色荧光证明了Cre在转基因动物中的活性。2010年,Chen等[40]通过控制给poly I/C的剂量和时间,来启动Mx1,构建Mx1特异性启动Cre表达的基因修饰猪,推动了以猪为模型研究发育和疾病机制的发展。TP53抑癌基因突变在临床肿瘤患者中占比很高,为了更好地研究TP53在肿瘤发生发展中的机制,迫切需要建立TP53突变的大动物模型。2012 年,Leuchs 等[41]构建了Cre 介导重组后失活TP53和表达人TP53R175H同源的TP53R167H突变的基因修饰猪,很好地模拟Li Fraumeni 综合症和人群中偶发的TP53特定突变导致的癌症,TP53基因修饰猪的出现促进了以大动物为模型研究肿瘤的发生发展。2014 年,Li 等[42]借助TALEN 首次在猪的开放性位点Rosa26进行打靶,敲入了Cre介导表达的报告基因EGFP,并且通过盒式置换实现绿色荧光变红色荧光,同样利用盒式置换可以实现任意基因的异位过表达获得多种转基因猪,不仅为研究大动物谱系示踪提供了重要工具猪模型,也为家畜育种提供了一种新的思路。
上述关于在猪上应用Cre/loxP的研究,为了避开通过交配传递Cre的时间成本,大都利用病毒传递Cre。为了降低实验成本,规避早期Cre 表达带来的毒性,研究人员尝试在猪体内实现Cre的条件性表达,例如利用Tamxifen 与雌激素受体结合的特性[43-44],将Cre和表达含有突变配体结合的雌激素受体基因放在同一个启动子下,翻译出来的Cre-ETR2 融合蛋白与细胞质中的热休克蛋白HSP90 形成复合物,只有外源药物Tamxifen 存在时,才能破坏二者的结合,形成的Cre-ER-T2复合物进入细胞核识别loxP 位点,介导目的基因的删除、倒置,形成了受外源药物诱导的Cre-ERT2系统[45],降低了实验成本。
上述研究表明,Cre 在成体猪体内有活性并且可以发挥功能,并且在猪上可以利用Cre/loxP系统来实现单一基因的条件性表达,如果同时条件性删除几个基因,一种方法是可以通过对猪体细胞进行多轮编辑,使其成为含有多个目的基因两侧插有loxP位点的细胞,再通过体细胞核移植技术获得成体。然而,一方面多个基因同时编辑效率及其低下,另一方面由于猪的体细胞增殖能力有限,难以承受多轮编辑和筛选。另一种方法需要分别制备不同的基因修饰猪品系,通过多次交配来获得含有多个位点插有loxP的基因修饰猪,但是由于猪的繁殖周期长,多次交配耗时费力也不一定能获得目的基因修饰猪(图3)。2017 年,本课题组Wang 等[46]利用TALEN 在猪胎儿成纤维细胞进行编辑,在Rosa26位点利用同源重组敲入了SA-loxP-NEOPolyA-loxP2272-PolyA-tdTomato-2A-SpCas9-loxPloxP2272。当Cre 存在时,方向相反的loxP 对发生两次置换,最后在Rosa26位点只留下不成对的SAloxP-SpCas9-T2A-tdTomato-PolyA-loxP2272,通过SCNT成功获得了Cre介导表达SpCas9的基因修饰猪,不仅在细胞水平验证了转基因的SpCas9 活性和功能,还通过滴鼻慢病毒传递Cre 和gRNA,成功制备了第一只条件性、原发性肺癌猪模型,加速了利用大动物模型开展癌症诊疗、药物筛选、临床研究的进程。

Fig.3 Combination Cre/loxP with Flp/FRT to eliminate resistance markers图3 Cre/loxP与Flp/FRT联合应用去除抗性标记
1.2 Flp/FRT系统
Flp 整合酶来源于酿酒酵母,与Cre 同属一个整合酶家族,有着与Cre 类似的DNA 序列识别和重组机制,Flp 识别的DNA 序列与Cre 识别的loxP序列结构相同,也是两侧13 bp 的回文序列和8 bp的核心序列,但是具体的碱基组成不同,靶序列两侧FRT 的方向相同时介导靶序列的删除,方向相反时介导靶序列倒置[47-48]。最开始发现Flp发挥作用的最适温度是30℃,在一定程度上限制了其在动物模型中的应用,后面经过优化后其最适温度为37℃[49]。由于Cre/loxP 系统制备基因修饰动物效率高,应用成熟且广泛,目前在基因修饰猪上,Flp/FRT能实现的,经典的Cre/loxP系统都能实现,因此很少有单独应用Flp/FRT建立的基因修饰猪报道,但是在筛选基因修饰细胞时,常常与Cre/loxP系统联用,在获得阳性细胞后删除抗性筛选标记,提高了基因修饰动物的安全性(图3)。2021 年,本课题组联用Cre/loxP 和Flp/FRT,创建出精巧的条件性基因表达关-开-关转换系统,将此系统插入到靶基因的编码外显子中,在Cre介导下,插在倒置的转录终止序列两侧的反向loxP 对发生置换,倒置的转录终止序列正置,靶基因表达关闭;然后在Flp 介导下,两侧loxP 外围同向的Frt 对发生删除,转录终止序列被删除,靶基因恢复表达,从而实现了基因表达的可逆调控。这两种重组酶系统的联用应用到研究肿瘤、发育等相关基因的功能,将更加全面的阐释基因功能,促进靶向药物研发,加速临床转化(相关结果投稿中)。
2 条件性基因过表达系统
2.1 组织特异性启动子驱动系统
TALEN、ZFN、Cas9 等核酸酶出现之前,自然发生DNA 双链断裂和定点敲入的效率极低,为了在猪上实现组织特异性基因表达,通常采用的技术路线是将组织特异性表达基因的启动子利用PCR 技术扩增下来和需要表达的外源基因放在一起,或者人工设计启动子来实现组织特异性外源基因的表达。核酸酶出现之后,不仅大大提高了DNA 双链断裂发生的概率,而且还能实现定点基因敲入。利用人工核酸酶实现组织特异性表达,只需要打靶组织特异性表达基因的终止密码子附近,使其发生DNA 双链断裂,同时提供含有断裂位点上下游同源臂、外源基因的同源重组模板,这样就能真正实现内源基因启动子介导的外源基因过表达。2016 年,Lai 等[50]利 用CRISPR/Cas9 在 猪Oct4最后一个外显子的终止密码子进行打靶,同时提供含有5'同源臂、2A-Tdtomato 和3'同源臂的外源模板,利用同源重组成功获得了红色荧光指示Oct4表达的猪成纤维细胞,并通过SCNT获得了健康的仔猪,实现了细胞多能性状态的实时监测。2021 年,Du 等[51]利用CRISPR/Cas9 在猪ACE2的内源性启动子到1号外显子前进行打靶,同时提供含有5'同源臂-人ACE2-3'同源臂的外源模板,利用同源重组得到了表达人ACE2受体的猪成纤维细胞,并通过体细胞核移植技术成功获得了基因修饰猪,为新型冠状病毒检测、治疗、药物研发提供了一种新的大动物模型。目前,大都采用CRISPR/Cas9 介导的定点同源重组来获得基因修饰细胞,再通过体细胞核移植技术得到基因修饰猪的技术路线。
2.2 Tet-off/on调控系统
四环素(tetracyclines)与细菌30S核糖体亚基结合,是抑制细菌蛋白质合成和生长的抗生素,在革兰氏阴性菌的耐药性研究中发现,膜蛋白TetA介导的四环素流出是造成耐药的主要原因,而TetA 的表达受四环素反应抑制蛋白TetR 的调控,然而在Tn10编码的Tet操纵子中,tetA和tetR基因的位置相反,它们的表达受同一调控区域但相互独立的启动子PA 和PR 调控,TetR 蛋白形成二聚体,识别和结合tetO元件,从而抑制PA和PR启动子的活性,使tetA和tetR不表达[52-54]。1992年,Gossen等[55]描述了利用Tet操纵子的tetR和tetO的特性来开发哺乳动物细胞中控制基因表达的Tet-off调控机制:单纯性疱疹病毒VP16蛋白的转录激活结构域与tetR融合表达,使其成为受四环素控制的转录激活因子(tTA),7 个tetO 融合进真核启动子的TATA 盒;在没有四环素时,TATA 盒与tetO 结合,激活下游基因表达;四环素存在时,tTA 中的tetR构象改变,阻止tetO 结合,基因表达关闭[56-57](图4a)。利用这一系统研究目的基因功能时需要持续加药,而激活基因表达时又需要完全移除四环素,虽然这在细胞水平很容易操作,但在成体动物实验中难以控制,因此Tet-off系统不适合制备动物模型。
1995年,Gossen等[58]筛选到以相反方式发挥作用的rTetR,从而得到了四环素存在时,目的基因表达;撤药后,基因表达逐渐关闭的Tet-on 系统,最初的Tet-on系统对四环素不敏感,需要较高剂量的诱导,通过不断地突变筛选才得到正常剂量就能实现调控目的基因表达(图4b)。2012 年,Klymiuk 等[59]首次将Tet-on 系统应用到大动物模型猪上,通过第一轮细胞筛选获得了表达rtTA 的阳性克隆并获得了基因修饰猪,分离出的细胞进行二次筛选,经过两轮筛选分别建立了受四环素诱导表达RANKL、CTLA-4Ig的基因修饰猪模型,解决了异种器官移植中组成型表达某些基因导致供体过度免疫缺陷难以存活的情况,为异种器官移植和再生医学中供体的基因修饰提供了一种新思路。2012年,Jiang等[60]通过慢病毒转染Tet-on元件构建了受四环素诱导稳定表达猪生长激素蛋白的猪成纤维细胞系,与组成型表达生长激素的细胞系相比,pGH mRNA 水平提高了10 倍,利用该系统结合体细胞核移植技术对产生健康高产的转基因猪具有重要指导意义。2014 年,Ruan 等[61]先获得rtTA 置于猪内皮细胞特异性启动子Icam-2下游的细胞,在此细胞基础上再转染Tre 启动pp65RHD-IRESEGFP 表达的质粒,同样经过两轮筛选获得了条件性表达pp65RHD 的猪成纤维细胞系,解决了猪异种器官移植中内皮细胞功能障碍的问题,进一步推动了条件性基因表达系统在异种器官移植领域的应用。同年,以Tet-on 为基础,受四环素诱导表达EGFP的转基因猪诞生[62]。2021年,本课题组借助Cpf1 分别在猪的开放性位点Rosa26和Hipp11定点敲 除rtTA 和Tre-attP-Tdtomato-attP 等Tet-on 系统的元件,并将筛选到的阳性细胞作为供体通过SCNT成功获得受Dox诱导表达红色荧光猪模型;在此基础上,利用仅在Rosa26位点含有rtTA 元件的猪胎儿成纤维细胞再分别将原癌基因KRASG12D和基因编辑所需要的核酸酶Cas9 定点敲入Hipp11位点,通过SCNT 也分别获得了Dox 诱导表达KRASG12D和Cas9的模型猪,并且在诱导KRASG12D表达后,模型猪上出现肿瘤表型[63]。

Fig.4 Schematic of inducible system Tet-off and Tet-on图4 Tet/off与Tet/on可诱导系统原理图
2.3 PhiC31调控系统
PhiC31 整合酶是一种位点特异性重组酶,来源于链霉菌属噬菌体,属于丝氨酸催化的重组酶家族,通过识别宿主基因组上两个大约30 bp 的序列——attB 和attP,来介导两个位点之间序列的精确整合,整合后产生两个杂交位点,称为attL 和attR,不能再被PhiC31 识别,因此PhiC31 介导的整合是单向的[64-66](图5)。相比较Cre 介导的整合,重组后识别位点仍然存在,可能会发生二次重组,因此PhiC31更适合基因整合,Cre更适合删除基因。研究人员通过实验发现,基因组上存在的天然attP与含有attB的质粒组合PhiC31才能实现高效的重组整合;反之,基因组上的天然attB 与含有attP 质粒组合,无法实现[67]。真核生物基因组中存在的天然attP序列称为伪attP序列,通过在外源模板上人为添加attB,在PhiC31 的介导下就能实现精确地整合,因此PhiC31 整合酶系统成为转基因动物生产的有力工具[68]。2013 年,Bi 等[69]首次在猪的PK15 细胞中应用这一系统,证明了猪基因组中天然存在的伪attP序列功能性,为定向猪基因组工程开辟了一条新途径。2017 年,Park 等[70]首次利用显微注射将Cas9 和靶向目的基因的sgRNA 注射到猪的受精卵中以获得目的基因敲除的动物,此外他们还提供含有attP的外源模板,获得COL1A位点含有attP 的转基因动物,并在细胞水平验证在给予含有attB-EGFP-PhiC31 的外源模板时,能实现EGFP 的位点特异性整合。2018 年,Nunes Dos Santos 等[71]利用Cas9 和靶向猪血栓调节蛋白(pTHBD)外显子上下游的两条sgRNA 删除猪基因组上原有的pTHBD,同时提供含有sgRNA 切割位置同源臂、attP-hTHBD-attB、抗性筛选标记的外源模板,发生同源重组后的阳性细胞,在PhiC31、同源重组的介导下,在猪基因组上实现猪内源性pTHBD 启动子启动人血栓调节蛋白的表达,由于猪血栓调节蛋白无法调节人的血栓凝结,这一研究结果将直接促进猪作为供体在异种器官移植领域的研究。此外,利用这一策略,可以高效快速构建表达人基因的猪细胞系,相比较与病毒介导的随机整合,PhiC31 整合酶系统精确度更高,对宿主也更安全,但目前在基因修饰猪中应用较少。

Fig.5 Gene recombination is mediated by PhiC31图5 PhiC31介导基因重组
3 展望
在制备条件性基因修饰动物模型时有很多选择,但研究表明并不是所有的系统都是完美的。例如,在利用Cre/loxP 或Flp/FRT 时有一个预先的假设是动物体内不存在天然的loxP 位点,然而在研究中发现基因组中存在天然的伪序列[72-73],这些伪序列在体外实验中能够在Cre 介导下发生重组,尽管小鼠上有大量的Cre/loxP品系没有显示出这一问题,但由于Cre/loxP基因修饰猪数量较少,难以统计。此外,通过组织特异性启动子表达Cre 时,最常见的问题是启动子不特异,造成Cre的泄漏表达,无法实现空间特异性表达。尽管可能存在一些问题,但是仍然是小鼠上主要应用的条件性系统,据此建立了多种小鼠品系。在猪上应用条件性系统时可以适当参考小鼠上选用的启动子以及打靶外显子位置来获得高质量受调控的条件性基因修饰猪。同样的,Tet-on系统在实际动物模型中也存在一些问题。在构建的Dox 诱导Cas9 表达的基因修饰猪模型中发现,即便是全身表达的启动子,Cas9 在各个器官中的表达量也不尽相同。此外有研究发现,Tet-on中的rtTA元件能引起猴子中某些个体的免疫反应[74],这一点在小鼠中未曾报道[75-76],也提示大动物模型与啮齿类动物之间的差异性。
在猪上应用条件性基因修饰系统,从最初只是在猪的基因组中放入单一条件性系统所需要的元件来研究特定基因的功能,发展到现在,不仅实现了多个条件性系统联用来调控基因表达“关-开-关”,而且将条件性系统与人工核酸酶联用,获得了条件性表达人工核酸酶的工具猪。为了构建一个适用于多种基因编辑场景的工具猪模型,本实验室利用人工核酸酶Cpf1 介导的双链断裂,成功将rtTA 和Tre3G-SpCas9-2A-tdTomato分别与猪基因组上的两个开放性位点Rosa26和Hipp11同源重组,利用体细胞核移植技术,成功获得了受四环素诱导的稳定表达SpCas9 并且能稳定遗传的基因修饰猪品系。通过饲料添加及腹腔注射四环素,不仅实现了Cas9 在多个器官中的稳定高效表达,还在细胞水平验证了受四环素调控的Cas9活性和功能;此外,通过向该基因修饰猪传递靶向抑癌基因TP53、LKB1敲除的sgRNA和过表达原癌基因KRASG12D的腺相关病毒,成功获得了转移性胰腺癌猪模型。更重要的是,在此模型猪细胞的基础上,仅需要一步基因修饰引入靶向不同基因的sgRNA,就能实现任一基因和多基因的组织特异性敲除,直击Cre/loxP系统在大动物模型应用中的痛点,建立一套更适用于大动物的模型的时空调控系统,将极大地促进猪作为一种大动物模型在再生医学、临床医学、肿瘤学中的应用,同时也为非人灵长类等大动物模型条件性系统的建立提示了一种新的路线(相关结果在投稿中)。
除了研究基因功能、建立基因突变驱动的疾病模型,条件性基因修饰系统在猪的异种器官移植领域也能解决直接敲除导致的供体猪过度免疫缺陷难以存活的问题,促进异种器官移植领域的发展。尽管人工核酸酶的发展极大地提高了获得含有条件性基因修饰元件的猪体细胞,但目前,哺乳动物克隆胚胎早期发育仍存在很多缺陷,结合表观遗传修饰敲除XIST 的体细胞通过SCNT 获得转基因动物的出生率也只有1%~2%[77],这些都制约着基因修饰动物的制备。因此,条件性基因修饰猪的制备目的不能只局限在研究单一基因功能,而是要致力于建立适用多种基因编辑的通用性工具猪,充分发挥每一头基因修饰猪的应用价值,真正实现一猪多能、一猪多用(图6)。基因修饰猪将凭借其与人类更多的相似性、饲养成本相对较低,成为临床前优于啮齿类动物、廉于非人灵长类的、不可或缺的高性价比大动物模型。

Fig.6 Application of conditional gene modification in pigs图6 条件性基因修饰猪的应用

