磁共振T1mapping与T2mapping序列在类风湿关节炎兔模型骨髓水肿中的定量研究*
丁 浩,袁文昭,莫志青,龙娇玲,许 华,曾自三
(广西医科大学第一附属医院放射科,南宁 530021)
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节侵蚀为主要临床表现的慢性自身免疫性疾病,可发生于任何年龄并以30~50 岁为其发病高峰,常以小关节受累为主的对称性、持续性且多发性的关节炎。RA 在病理上表现为滑膜炎、血管翳形成,并逐渐出现关节软骨和骨质破坏,其结局最终是导致关节畸形和功能丧失[1]。有研究表明骨破坏起始于骨髓水肿(bone marrow edema,BME),并且BME是早期诊断RA重要指标之一[2-3]。此外,国内、外类风湿专家认为BME是早期RA影像学上进展的强有力的独立预测因素之一,并且可以作为预后判断的指标[2,4-5]。因此,对BME监测、评价及治疗显得尤为重要。在治疗方面,有学者提出RA 的治疗以影像缓解为目标,而且通过影像可以准确地判断疾病低活跃度或缓解状态[6]。目前磁共振常规的序列虽然可以评估BME情况,但其只是半定量或定性的评价。Mapping技术是一种核磁共振弛豫时间的定量测定技术,主要包括T1maping、T2mapping、T2*mapping及T1ρmapping等,T1mapping及T2mapping分别测定纵向弛豫时间、横向弛豫时间[7]。目前T1mapping 及T2mapping 序列已应用于心脏、关节软骨等部位成像研究[8-9]。俞顺等[10]研究认为T1mapping、T2mapping可以定量评价骶髂关节BME,并且有较高的诊断效能。因此,本研究拟在动物模型上运用T1mapping 及T2mapping 序列探索其在BME治疗过程中定量评估的可能性,以期在疾病监测或治疗过程方面对临床有一定的帮助。
1 材料与方法
1.1 试剂
鸡卵蛋白粉、完全弗氏佐剂(美国,Sigma),甲醛溶液,石蜡、苏木精—伊红(HE)染色剂、乙醇溶液、戊巴比妥钠(上海源叶生物科技有限公司)。
1.2 动物及其分组
购买6个月龄雌雄不限新西兰大白兔16只,体重约2.5~3.0 kg,专人单笼饲养,喂养于广西医科大学实验动物中心。实验动物分为对照组及模型组,对照组行假造模而不治疗,模型组用于治疗。实验最后获得6 只兔/12 例膝关节(对照组)、10 只兔/20 例膝关节(模型组)纳入本研究。本研究方案经广西医科大学第一附属医院伦理委员审核通过(No.2021-KY-E-316)。
1.3 方法
1.3.1 RA模型组及对照组制备 根据鸡卵蛋白诱导兔关节炎造模方案[11],将卵蛋白干粉用生理盐水配置成浓度为20 mg/mL 的溶液后,与等量完全弗氏佐剂进行乳化,反复震荡搅拌混匀,至二者不再分层形成乳白色胶状液体。用注射器抽取1 mL 鸡卵蛋白乳浊液于家兔肩胛背部皮下分5个注射点注入,每周1次,连续4周,随后1周分别于双膝关节腔内注射0.4~0.5 mL鸡卵蛋白溶液作关节诱发,并在随后2~4周行膝关节扫描,评判有无BME,如无则重复造模流程直至出现BME并纳入模型组,对照组则采用等量的生理盐水行假造模,而不作治疗。
1.3.2 RA 模型组治疗方案 参考国内RA 治疗指南用药方案[4]对RA 兔模型进行治疗。将醋酸泼尼松龙(PA)粉末用生理盐水配置成浓度为10 mg/mL混悬液,甲氨蝶呤(MTX)粉末用生理盐水配置成浓度为30 mg/mL 混悬液,每千克体重剂量10 mg;PA连续14 d 经兔耳缘静脉静推1 mL(10 mg/mL),而MTX 于第1 天及第14 天臀部肌注1 mL/次(30 mg/mL),共2次,如磁共振BME监测未能达标,则再重复治疗流程,直至获得满意的磁共振图像。
1.4 MR扫描方案
扫描前将线圈放置于扫描床的头侧中央部,使线圈中心线与扫描床中心线相重合。兔麻醉后,将兔以头先进位、仰卧位放置于线圈平托内并固定好,双膝并拢屈曲约30~45°,髌骨正面朝上行磁共振扫描。
1.5 扫描仪器、线圈与扫描序列
西门子磁共振3.0T Prisma magneton,8 通道动物专用线圈(苏州众志医疗有限公司,江苏);扫描序列包括FS-TSE-T2WI、T1mapping 与T2mapping序列,各序列扫描方位均为矢状位。T2WI-TSE-FS相关参数:TR=3 810 ms,TE=76 ms,averages=4,层厚=2 mm,层间距=0 mm,矢状位FOV=60 mm×80 mm。T1mapping 图由B1Map-T1-mapping、T1Mapanatomical 序列扫描组合计算后产生,其序列参数分别为:B1Map-T1-mapping:TR=5 310 ms,TE=1.83 ms,FOV=200 mm×200 mm,层厚8.0 mm,间隔4.0 mm;T1Map-anatomical:TR=15 ms,TE=2.27 ms,翻转角分别为5°、14°、22°、30°,FOV=60 mm×80 mm,层厚=2.0 mm,层间距=0 mm。T2mapping伪彩图由T2Map-anatomical 序列扫描产生,扫描序列参数为:FOV=60 mm×80 mm,层厚=2.0 mm,层间距=0 mm,TR=1 000 ms,TE=13.8 ms、27.6 ms、41.4 ms、55.2 ms、69.0 ms。
1.6 影像数据后处理
将FS-TSE-T2WI、T1mapping、T2mapping 矢状位图像上传至西门子后处理工作站。利用西门子后处理软件在FS-TSE-T2WI序列上从右侧至左侧、由外及内侧依次观察兔股骨远端骨骺区及勾画感兴趣区(ROI),勾画的范围为股骨骨骺皮质下部分,尽量避开骨皮质及干骺线,并将ROI 区复制至T1mapping、T2mapping 图相同定位层面上,即测量出相应ROI的T1mapping、T2mapping值。
1.7 BME影像评分标准
根据FS-TSE-T2WI 序列图像,参照RA 磁共振成像评分系统(rheumatoid arthritis magnetic resonance image scoring system,RAMRIS)对模型组动物治疗前、后的股骨远端干骺区进行半定量评分[12-13]:根据水肿占骨体积的比例分为0~3 分,0 分代表无水肿;1分代表体积小于33%的BME;2分代表34%~66% 的BME;3 分代表67%~100%的BME;评分示例图见图1。

图1 兔膝股骨远端干骺区BME模型RAMRIS评分示例图
1.8 标本处理及病理学评估
对获取的兔股骨远端标本脱钙、脱水、组织包埋、蜡块制作,并对蜡块矢状位切片处理及苏木精—伊红染色等。病理学评分参考学国内者孟祥虹等[14]病理切片的分析方法来进行评估。据病理异常表现所占面积与切片面积的比例分为0~3 分,具体如下:病理学表现无异常,为0 分;比例<1/3,为1 分;比例在1/3~2/3间为2分;比例>2/3,为3 分。炎性细胞与破骨细胞浸润为BME 评估异常病理表现的主要内容。
1.9 统计学方法
采用SPSS 25.0软件进行数据统计分析,正态分布资料以均数±标准差(±s)表示,组间比较采用t检验;偏态分布资料以中位数(四分位数间距)表示,组间比较采用非参数检验;相关性检验采用Spearman相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组T1mapping、T2mapping 值比较及其病理情况
对照组(6 只兔/12 例膝关节)、模型组(10 只兔/20 例膝关节)的T1mapping 和T2mapping 定量值见表1。模型组T1mapping 值治疗前高于对照组(P<0.05),且模型组T1mapping值治疗前、后比较,差异具有统计学意义(P<0.05)。模型组治疗前的T2mapping值低于对照组(P<0.05),且模型组治疗后的T2mapping值高于治疗前(P<0.05)。
表1 两组治疗前、后T1mapping、T2mapping值比较ms,±s

表1 两组治疗前、后T1mapping、T2mapping值比较ms,±s
RA 模型治疗前、后的T1mapping、T2mapping及其病理示例图见图2,T1mapping 值治疗后(图2D)较治疗前(图2A)降低,T2mapping值治疗后(图2E)较治疗前(图2B)升高;模型组治疗前破骨细胞、淋巴B细胞浸润(图2C),治疗后破骨细胞及淋巴细胞减少(图2F)。
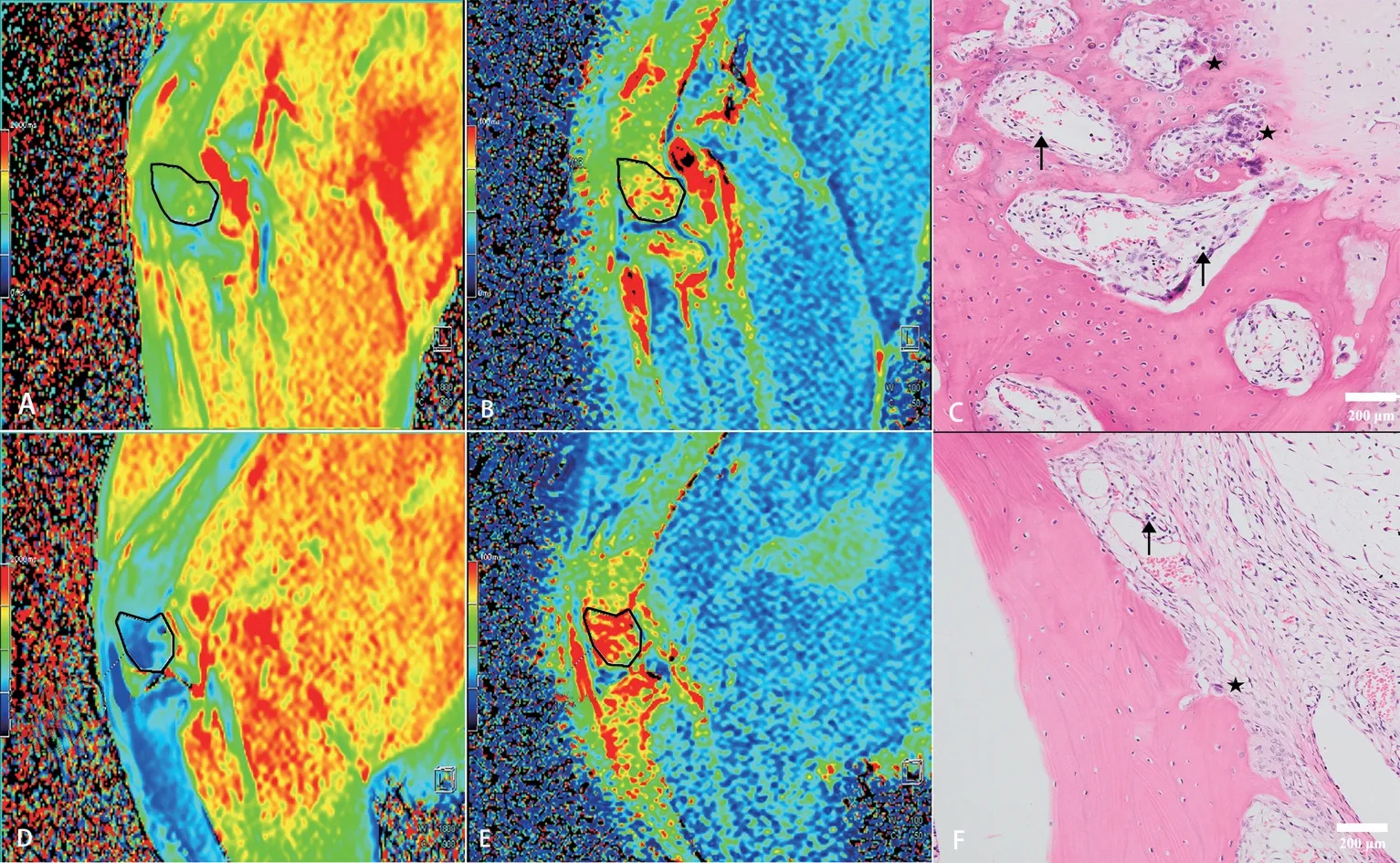
图2 RA模型治疗前、后的T1mapping、T2mapping及其病理示例图
2.2 模型组治疗前、后RAMRIS评分及其比较
模型组治疗前、后的RAMRIS 评分,分别为治疗前1分1例,2分10例,3分9例。治疗后1分11例,2分8例,3分1例,模型组治疗前、后比较,差异具有统计学意义(Z=-3.45,P=0.001)。
2.3 模型组治疗后BME病理评分
模型组治疗后(8 只兔/16 例膝关节)HE 染色病理骨髓评分:0分3例,1分5例,2分5例,3分3例,其中位数和四分位数间距为1.5(1,2)。
2.4 T1mapping、T2mapping值与模型组BME的RAMRIS评分、病理评分相关性分析
模型组治疗前、后的T1mapping 值与RAMRIS评分呈正相关关系(r=0.56,r=0.75,均P<0.05),而T2mapping值与RAMRIS评分无相关性(P>0.05);模型组治疗后的T1mapping 值与BME 病理评分呈正相关关系(r=0.67,P<0.05),模型组治疗后的T2mapping值与BME病理评分呈负相关关系(r=-0.57,P<0.05),见表2。

表2 T1mapping、T2mapping 值与模型组BME 的RAMRIS评分、病理评分相关性分析
3 讨论
在以往的RA影像研究方面主要是侧重于早期诊断[15]或者疗效评价上[16],而在BME上的全定量研究并不多。有学者认为骨髓可能是观察RA病理变化的重要部位,而且BME 关系到软骨损伤、骨侵蚀及RA预后,甚至有些还可以影响炎症表型[2,17]。虽然引起BME 的原因有创伤、骨折、感染、血管源性、关节炎、废用或过度使用等[2,5],但RA 的BME 在病理上有其自身的特点,RA 中磁共振所显示的BME又称为骨炎,BME在自身免疫作用下通过局部释放炎性细胞因子,使富含脂肪的骨髓被淋巴细胞和血管内聚集物所替代[18],从而引起破骨细胞增生、软骨下骨破坏[14,19]。
本研究中RA 动物模型组治疗前的BME 区域相对于对照组T1mapping值升高,经治疗后T1mapping降低(P<0.05),本课题组认为这跟骨髓的主要成分为水与脂肪有关,且由于骨髓中水的T1mapping值明显高于脂肪,当BME区域因存在炎性细胞浸润时,血管通透性增加,水分增多、脂肪细胞被挤占,因而导致T1mapping值升高,经治疗后炎性反应减轻,血管通透性减弱、水分减少,因此T1mapping值降低。在T2mapping值方面,模型组BME区域的T2mapping 值较对照组低,主要是由于在骨髓中水的T2mapping 值较脂肪小[20],当合并水肿时则会导致骨髓区的T2mapping 值相对减少,因此T2mapping 值降低。同时,本研究中模型组治疗后的病理切片中也印证了其中的炎性反应变化。RAMRIS作为业界公认的RA评分系统,T1mapping值与其呈正相关关系,充分说明了T1mapping 序列具有一定的可靠性及临床价值。而T2mapping值虽然在治疗前、后存在差异,但与RAMRIS评分无明显相关性,本课题组认为这可能跟RAMRIS 评分的滞后性和(或)与脂肪、水的T2mapping 值相差不大有关。在模型组治疗后的T1mapping、T2mapping 值与病理评分相关性分析中,2 只兔模型因意外死亡而未能获得其病理组织,故纳入病理相关分析中的模型为8 只/16 例膝,经相关分析结果提示具有相关性,本课题组认为T1mapping及T2mapping值可以定量反映骨髓中水分含量的变化,而且水肿常伴随炎症产生,因而可以间接地反映炎症变化。
本研究运用3.0T 磁共振T1mapping 及T2mapping 序列定量研究了RA 的BME 动物模型治疗过程中疗效评价的可行性,同时获取治疗后的BME病理相互验证。本研究的不足在于模型数量较少,难免会出现抽样误差,且RA 兔模型并不能完全真正地反应人类的RA。
综上,磁共振T1mapping 及T2mapping 序列可以定量评价RA 兔模型的BME,T1mapping 序列可应用于动物RA模型疗效的定量评价。

