全球新型抗肿瘤药物研发进展及趋势
李积宗 张博文 方淑蓓 韩佳 毛开云 江洪波 陈大明


李积宗,中共党员﹑高级工程师,上海市生物医药科技发展中心主任、上海医药行业协会副会长,长期从事生物医药领域科研项目管理、科技成果转化和软课题研究等工作,牵头建设运行上海市生物医药研发与转化功能型平台,熟悉上海生物医药科技创新政策,具有丰富的项目管理和成果转化经验。
通信作者:陈大明,研究员,长期从事生物医药等领域的科技情报研究,创新了基于关联索引的情报研究新方法,揭示了多学科交叉融合演进的范式,构建了用于专利价值和成果转化的评估框架,在软科学研究、知识产权分析、产业情报研究等方面带领团队完成了数十项研究课题,有力支撑了多种决策。
摘要:新型抗肿瘤药物已成功用于规避常规策略的某些局限性,同时提供更高的敏感性和特异性、更高的生物利用度和改善的综合治疗效果。本文总结了过去70年的抗肿瘤药物开发里程碑,综述了基于肿瘤标志性特征的14类抗肿瘤药物开发路径,并且从多学科交叉融合的视角探索了抗肿瘤药物开发中的前景。
关键词:抗肿瘤 药物 多学科研究
中图分类号:R979.1文献标志码:A文章编号:1006-1533(2022)S2-0001-o8
引用本文李积宗,张博文,方淑蓓,等.全球新型抗肿瘤药物研发进展及趋势[J.上海医药,2022,43(S2):1-8.
Noval anti-tumor drugs: global advances and trends
LlJizong' , ZHANG Bowen', FANG Shubei' ,HAN Jia', MAO Kaiyun',JIANG Hongbo , CHEN Daming
( 1.Shanghai Center of Biomedicine Development,Shanghai 201203,China; 2. Shanghai lnformation Center for LifeSciences,Shanghai Institute of Nutrition and Health, Chinese Academy of Sciences ,Shanghai 200031 , China)
ABSTRACT Noval anti-tumor drugs have been successfully employed to circumvent certain limitations of conventionalstrategies while providing higher sensitivity and specificity,greater bioavailability, and improved comprehensive effects fortherapeutic outcomes. This paper summarized anti-tumor drug development milestones in the past seven decades,reviewed anti-tumor drug based therapies accroding to 14 different targeting approaches, and discussed the imperative role of multidisciplinaryresearches that could drive anti-tumor drug developments.
KEY WORDS anti-tumor ; drug; multidisciplinary research
过去数十年来,全球肿瘤治疗巨大需求的拉动力、多种技术融合创新的驱动力,共同推动了全球抗肿瘤药物研发的快速发展。尤其是21世纪以来,分子靶向药物、融合蛋白、单克隆抗体药物、抗体偶联药物(antibody-drug conjugates,ADC)、细胞治疗等类型的抗肿瘤新药层出不穷,蛋白水解靶向嵌合分子(proteolysis-targeting chimera,PROTAC)、双特异性抗体、基因治疗、溶瘤病毒等新型药物研发不断发展。从特异性低、副作用大的化疗药物到靶向性强、毒副作用少的新型抗肿瘤药物,人类的抗肿瘤药物研发取得了长足的进展,也为未来的肿瘤治疗带来了更多的希望。
1抗肿瘤药物的研发历程
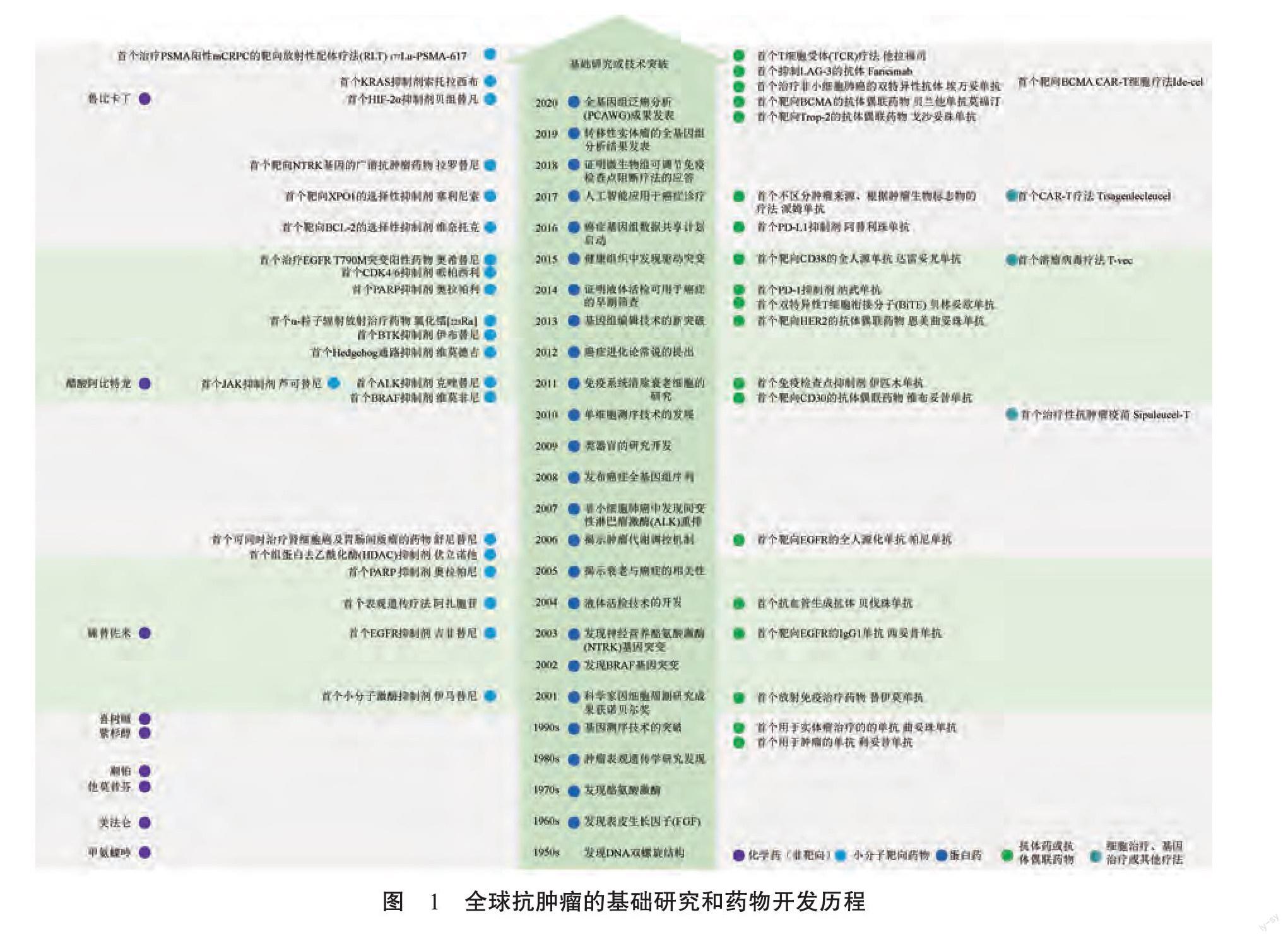
20世纪40年代,人类尝试将氮芥用于治疗肿瘤。自此,人类已将肿瘤治疗的视野,从早期的手术治疗和放射治疗,扩展至化学治疗。此后,人类在化疗药物的开发中发展了烷化剂、天然产物、激素类、铂类药物等多类不同的药物,并在20世纪后期发展出了小分子靶向药物、单克隆抗体药物等类型的抗腫瘤药物。自21世纪以来,人类的抗肿瘤药物研发更是突飞猛进,取得了诸多前所未有的突破(图1)。
纵观全球抗肿瘤药物研发的历程,可以发现抗肿瘤药物研发的重大突破,是偶然性与必然性相结合的结果。之所以有偶然性,是因为机制发现、药物筛选等过程中存在很多的随机因素;之所以有必然性,是因为抗肿瘤药物的研发过程中存在一些共通的规律或经验。
首先,基础研究的重大突破,是新型抗肿瘤新机制新靶点发现的重要驱动力。从1962年发现表皮生长因子(epidermal growth factor,EGF)(到2003年首个表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂吉非替尼(2)的上市,从1964年RAS基因研究发现3到2021年首个KRAS抑制剂索托拉西布(sotorasib)(4]的上市,从1967年雌激素受体的确定[5]到他莫昔芬(tamoxifen)6的上市,从1970年细胞周期发现到2015年首个细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)4/6抑制剂哌柏西利(palbociclib)[8]的上市,从1979年蛋白酪氨酸激酶(protein tyrosine kinase,PTK)研究的突破到受体酪氨酸激酶抑制剂、非受体酪氨酸激酶抑制剂101引领小分子靶向药物的开发,从1971年肿瘤血管形成机制的提出到血管内皮细胞生长因子受体(vascularendothelial growth factor receptor,VEGFR)抑制剂成为热门靶点21,从1980年DNA甲基化机制的发现3到2004年首个表观遗传药物5-阿扎胞苷(5-azacitidine)[14]的上市,从1984年发现肿瘤与细胞凋亡间的B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)关联[15]到2016年首个Bcl-2选择性抑制剂维奈托克(venetoclax)[16]的上市,从1986年发现乳腺癌细胞中人表皮生长因子受体2(human epidermal growvth factor receptor 2,HER2)的过表达到首个用于实体瘤治疗的单克隆抗体药物曲妥珠单抗(trastuzumab)(18]的上市,从1990年乳腺癌1号基因(breast cancer susceptibility gene 1,BRCA1)突变的发现9到用于治疗BRCA突变早期乳腺癌的奥拉帕利(olaparib)的上市,从1992年程序性死亡受体1(programnmed cell death protein 1,PD-1)的发现2到首个PD-1抑制剂纳武单抗(nivolumab)的上市、首个程序性死亡配体1(programmed cell death ligand 1,PD-L1)抑制剂阿替利珠单抗22的上市,肿瘤发生发展相关机制的研究发现一直是源动力。
其次,化学、药学、基因组学、蛋白质组学、免疫学、医学等学科的交叉融合,驱动新药物形式、新药物载体的不断推陈出新。从1975年用杂交瘤生产单克隆抗体的技术突破23到1997年首个用于肿瘤的单抗药物利妥昔单抗2]的上市,从早期的放射免疫技术发展到2001年首个放射免疫治疗药物替伊莫单抗[26]的上市,从20世纪90年代人类基因组计划带动的基因测序技术的发展(27到2017年首个不区分肿瘤来源、根据肿瘤生物标志物的治疗药物派姆单抗的上市128],从20世纪70年代基因重组技术的发展[29]到2010年首个治疗性抗肿瘤疫苗30的上市,从早期的免疫球蛋白与小分子偶联探索3到首个靶向CD30的抗体偶联药物维布妥昔单抗32的上市,从1998年单链抗体(single-chain variable fragments,ScFvs)的发明33]到2014年首个双特异性T细胞衔接分子(bispecific T cell engager,BiTE)贝林妥欧单抗的上市,从1989年T细胞的嵌合抗原受体工程技术创新35到2017年首个嵌合抗原受体T细胞(autologous chimeric antigen receptor T-cell,CAR-T)治疗药物的上市,体现了多学科交叉融合带来的创新赋能。当前,多学科交叉融合正推动反义寡核苷酸(antisenseoligonucleotide,ASO)[37]、小干扰RNA(small interfering RNA,siRNA)[38]、PROTAC[39]、抗肿瘤的mRNA疫苗[40]人工智能药物设计(AI-driven drug design,AIDD)]等技术的发展,而这也正在驱动更新颖的药物创新发展。
再次,人工智能、液态活检、芯片技术等的跨学科运用,提升了抗肿瘤药物的研发效率和成功率,赋能抗肿瘤药物相关的个性化治疗、预后判断等临床应用的发展。人工智能的运用,提升了靶标发现、化合物筛选和药物设计的效率(42),优化了临床研究设计和志愿者招募流程],提升了临床研究和审批效率;液体活检继用于癌症早期筛查45]后,又用于抗肿瘤药物的伴随诊断(companion diagnostic,CDx)[46];下一代测序技术的开发和运用,提升了个性化、精准化用药水平[47]。
2抗肿瘤药物的研发现状
随着研究的发展,人类对于肿瘤的认识越来越深入。21世纪以来,人们先是总结出癌症的6个标志性特征48],进而逐步将其特征增至10个[49]、14个[50]。针对这些特征,已有不少相关的信号通路或代谢通路得到研究,人们在此基础上发现了相关的靶标,近年来也有诸多的新药得到开发(图2)。
1)肿瘤凋亡逃逸相关的研发。生长因子、趋化因子、肿瘤坏死因子、集落刺激因子等细胞因子与其特异性受体结合后,可激活细胞内的信号转导,从而调控细胞的生长、分化,同时也可通过某些通路调控细胞的凋亡。例如,靶向集落刺激因子-1(colony-stimulating factor 1,CSF-1)及其受体(CSF-1R)的依米妥珠单抗(emactuzumab)在用于腱鞘巨细胞瘤治疗的临床试验中,表现出良好的应答率[51]。
2)基因组的不稳定性和突变相关的研发。碱基切除修复(base-excision repair,BER)、核苷酸切除修复(nucleotide excision repair,NER)、错配修复(mis-match repair,MMR)和跨损伤DNA合成主要负责DNA单链断裂(single-strand breakages,SSBs)的修复,对于基因组稳定具有重要的意义。多腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PRAP]作为DNA修复酶的失活、Ras基因(HRAS、KRAS和NRAS)的突变等,均可导致基因组的不稳定。例如,他拉唑帕尼(talazoparib)表现出较强的PARP抑制作用,用于有害(或疑似有害)的BRCA突变(germline BRCAl and/or BRCA2 mutation,gBRCAm)、HER2陰性局部晚期或转移性乳腺癌患者的治疗[52]。
3)细胞衰老相关的研发。细胞衰老是维持稳态的必要条件,衰老相关的分泌表型(senescence associated secretory phenotype,SASP)的激活等多重因素可导致肿瘤微环境的变化。例如,体内雄激素和雌激素的平衡对维持细胞稳态具有重要的作用;瑞卢戈利作为口服的促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)受体拮抗剂(34)、达洛鲁胺作为新一代口服雄激素受体(androgen receptor,AR)抑制剂[55],两者的上市分别为妇科肿瘤、前列腺癌的治疗带来了新选择。
4)促血管生成相关的研发。肿瘤血管生成涉及血管内皮基质降解、内皮细胞增殖等复杂过程,促血管生成相关的靶标是抗肿瘤药物研发的重要方面。例如,替沃扎尼(tivozanib)作为新一代血管内皮生长因子(vascular endothelial growth factor,VEGF)酪氨酸激酶抑制剂,在复发或难治性晚期肾细胞癌中可抑制VEGFR。索拉非尼(sorafenib)可通过抑制VEGFR 阻断肿瘤血管生成,通过抑制丝氨酸/苏氨酸蛋白激酶和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联激酶组成的Ras-MAPK信号通路以抑制肿瘤生长。
5)免疫清除逃避相关的研发。肿瘤免疫编辑是个动态的过程,涉及清除、平衡和逃逸3个阶段。近年来,靶向PD-1/PD-L1[58]、细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte antigen-4,CTLA-4)[59]等多个免疫检查点的新药开发不断推陈出新。
6)多态的微生物组相关的研发。近年来,人体的微生物群与肿瘤发生发展的相关性得到初步的揭示[60],随着未来或也将有越来越多的机制得到阐明,相关药物开发或将进一步深入。
7)肿瘤的促炎症作用相关的研发。上皮间质转化(epithelial-mesenchymal transition,EMT)信号、活性氧4类(reactive oxygen species,ROS)等炎症释放细胞因子,或促进肿瘤的演化。例如,人滋养细胞表面抗原2(trophoblast cell-surface antigen 2,Trop-2)能调节细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)通路下游的细胞周期基因转录,还可能通过钙黏蛋白E表达影响EMT;靶向Trop-2的抗体偶联药物戈沙妥珠单抗(sacituzumabgovitecan)的获批上市,为晚期三阴性乳腺癌(triple negative breast cancer,TNBC)的治疗带来了希望[61]。
8)无限复制潜力相关的研发。端粒、着丝粒和复制原点是保持染色体稳定的必要条件,端粒末端转移酶的活性变化或导致肿瘤细胞复制潜力的变化。近年来,塞尔帕替尼(selpercatinib)作为高度选择性的转染期间重排(rearranged during transfection,RET)激酶抑制剂,其获批为非小细胞肺癌、甲状腺髓样癌的治疗(62)带来了新选择。
9)组织浸润和转移相关的研发。肿瘤的组织浸润和
转移,涉及EMT、间质上皮转化因子(mesenchymal- epithelial transition,MET)、肿瘤相关巨噬细胞(tumor- associated macrophage,TAM)等机制。相关的新药开发实例:那昔妥单抗(naxitamab)作为全球首款获批的人源化神经节苷脂(disialoganglioside,GD2)单克隆抗体[63],为神经母细胞瘤治疗带来了新希望。
10)非突變表观遗传重编程相关的研发。随着单细胞测序等技术的发展,表观遗传重塑在肿瘤进化等过程中的作用得到越来越多的研究。近年来,他泽司他(tazemetostat)作为靶向组蛋白甲基转移酶EZH2的抑制剂[64],为肿瘤表观遗传相关的药物开发带来了新选择。
11)生长抑制逃避相关的研发。抑癌基因缺失等机制可使肿瘤逃避原本应有的生长抑制。近年来,CDK4/6小分子抑制剂瑞博西林(ribociclib)[65]、玻玛西尼(abemaciclib)[66]等的上市,为乳腺癌治疗提供了新选择。
12)持续增殖信号相关的研发。体细胞突变可导致多种下游通路激活,从而导致增殖的负反馈失灵等现象出现。酪氨酸激酶在细胞的信号转导中发挥着重要作用,调控着细胞的生长、分化、死亡,还与肿瘤的浸润、转移、血管生成等密切相关。至今,已有20多类不同家族的受体酪氨酸激酶、非受体酪氨酸激酶得到开发,EGFR、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)、成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)等。多靶点的酪氨酸激酶抑制剂,也成为抗肿瘤药物研发的前沿。例如,舒尼替尼(sunitinib)[67]作为ATP竞争性抑制剂,同时靶向 VEGFR2和 PDGFRβ;凡德他尼(vandetanib)[68]的靶点则包含EGFR、VEGFR和RET。
13)解锁表型可塑性相关的研发。表型可塑性可导致细胞分化的中断,其正常限制若被解除,或将导致肿瘤发生发展。近年来,比美替尼(binimetinib)作为MEK信号通路抑制剂,为黑色素瘤的治疗带来新选择[69]。
14)细胞能量代谢的失控相关的研发。肿瘤细胞的能量代谢得到越来越多的研究,例如低氧诱导因子(HIF)可通过参与多种靶基因的转录调控影响肿瘤细胞的能量代谢。首个HIF-2α抑制剂贝组替凡(belzutifan)的上市,为HIF的开发带来了新希望。
3抗肿瘤药物的研发趋势
总结全球抗肿瘤药物研发的历程,可以发现基础研究、临床研究和临床实践的深入,使得人类对于肿瘤这一疾病的认知越加深入。以此为基础,带来了肿瘤研究的科学技术突破,进而驱动新型抗肿瘤药物的开发体系升级。在此基础上,新药的临床应用、抗肿瘤治疗的演进不断突破,进而又促进了人类对肿瘤疾病认识的深入,从而形成了良性的、可循环的完整抗肿瘤药物开发体系(图3)。
首先,生命科学和生物技术的发展加深了人类对于肿瘤特征的认知,临床研究和临床实践的深入驱动了新机制新靶点的发展。在高选择性、低毒性的靶向药物开发需求面前,细胞周期蛋白依赖性激酶抑制剂、嵌合抗原受体T细胞、表皮生长因子受体、人表皮生长因子受体2等热门靶点成为诸多企业投入的对象;与此同时,随着靶向药物、细胞与基因治疗运用的越来越广泛,研究者发起的临床研究也在向更深的机制、更多的适应证等方面拓展,从而为抗肿瘤的新靶点发现带来了更多可能。
其次,纳米技术、材料技术等的融合运用,促进了新型抗肿瘤药物形式的不断开发。蛋白水解靶向嵌合体、双特异性抗体、抗体偶联药物、治疗性疫苗、溶瘤病毒疗法、细胞与基因治疗等新药物形式的发展,以及脂质体、外泌体、纳米递送等载体的突破,驱动了抗肿瘤的靶点研究不断深入。这些新药物形式的发展,因其更强的特异性、更深入的递送范围等特点,又为人类加深对抗肿瘤调控机制的认知提供了可能。抗体偶联药物可将此前较难开发运用的小分子细胞毒素精准递送至恶性肿瘤细胞,从而在体内研究中深入揭示肿瘤细胞对小分子细胞毒素的应激机制。
再次,人工智能、芯片技术等新技术,以及基于真实世界证据的研究等新模式,提升了抗肿瘤药物的研发效率。在基础研究中,生命组学、基因编辑、单细胞技术、合成生物学、类器官和器官芯片等方面的不断突破,极大加深了人类对于体内环境中肿瘤发生发展等方面的认知,提升了抗肿瘤的候选分子筛选的通量;在临床前研究中,人工智能的运用,已使得部分采用AIDD的候选药物设计效率大幅提升;在临床研究的过程中,真实世界证据(real world evidence,RWE)的运用,一定程度上可弥补随机临床试验(randomised controlled trial, RCT)的局限;生物标志物的运用,使得临床阶段的抗肿瘤药物研发成功率得到了提升70];在临床用药中,基因编辑、人工智能等技术的交叉融合运用,提高了临床前研究的效率以及伴随诊断的准确性。
最后,抗腫瘤药物的研发进展,驱动了临床用药的升级、抗肿瘤治疗的演进。下一代基因测序、液体活检、人工智能等技术的运用,使得联合用药、精准用药、伴随诊断等不断发展,患者生存率进一步提升,预后效果不断改进。
参考文献
[1]CohenS.The stimulation of epidermal proliferation by a spe- cific protein (EGF)[J].Dev Biol,1965,12(3):394-407.6
[2]KrisMG,NataleRB,Herbst RS, et al. Efficacy of gefitinib, an inhibitor of the epidermal growth factor receptor tyrosine kinase,in symptomatic patients with non - small cell lung cancer:a randomized trial[J].JAMA,2003,290(16):2149-2158.
[3]Malumbres M, Barbacid M. RAS oncogenes: the first 30 years[J].Nat Rev Cancer,2003,3(6):459-465.
[4]SkoulidisF,LiBT,DyGK,etal.Sotorasib for lung cancers with KRAS p.G12C mutation[J].N Engl J Med,2021,384(25):2371-2381.
[5]JensenEV,DeSombre ER. Estrogen-receptor interaction: es- trogenic hormones effect transformation of specific receptor proteins to a biochemically functional form[J].Science, 1973,182(4108):126-134.
[6]Jordan VC, Collins MM,RowsbyL,etal.Amonohydroxyl- ated metabolite of tamoxifen with potent antioestrogenic ac- tivity[J].J Endocrinol,1977,75(2):305-316.
[7]BurnsFJ,TannockIF.On the existence of a GO-phase in the cell cycle[J].Cell Proliferat,1970,3(4):321-334.
[8]Turner NC, Ro J, André F, et al. Palbociclib in hormone-re- ceptor-positive advanced breast cancer[J].N Engl J Med, 2015,373(3):209-219.
[9]HunterT,CooperJA.Protein-tyrosine kinases[J].Ann Rev Biochem,1985,54(1):897-930.
[10] Arora A,Scholar EM. Role of tyrosine kinase inhibitors in cancer therapy[J].JPharmacol Exp Ther,2005,315(3):971-979.
[11]Folkman J. Tumor angiogenesis:therapeutic implications[J]. N Engl J Med,1971,285(21):1182-1186.
[12] Ivy SP,WickJY,KaufmanBM.An overview of small-mole- cule inhibitors of VEGFR signaling[J].Nat Rev Clin Oncol, 2009,6(10):569-579.
[13]RazinA,Riggs AD.DNA methylation and gene function[J]. Science,1980,210(4470):604-610.
[14]Kaminskas E, Farrell AT,Wang YC, et al. FDA drug approv- al summary:azacitidine (5-azacytidine, VidazaT) for inject- able suspension[J].Oncologist,2005,10(3):176-182.
[15] Adams JM,CoryS.The Bcl-2 protein family:arbiters of cell survival[J].Science,1998,281(5381):1322-1326.
[16]DeeksED.Venetoclax:first global approval[J].Drugs,2016, 76(9):979-987.
[17]SlamonDJ,ClarkGM,Wong SG, et al.Human breast can-cer:correlation of relapse and survival with amplification of the HER-2/neu oncogene[J]. Science,1987,235(4785):177-182.
[18]Goldenberg MM. Trastuzumab, a recombinant DNA-derived humanized monoclonal antibody,a novel agent for the treat-ment of metastatic breast cancer[J].Clin Ther,1999,21(2):309-318.
[19] Ford D,EastonDF,Bishop DT, et al. Risks of cancer in BRCA1-mutation carriers[J].Lancet,1994,343(8899):692-695.
[20] Robson M,ImSA,Senkus E, et al.Olaparib for metastatic breast cancer in patients with a germline BRCA mutation[J]. N Engl J Med,2017,377(6):523-533.
[21] Ishida Y,AgataY,ShibaharaK,etal.Inducedexpression of PD-1,a novel member of the immunoglobulin gene super- family,upon programmed cell death[J]. EMBO J,1992,11(11):3887-3895.
[22] Socinski MAA,Jotte RM, Cappuzzo F,et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC[J]. N Engl J Med, 2018,378(24):2288-2301.
[23] K?hler G,MilsteinC.Continuous cultures of fused cells se- creting antibody of predefined specificity[J].Nature,1975, 256(5517):495-497.
[24]Leget GA, Czuczman MS. Use of rituximab,the new FDA- approved antibody[J]. Curr Opin Oncol, 1998, 10(6):548-551.
[25] Curcio CG,Vasile C, Gianciotta A, et al. Short-term results of combined radioimmunotherapy in inoperable lung cancer [J].Tumori,1976,62(6):587-597.
[26]WitzigTE,FlinnIW,GordonLI,etal.Treatment with ibritu- momabtiuxetan radioimmunotherapy in patients with ritux- imab-refractory follicular non-Hodgkin's lymphoma[J].J Clin Oncol,2002,20(15):3262-3269.
[27] Adams MD,Kelley JM, GocayneJD,etal.Complementary DNA sequencing: expressed sequence tags and human ge- nome project[J].Science,1991,252(5013):1651-1656.
[28] Marcus L, Lemery SJ, Keegan P, et al. FDA approval sum- mary: pembrolizumab for the treatment of microsatellite in- stability-high solid tumors [J].Clin Cancer Res,2019,25(13):3753-3758.
[29] Lehman IR.DNA Ligase: structure,mechanism,andfunc- tion:the joining of DNA chains by DNA ligase is an essen- tial component of DNA repair. replication,andrecombina- tion[J].Science,1974,186(4166):790-797.
[30]KantoffPW,Higano CS, Shore ND, et al.Sipuleucel-T im- munotherapy for castration-resistant prostate cancer[J].N Engl J Med,2010,363(5):411-422.
[31]PouillartP,WeinerR,SchwarzenbergL,etal.Combination chemotherapy based on a model of cell recruitment by par- tial synchronization[J]. Med Pediatr Oncol,1975,1(2):123-134.
[32] Younes A,BartlettNL,Leonard JP, et al. Brentuximab vedo-tin (SGN-35) for relapsed CD30-positive lymphomas[J].N Engl J Med,2010,363(19):1812-1821.
[33] Bird RE,HardmanKD,Jacobson JW, et al.Single-chain an- tigen-binding proteins[J]. Science,1988, 242(4877):423-426.
[34]PrzepiorkaD,KoCW,Deisseroth A, et al. FDA approval:blinatumomab[J]. Clin Cancer Res,2015,21(18):4035-4039.
[35] Lin AY,Devaux B, Green A,et al. Expression of T cell anti- gen receptor heterodimers in a lipid-linked form[J].Science, 1990,249(4969):677-679.
[36]Neelapu SS, TummalaS,KebriaeiP,et al. Chimeric antigen receptor T-cell therapy-assessment and management of tox- icities[J].Nat Rev Clin Oncol,2018,15(1):47-62.
[37] Le BT,Raguraman P,Kosbar TR,et al. Antisense oligonucle-otides targeting angiogenic factors as potential cancer thera-peutics[J].MolTher Nucleic Acids,2019,14:142-157.
[38] Subhan MA,TorchilinVP.Efficient nanocarriers of siRNAtherapeutics for cancer treatment[J].Transl Res,2019,214:62-91.
[39] He S, Gao F, Ma J, et al.Aptamer-PROTAC conjugates(APCs) for tumor-specific targeting in breast cancer[J].An- gew Chem Int Ed Engl,2021,60(43):23299-23305.
[40] Bajan S,Hutvagner G. RNA-based therapeutics:from anti- sense oligonucleotides to miRNAs[J]. Cells,2020,9(1):137.
[41]Mak KK, Pichika MR. Artificial intelligence in drug devel-opment:present status and future prospects[J].Drug Discov Today,2019,24(3):773-780.
[42] Chan HCS, Shan H, Dahoun T, et al.Advancing drug discov-ery via artificial intelligence[J]. Trends Pharmacol Sci, 2019,40(8):592-604.
[43]AngusDC.Randomized clinical trials of artificial intelli- gence[J].JAMA,2020,323(11):1043-1045.
[44]SongL,JiaY,RanS,et al. Current situation of pediatric clin- ical trials in China: focus on trials for drug marketing appli- cation and administrative approval[J]. BMC Pediatr,2022, 22(1):1-9.
[45] Yoshioka Y, Kosaka N, Konishi Y, et al. Ultra-sensitive liq-uid biopsy of circulating extracellular vesicles using Exo- Screen[J].Nat Commun,2014,5(1):1-8.
[46]Ignatiadis M, Sledge GW,Jeffrey SS. Liquid biopsy entersthe clinic-Implementation issues and future challenges[J] Nat Rev Clin Oncol,2021,18(5):297-312.
[47]ColomerR,MondejarR,Romero-LaordenN,etal.Whenshould we order a next generation sequencing test in a pa-tient with cancer?[J].EClinicalMedicine,2020,25:100487.
[48] Hanahan D,WeinbergRA.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[49]HanahanD,Weinberg RA. Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[50] Hanahan D. Hallmarks of cancer:new dimensions[J].Can- cer Discov,2022,12(1):31-46.
[51] Cassier PA,Italiano A, Gomez-Roca C, et al. Long-term clin- icalactivity,safety and patient-reported qquality of life for emactuzumab-treated patients with diffuse-type tenosynovi- al giant-cell tumour[J].Eur J Cancer,2020,141:162-170.
[52] Litton JK,RugoHS,Ettl J, et al. Talazoparib in patients with advanced breast cancer and a germline BRCA mutation[J]. N Engl J Med,2018,379(8):753-763.
[53] Mirzakhani K, Kallenbach J, Rasa SMM, et al. The andro- gen receptor-IncRNASAT1-AKT-p15 axis mediates andro- gen-induced cellular senescence in prostate cancer cells[J]. Oncogene,2022,41(7):943-959.
[54]ShoreND,SaadF,CooksonMS,etal.Oralrelugolix for an- drogen-deprivation therapy in advanced prostate cancer[J]. N Engl J Med,2020,382(23):2187-2196.
[55]FizaziK,ShoreN,TammelaTL,etal.Darolutamide in non- metastatic,castration-resistant prostate cancer[J].N Engl J Med,2019,380(13):1235-1246.
[56] Rini BI, Pal SK,Escudier BJ, et al. Tivozanib versus sorafenib in patients with advanced renal cellcarcinoma (TI- VO-3):a phase 3,multicentre,randomised,controlled,open- label study[J].Lancet Oncol,2020,21(1):95-104.
[57] Tang W, Chen Z, Zhang W, et al.The mechanisms of sorafenib resistance in hepatocellular carcinoma:theoretical basis and therapeutic aspects[J].Signal Transduct Target Ther,2020,5(1):1-15.
[58] Yu JX, Hodge JP, Oliva C, et al. Trends in clinical develop- ment for PD-1/PD-L1 inhibitors[J].Nat Rev Drug Discov, 2020,19(3):163-164.
[59]CoutzacC,Jouniaux JM, Paci A, et al. Systemic short chainfatty acids limit antitumor effect of CTLA-4 blockade in hosts with cancer[J].Nat Commun,2020,11(1):1-13.
[60]HelminkBA,KhanMA,HermannA,etal.The microbiome, [J]cancer,and cancer therapy[J]. Nat Med,2019,25(3):377-388.
[61]BardiaA,MayerIA,VahdatLT,etal.Sacituzumabgovite-can-hziy in refractory metastatic triple-negative breast can- cer[J].N Engl J Med,2019,380(8):741-751.
[62]Bradford D, Larkins E, Mushti SL, et al. FDA approval sum- mary:selpercatinib for the treatment of lung and thyroid can- cers with RET gene mutations orfusions[J].Clin Cancer Res,2021,27(8):2130-2135.
[63]MarkhamA.Naxitamab: first approval[J].Drugs,2021,81(2):291-296.
[64] Hoy SM.Tazemetostat:first approva1[J].Drugs,2020,80(5):513-521.
[65]Im SA, Lu YS, Bardia A,et al. Overall survival with riboci- clib plus endocrine therapy in breast cancer[J]. N Engl J Med,2019,381(4):307-316.
[66] Kim ES. Abemaciclib: firstglobal approval[J].Drugs,2017,77(18):2063-2070.
[67]Méjean A, Ravaud A, Thezenas S, et al. Sunitinib alone or after nephrectomy in metastatic renal-cell carcinoma[J].NEngl J Med,2018,379(5):417-427.
[68] Ramos HE,HechtF,Berdelou A, et al.Long-term follow-upand safety of vandetanib for advanced medullarythyroid cancer[J].Endocrine,2021,71(2):434-442.
[69]Lugowska I, Rogala P. Encorafenib and binimetinib[M]//Rutkowski P, Mandalà M. New therapies in advanced cuta- neousmalignancies.Switzerland:SpringerCham Interna- tional Publishing,2021:167-177.
[70] Parker JL, Kuzulugil SS, Pereverzev K, et al. Does biomark-er use in oncology improve clinical trial failure risk? A large- scale analysis[J].Cancer Med,2021,10(6):1955-1963.
(收稿日期:2022-08-29)

