长链非编码RNA RP11-490M8.1对脂多糖诱导的人脐静脉内皮细胞炎症的影响*
刘雪辉, 吴丽美, 刘达彬, 李志海, 刘华森, 伍绍国△, 胡炎伟
1广州市第十二人民医院检验科(广东广州 510620); 2广州市妇女儿童医疗中心检验部(广东广州 510623)
动脉粥样硬化(atherosclerosis,AS)是一种影响大、中型动脉的慢性炎症性疾病,是冠心病、心肌梗死、外周血管病等心血管疾病的主要病因,病死率逐年上升且发病人群趋于年轻化。AS发病机制非常复杂,伴随着内皮细胞损伤、炎症反应、脂肪斑块形成、平滑肌细胞增殖和单核细胞迁移。内皮细胞功能障碍是心血管疾病的发病机制,一些来自AS病变内活化细胞的促炎细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)导致内皮细胞功能障碍。研究表明炎症在AS的发生和发展中起着关键作用[1-2]。许多因素可以刺激血管内皮细胞的损伤。例如,死亡的内皮细胞可以释放促炎细胞因子,从而放大炎症反应。反过来,炎症因子的释放会导致细胞的堆积和坏死,堆积的细胞逐渐形成具有坏死核心的AS斑块。有研究表明通过抑制IL-6、TNF-α、核因子-κB(NF-κB)等促炎因子可对AS有积极的影响[3]。脂多糖(lipopolysaccharide,LPS)又称内毒素,是革兰阴性菌细胞壁的外膜成分。外源性脂多糖被吸收到血液中会导致内皮细胞损伤和炎症细胞分泌细胞因子,引起炎症反应,这是炎症的重要病理因素[4]。然而,目前LPS诱导炎症的分子机制尚不清楚。长链非编码RNA(lncRNA)是一类长度超过200个核苷酸的缺乏蛋白质编码功能的RNA。它虽然不能编码蛋白质,但它能通过染色体修饰、干扰mRNA的剪切、影响miRNA的功能、与mRNA结合并影响其翻译等方式在许多疾病[5-6],特别是AS中起着关键作用[7-9]。lncRNA-NEXN AS1通过调节肌动蛋白结合蛋白(NEXN)减缓AS的发展[10]。有文献报道lncRNA CDKN2B-AS1通过抑制ADAM10表达降低AS中的炎症反应并促进胆固醇外流[11]。lncRNA-FA2H-2抑制MLKL的表达,减轻炎症反应,对AS起保护作用[12]。上述报道表明lncRNA与炎症、AS之间存在紧密联系。尽管已有很多lncRNA被发现,但在了解lncRNA在AS中的具体作用机制方面仍不够深入和详细。我们发现LncRNA RP11-490M8.1在AS斑块中的表达显著下调。它是位于染色体2p22.3上的一个366 kb的长链非编码RNA。目前鲜见LncRNA RP11-490M8.1关于AS的报道。为此,我们于2019年1月至2020年6月就LncRNA RP11-490M8.1在AS中的相关作用进行了初步探究。
1 材料与方法
1.1 细胞来源 人脐静脉内皮细胞系购自美国模式菌种收集中心(American Type Culture Collection,ATCC库)。本研究经广州市第十二人民医院医学伦理委员会审批同意[第(2022026)号]。
1.2 主要试剂和耗材 实时荧光定量PCR试剂盒购自上海立菲生物技术公司,含有绿色荧光蛋白的空LV载体(LV mock)和含有GFP荧光的过表达LncRNA RP11-490M8.1的慢病毒载体(LV-LncRNA RP11-490M8.1)购自上海和元生物科技有限公司,高糖培养基(Dulbecco′s Modified Eagle′s Medium,DMEM)和胎牛血清(fetal bovine serum,FBS)购自上海 Gibco公司,多克隆兔抗IL-6(YT5348)和TNF-α(YT4689)均购自美国ImmunoWay生物技术公司,多克隆兔抗 核因子-κB(NF-κB,AF5006-50)购自加拿大Affinity生物制品公司,内参tubulin抗体及兔二抗购自美国 Santa公司,0.25% EDTA-胰酶、青霉素-链霉素双抗、脂多糖(lipopolysaccharide,LPS)均购自广州一骏生物制品有限公司,细胞培养皿、冻存管、离心管、6孔板均购自美国康宁(corning)公司,引物合成及测序均由上海生工生物工程有限公司完成,本研究所用引物序列见表1。

表1 荧光定量PCR引物序列
1.3 内皮细胞的培养和加药干预 在DMEM中添加10%FBS和双抗(100 U/mL青霉素和100 mg/mL链霉素),于37℃、5%CO2的培养箱中培养24~48 h,观察细胞生长汇合度达到80%~90% 时传代。传代后培养4~6 h,观察细胞贴壁良好,换液,根据实验设计加入LPS干预或转染慢病毒载体。浓度梯度干预处理方法:加入不同浓度LPS(0、250、500、1 000 ng/mL)到内皮细胞,培养48 h,用于后续实验。时间梯度干预处理方法:加入1 000 ng/mL LPS到内皮细胞,分别培养0、12、24、48 h,在特定时间点收集细胞用于后续实验。
1.4 慢病毒载体与细胞转染 构建含有绿色荧光蛋白GFP的空载体(LV-mock)和含有GFP的慢病毒介导的lncRNA RP11-490M8.1过表达载体(LV-RP11-490M8.1)。脐静脉内皮细胞(HUVECs)以2×106个细胞/孔的密度接种于6孔细胞培养板中,分为4组进行干预:(1)慢病毒空载体对照组(对照组,LV-MOCK):慢病毒空载体(LV-MOCK)转染内皮细胞培养24 h;(2)慢病毒空载体加LPS(LV-MOCK +LPS): LV-MOCK转染内皮细胞培养6 h,加1 000 ng/mL的LPS培养18 h;(3)慢病毒过表达组(LV-RP11-490M8.1):LV-LncRNA RP11-490M8.1转染内皮细胞培养24 h;(4)LncRNA RP11-490M8.1过表达加LPS(LV-RP11-490M8.1+LPS):LV-LncRNA RP11-490M8.1转染内皮细胞培养6 h,加1 000 ng/mL的LPS培养18 h。HUVECs在添加10%FBS、抗生素(100 U/mL青霉素和100 mg/mL链霉素)和2 μg/mL嘌呤霉素的DMEM中培养2周以获得稳定表达株。实时荧光定量PCR(qRT-PCR)检测LncRNA RP11-490M8.1的表达水平和转染效率,转染成功后进行后续实验。
1.5 免疫印迹(western blot)试验检测蛋白表达水平 收集各组细胞,在含有蛋白酶和磷酸酶抑制剂的放射免疫沉淀缓冲液中裂解,提取总蛋白。BCA法测定蛋白浓度,取50 μg总蛋白和上样缓冲液混合,煮沸15 min使其变性。用SDS-PAGE凝胶电泳分离总蛋白,转移到PVDF膜上,室温下用5%脱脂奶粉封闭2 h,4℃下用一抗于摇篮孵育过夜,用TBST 缓冲液洗膜3次,加入辣根过氧化物酶(HRP)标记兔二抗(稀释度1∶5 000)孵育2 h,用TBST 缓冲液洗膜3次,用ECL发光液显色,并用ImageJ软件进行条带分析,计算IL-6、TNF-α、NF-κB的蛋白相对表达量。
1.6 实时荧光定量PCR(qRT-PCR)检测mRNA表达水平 收集各组细胞,采用Trizol法提取细胞总RNA,检测其浓度,按反转录试剂盒说明书进行反转录。以反转录产物cDNA为模板进行实时荧光定量PCR扩增,以mRNA扩增以GAPDH、LncRNA扩增以U6为内参,用2-ΔCt法计算lncRNA RP11-490M8.1、IL-6、TNF-α、NF-κB的RNA相对含量。每次试验均重复检测3次。
2 结果
2.1 LPS对内皮细胞炎症因子IL-6、TNF-α、NF-κB的mRNA和蛋白水平的影响 我们检测浓度梯度LPS对内皮细胞的影响,qRT-PCR和western blot结果显示LPS能显著上调IL-6、TNF-α、NF-κB的mRNA和蛋白质表达。IL-6和NF-κB在1 000 ng/mL浓度上调最明显(P<0.05),而TNF-α在500 ng/mL干预浓度上调最明显(P<0.01),其对LPS的敏感度较IL-6和NF-κB明显。其次,我们检测LPS时间梯度对内皮细胞的影响,qRT-PCR和western blot结果显示LPS能显著上调IL-6、TNF-α、NF-κB的表达(P<0.05)。见表2~3,图1。
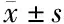
表2 各组细胞的IL-6、TNF-α、NF-κB mRNA相对表达结果
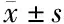
表3 各组细胞的IL-6、TNF-α、NF-κB 蛋白质相对表达结果
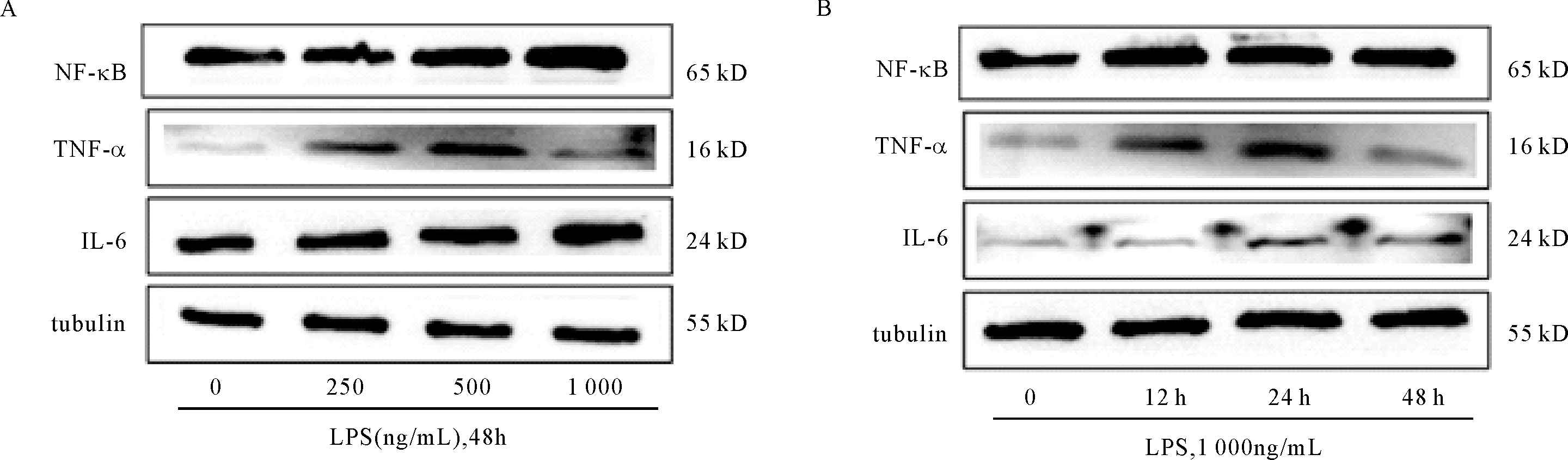
注:内参tubulin为微管蛋白;A:0、250、500、1 000 ng/mL的LPS作用于内皮细胞48 h;B:1 000 ng/mL的LPS分别作用于内皮细胞0、12、24、48 h
2.2 LPS对LncRNA RP11-490M8.1表达的影响 基因芯片分析结果显示LncRNA RP11-490M8.1在AS斑块中显著下调(P<0.000 1),本研究结果显示LncRNA RP11-490M8.1的表达水平能被LPS抑制,在1 000 ng/mL浓度下调最明显(P<0.01)。另外,研究结果显示LncRNA RP11-490M8.1的表达水平能时间依赖地被LPS抑制,在48 h处下调最明显(P<0.01),见表4。于是选取1 000 ng/mL和48 h作为后续研究的浓度和时间。
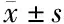
表4 各组细胞的LncRNA RP11-490M8.1表达水平检测结果
2.3 慢病毒过表达LncRNA RP11-490M8.1对炎症因子IL-6、TNF-α、NF-κB的mRNA和蛋白水平的影响 研究结果表明,与LV-MOCK对照组相比,过表达组的LncRNA RP11-490M8.1上调113倍(112.96±3.35vs.1,P<0.001),说明转染成功,获得稳定表达株可用于后续实验。qRT-PCR和western blot结果显示IL-6、TNF-α、NF-κB的mRNA和蛋白水平随着LncRNA RP11-490M8.1的过表达而明显下调(P<0.05)。见表5、图2。
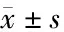
表5 内皮细胞转染慢病毒后IL-6、TNF-α、NF-κB的表达水平
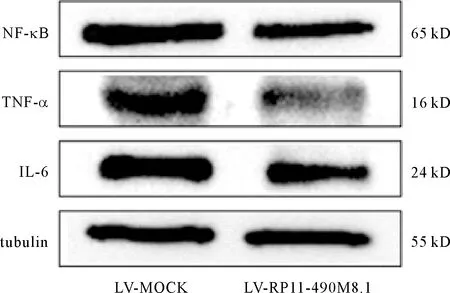
图2 内皮细胞转染慢病毒后IL-6、TNF-α、NF-κB的蛋白表达水平
2.4 过表达LncRNA RP11-490M8.1对LPS所致炎症因子的影响 与对照组相比,加LPS组的炎症因子的mRNA和蛋白质表达水平明显下调(P<0.05),加过表达组的炎症因子表达下调,这与前面研究结果相符(P<0.05),LPS诱导的炎症因子上调程度能被过表达LncRNA RP11-490M8.1抑制,与对照组相比差异无统计学意义(P>0.05),回到正常水平。见表6、图3。
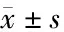
表6 分组干预后IL-6、TNF-α、NF-κB的mRNA和蛋白表达水平

注:A:LV-MOCK; B:LV-RP11-490M8.1; C:LV-MOCK +LPS; D:LV-RP11-490M8.1+LPS
3 讨论
AS是一种动脉壁脂质滞留引起的慢性炎症性疾病,血管内皮细胞在AS的早期炎症反应中起重要作用。NF-κB是一种调节免疫应答的转录因子,是炎症反应的介质[13]。当NF-κB在炎症反应中被激活时,它从细胞质转移到细胞核,然后充当转录因子,导致炎症相关基因(TNF-α、IL-6)表达增加[14]。IL-6是一种多效性细胞因子,与先天免疫和适应性免疫有关,调节急性期反应和慢性炎症。在斑块破裂的情况下,IL-6水平升高,高水平的促炎细胞因子IL-6一直被认为是AS疾病发展和并发症的危险因素[15]。在炎症早期,TNF-α被认为是一个能促进炎症负反馈的关键细胞因子[16]。TNF-α促进各种炎症细胞的分化和增殖[17],改变内皮细胞功能,导致血管功能障碍,在AS的发生和发展中起着关键作用。简言之,NF-κB的激活、TNF-α和IL-6的分泌促进AS炎症反应,多项研究表明抑制NF-κB、TNF-α和IL-6表达有助于减缓AS的发展[18-19]。有研究报道LPS刺激单核细胞增加NF-κB基因的表达,并促进人外周血中TNF-α和IL-6的分泌[20]。另外,LPS也可上调动脉血管内皮细胞的IL-6、TNF-α和NF-κB的表达[21]。我们研究的是脐静脉内皮细胞,结果显示LPS能明显上调IL-6、TNF-α和NF-κB的表达,与最新文献报道的结果相符[22]。
长链非编码RNA(LncRNA)在各种疾病的作用机制成为近年来的研究热点,它是一类长度超过200个核苷酸的不具有蛋白质编码功能的RNA,存在于细胞核和细胞质中。LncRNA可与蛋白质、DNA和RNA结合,调节疾病的发生发展和动脉粥样斑块的稳定性[23]。LncRNA SNHG16通过NF-κB信号通路促进巨噬细胞增殖和炎症反应,从而加速AS发展[24]。其次,过表达LncRNA MALAT1能促进炎症细胞因子IL-6和TNF-α的分泌,从而增强内皮细胞的炎症活性[25]。另外,还有文献报道敲除LncRNA OIP5-AS1基因能通过阻断AKT/NF-κB信号通路抑制HUVECs细胞炎症反应[26]。上述研究结果表明LncRNA与炎症因子IL-6、TNF-α和NF-κB存在密切联系。在我们的研究中,发现LPS下调LncRNA RP11-490M8.1的表达,推测LncRNA RP11-490M8.1很可能是LPS诱导炎症的靶标分子。而过表达LncRNA RP11-490M8.1能抑制IL-6、TNF-α和NF-κB的表达,表明LncRNA RP11-490M8.1对炎症因子起负向调控作用。另外,我们还发现过表达LncRNA RP11-490M8.1能减弱LPS诱导炎症因子IL-6、TNF-α和NF-κB的上调程度,上述结果提示LncRNA RP11-490M8.1介导LPS抑制炎症反应,在AS中发挥积极的保护作用。
本课题组通过3对AS斑块组织和正常动脉内膜组织进行基因芯片分析发现LncRNA RP11-490M8.1在AS斑块中的表达水平较正常组织显著下调。因此,我们对LncRNA RP11-490M8.1产生极大兴趣。本文的创新之处是首次探讨在AS疾病中LncRNA RP11-490M8.1与炎症之间的关系。本研究的结果显示,已被普遍认为具有致炎作用的LPS能明显抑制LncRNA RP11-490M8.1表达、促进炎症因子(IL-6,TNF-α,NF-κB)的表达,基因芯片分析结果显示LncRNA RP11-490M8.1在AS内膜组织中的表达显著被抑制。根据我们的研究结果,可推断LncRNA RP11-490M8.1很可能是LPS在AS中发挥促炎作用的靶向分子,为后续研究打下基础。其具体机制有待更深入的研究,且需动物实验加以验证我们的推测。
利益相关声明:本文所有作者共同认可文章,无利益冲突。
作者贡献说明:研究设计为胡炎伟,伍绍国,研究方案执行为刘雪辉,数据整理为刘达彬,统计分析为刘华森,文章撰写为李志海,论文评阅为吴丽美。

