多西他赛对人视网膜色素上皮细胞增殖的抑制作用*
蒋姣姣, 丁芝祥, 邱梅园, 黄岚珍
1桂林医学院附属医院眼科(广西桂林 541001);2桂林医学院科学实验中心(广西桂林 541001)
增生性玻璃体视网膜病变(proliferative vitreo-retinopathy,PVR)是以视网膜色素上皮(retinal pigment epithelium,RPE)细胞、神经胶质细胞、巨噬细胞、成纤维细胞等在视网膜表面、视网膜下和玻璃体腔内发生迁移增殖,增殖膜发展、收缩产生视网膜固定皱褶造成牵拉性视网膜脱离为特征的一种严重眼病[1-2]。RPE细胞既是PVR病变中主要的移行、分裂、增殖细胞,也是PVR膜中主要的细胞成分[3]。目前,手术仍是治疗PVR的标准方法,但手术只能清除病变的增生组织,并不能预防和阻止细胞的增生和迁移,因而PVR复发率较高,故目前倾向于手术联合眼内用药[4]。现阶段研究用于PVR防治的药物主要是有抗炎药、抗肿瘤药、抗生长因子药物等[5]。抗肿瘤药物特殊的抑制细胞生长增殖、抗代谢、促进细胞凋亡等功能使其早用于眼科疾病,如丝裂霉素、5-氟尿嘧啶可明显抑制青光眼滤过手术[6-7]后瘢痕形成,可有效减少翼状胬肉手术[8]的复发;新型抗肿瘤类药物如贝伐单抗、阿柏西普等在眼部新生血管类疾病如角膜新生血管、新生血管性青光眼、年龄相关性黄斑变性、息肉状脉络膜血管病变等疾病中[9-10]得到了很好的应用。而多西他赛(DTX)作为一种以微管为靶点的高效低毒的新型抗肿瘤药物,具有较高的抗肿瘤活性、抗肿瘤血管形成和诱导凋亡作用[11]。目前广泛应用于临床多种肿瘤的治疗,而在眼科领域应用较少,2019年12月至2020年7月我们通过体外培养的细胞作为实验对象,利用DTX特有的促进细胞凋亡的机制,研究其对RPE细胞的增殖抑制作用及其机制,为研究和治疗PVR提供一定的临床理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞和主要试剂 DTX注射液(江苏奥赛康药业有限公司,剂量为0.5 mL:20 mg/支);人RPE-19细胞株(桂林医学院科学实验中心);DMEM培养基、2.5 g/L胰蛋白酶、胎牛血清(美国Gibco公司);四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)、青霉素、链霉素、胰蛋白酶和碘化丙啶(PI)(美国Sigma公司)。
1.1.2 主要仪器 Thermo细胞培养箱(美国Electron Corporation),细胞培养瓶、倒置相差显微镜(日本Olympus/Leica公司)、FACSAriaⅢ流式细胞仪(美国BD公司),酶标仪(瑞士帝肯公司)。
1.2 方法
1.2.1 细胞培养及药物配制 hRPE细胞采用含10%胎牛血清的DMEM培养基在37℃、体积分数为5%的CO2培养箱中培养,2~3 d用胰蛋白酶消化传代1次,取对数生长期的细胞用于实验。
1.2.2 MTT法检测细胞增殖抑制 取对数生长期的细胞胰蛋白酶消化后制成单细胞悬液,调整浓度为2×104·L-1,将细胞接种于96孔板中。设空白对照组、阴性对照组和DTX组(分别为10、20、40、80 μg/mL),空白对照组加入200 μL不含细胞培养液,阴性对照组和DTX组分别加入100 μL细胞悬液,每组设5个复孔,标准条件下培养细胞至贴壁后,去上清液后阴性对照组加入200 μL DMEM培养基,DTX组分别加入不同浓度(10、20、40、80 μg/mL)DTX 200 μL,放入培养箱中继续培养24、48、72 h。药物作用结束后吸出上清液,每孔加入90 μL 培养液和10 μL MTT,培养4 h后,离心去上清液,加入DMSO 100 μL/孔,振荡至结晶完全溶解,在酶标仪490 nm波长处测定各孔吸光度A值,计算细胞增殖抑制率,实验重复3次取平均值。细胞增殖抑制率=(阴性对照组A值-DTX组A值)/(阴性对照组A值-空白对组组A值)×100%。
1.2.3 凋亡细胞的观察 取对数生长期的细胞制成细胞悬液,按每孔1×105个接种于6孔板上,标准条件下培养细胞,设置不同浓度DTX组和空白对照组,待细胞融合至60%后分别加入不同浓度(20、40、80 μg/mL)DTX和相同体积DMEM为空白细胞对照组,继续培养作用48 h后,吸除6孔板上清,PBS洗涤2次,每孔加入37%甲醇,20 min固定,吸除后PBS洗涤1次,再加入DAPI染色5 min,抗淬灭荧光封片液固定盖玻片移入Olympus荧光显微镜下观察细胞凋亡情况。
1.2.4 流式细胞术检测细胞周期 取对数生长期的细胞以10×106·L-1浓度接种于直径为10 cm培养皿中,因MTT法中10 μg/mL DTX对hRPE细胞抑制率较小,细胞贴壁后DTX组加入DTX(20、40、80 μg/mL)200 μL,阴性对照组加入200 μL DMEM培养基,放入培养箱中继续培养24、48 h。24、48 h后分别用胰蛋白酶消化离心后收集细胞,PBS缓冲液洗涤后70%冷乙醇固定过夜。次日去除冷乙醇,PBS缓冲液洗涤后加入0.1 mg/mL RNA酶37℃水浴30 min,加入25 μg/mL PI染色30 min后置于流式细胞仪进行检查分析细胞周期分布,数据采用流式细胞仪自带软件分析G1/G0期、S期和G2/M期细胞比例。
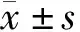
2 结果
2.1 DTX对hRPE细胞增殖的抑制 MTT结果显示,随着DTX浓度的增加,DTX对hRPE细胞的增殖抑制作用明显增强(P<0.05),相同时间点20 μg/mL与10 μg/mL DTX间、40 μg/mL与20 μg/mL DTX间、80 μg/mL与40 μg/mL DTX间差异均有统计学意义(P<0.05);而随着DTX作用于hRPE细胞时间的延长,对其抑制作用稍增强,40 μg/mL、80 μg/mL DTX作用hRPE 72 h与48 h比差异有统计学意义(P<0.05),其余浓度不同时间点两两比较差异均无统计学意义(P>0.05)。当DTX浓度为80 μg/mL作用于hRPE细胞48 h时,细胞增殖抑制达93%,随着药物浓度的增加,DTX能明显抑制hRPE细胞的增殖,其抑制作用呈浓度依赖性。见表1。
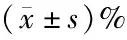
表1 各组不同时间hRPE细胞增殖抑制率
2.2 hRPE凋亡细胞形态学观察 取不同浓度DTX作用于hRPE细胞48 h,染色后置于荧光显微镜下观察,细胞中细胞核或细胞质内出现致密浓染的颗粒状或条索状荧光的凋亡细胞,随着浓度的增加,细胞数明显减少,凋亡细胞数增加,见图1。
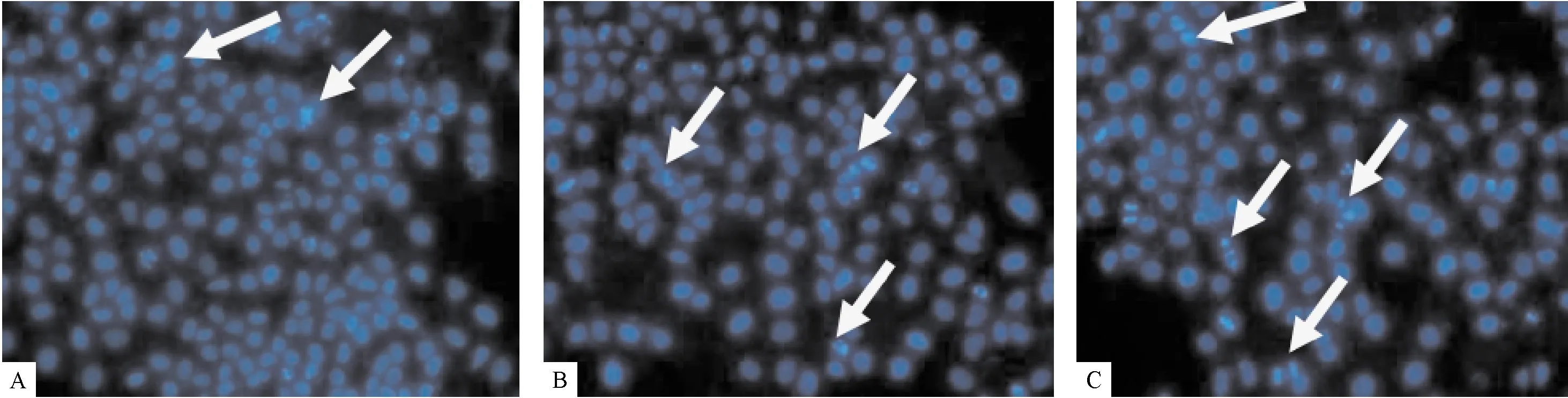
注:A:20 μg/mL; B:40 μg/mL; C:80 μg/mL;白色箭头示:凋亡细胞
2.3 DTX对hRPE细胞周期的影响 流式细胞仪检测显示,加入DTX的hRPE细胞各周期比例发生改变,培养24、48 h的hRPE细胞中G0/G1期、S期细胞比例减少,G2/M期细胞增加,与对照组比较差异有统计学意义(F=223.04,P<0.01;F=724.93,P<0.01);随着浓度增加,G2/M期细胞增加,差异无统计学意义(P>0.01);当DTX浓度为80 μg/mL作用hRPE 48 h时细胞明显阻滞于G2/M期,见表2~3、图2。
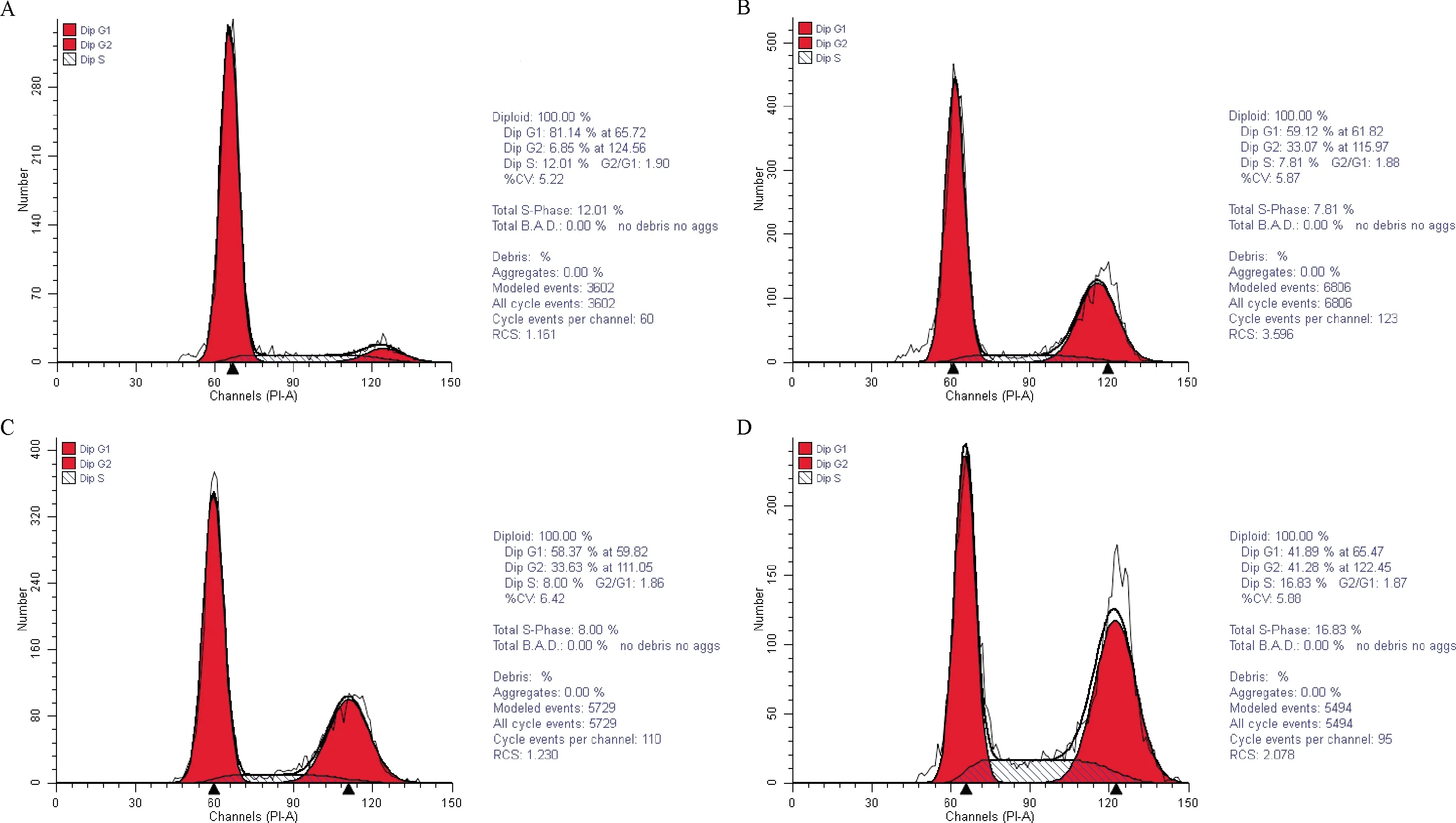
注:A:正常细胞周期曲线; B: 20 μg/mL DTX作用48 h细胞周期曲线; C:40 μg/mL DTX作用48 h细胞周期曲线; D:80 μg/mL DTX作用48 h细胞周期曲线

表2 DTX作用24 h与对照组各期细胞构成比较
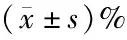
表3 DTX作用48 h与对照组各期细胞构成比较
3 讨论
DTX的前体是从欧洲浆果紫杉的针叶中提取,经半合成而获得的紫杉醇衍生物,属于细胞周期特异性药, 可通过促进微管双聚体装配成微管,同时防止去多聚化过程而使微管稳定,从而抑制细胞有丝分裂和增殖[12]。近年来许多研究证明,DTX可诱导多种肿瘤细胞凋亡,正是由于这种诱导多种细胞凋亡的能力, 使DTX具有特殊的临床疗效。在眼科领域,有学者[13-14]利用DTX抑制晶状体上皮细胞增殖的作用,在白内障摘除术后晶状体囊袋空腔内植入DTX聚合物缓释剂,可很好防治后发性白内障发生,该制剂可持续释药1个月以上。黄金荣等[15]用DTX滴眼液滴用碱烧伤的兔眼,可有效抑制角膜新生血管的增殖,并可减少角膜组织血管内皮生长因子(VEGF)的表达,对眼部新生血管性疾病提供了实验基础。而DTX在眼底PVR的研究方面尚未开展。PVR是眼内RPE细胞、Müller细胞、巨噬细胞、成纤维细胞等增殖、迁移的病理改变过程,RPE细胞被认为在PVR过程中发挥核心作用[4],所以我们利用hRPE细胞为材料,研究DTX对hRPE细胞增殖的抑制和对细胞周期的影响,为PVR治疗提供新的用药途径。
本研究通过不同浓度的DTX作用于体外培养的hRPE细胞,结果表明当DTX浓度大于20 μg/mL时,可抑制hRPE细胞的生长,呈浓度依赖性;20 μg/mL DTX作用hRPE 48 h后观察可见凋亡细胞,并随着浓度增加细胞数明显减少、凋亡细胞增多。流式细胞术显示,加入DTX的hRPE细胞G0/G1期、S期细胞比例减少、G2/M期细胞增加,说明DTX将hRPE细胞阻滞于G2/M期,即该药可调控细胞有丝分裂诱导转折点。随着药物浓度逐渐增加,G2/M期细胞增加不明显,可能与随着浓度增加DTX抑制hRPE细胞增殖同时诱导其凋亡且存在细胞毒性相关。有研究[16]表明,DTX在作用于人脐静脉内皮细胞,低剂量时抑制细胞迁移、较高剂量时抑制细胞增殖、高剂量时出现细胞毒性促进细胞凋亡,DTX是否亦存在低剂量抑制hRPE细胞迁移有待进一步实验论证,这对DTX在眼内通过抑制RPE细胞的迁移而防治PVR发生有重要意义,同时这对于我们探讨最合适浓度DTX抑制RPE细胞增殖、迁移同时具有最小细胞毒性提供实验依据。
抗肿瘤药物的毒性作用抑制了其在体内的应用,为了增加和延长疗效、减少眼内毒性,用于眼部的抗肿瘤药物被制成各种缓释试剂,一部分药物已广泛应用于临床,一部分也已经进入临床试验阶段,但仍需要更深入的基础研究和临床实践,也需要多学科包括药物、化学、材料、眼科的交叉合作,开发出新的安全有效的眼内给药体系。
利益相关声明:所有作者均声明无利益冲突。
作者贡献说明:蒋姣姣直接参与酝酿和设计实验,采集数据,分析解释数据,起草论文,获取研究经费;丁芝祥直接参与酝酿和设计实验并指导;邱梅园直接参与酝酿和设计实验并指导;黄岚珍直接参与酝酿和设计实验,采集数据,分析解释数据并指导。

