腺病毒P53抑制SDF-1/CXCR4信号轴增强裸鼠胰腺癌移植瘤放疗敏感性
吴灶璇 王桂良 徐林芳 邱萍 李兴 文剑波 龚敏

[摘要] 目的 研究重組人腺病毒P53(rHAd-P53)抑制基质细胞衍生因子-1(SDF-1)/C-X-C基序趋化因子受体4(CXCR4)信号轴增强裸鼠胰腺癌移植瘤放疗敏感性的效果。 方法 选用人胰腺癌细胞构建裸鼠移植瘤模型,按随机数字表法将48只裸鼠分为空白组、125I粒子治疗组、rHAd-P53治疗组及rHAd-P53+125I粒子治疗组。测量治疗前后移植瘤体积、瘤重、凋亡指数、SDF-1和CXCR4表达。 结果 与空白组比较,rHAd-P53治疗组的体积增量比、瘤重、增殖指数、SDF-1mRNA和蛋白、CXCR4 mRNA和蛋白均显著性降低,而凋亡指数显著性升高,125I粒子治疗组或rHAd-P53+125I粒子治疗组的体积增量比、瘤重、增殖指数均显著性降低,而抑瘤率、凋亡指数、SDF-1 mRNA和蛋白、CXCR4 mRNA和蛋白均显著性升高;rHAd-P53+125I粒子治疗组的体积增量比、瘤重、增殖指数、SDF-1 mRNA和蛋白、CXCR4 mRNA和蛋白降低最多,而抑瘤率和凋亡指数升高最多。 结论 rHAd-P53和125I粒子均能诱导裸鼠胰腺癌移植瘤凋亡,rHAd-P53能抑制SDF-1和CXCR4的表达而增强125I粒子放疗敏感性。
[关键词] 胰腺癌;125I粒子;腺病毒P53;SDF-1;CXCR4
[中图分类号] R735.2 [文献标识码] A [文章编号] 1673-9701(2022)10-0016-04
[Abstract] Objective To study the effect of recombinant human adenovirus-P53 (rHAd-P53) on inhibiting the signal axis of stromal cell derived factor -1(SDF-1)/C-X-C motif chemokine receptor 4(CXCR4) and enhancing the radiosensitivity of nude mice with pancreatic xenograft tumors. Methods The transplanted tumor model of nude mice was established by using human pancreatic cancer cells, and 48 nude mice were randomly divided into the blank group, rHAd-P53 group, iodine 125 particle group and rHAd-P53+ iodine 125 particle group. The volume and weight of transplanted tumors, apoptosis index, SDF-1 and CXCR4 expression were measured before and after treatment. Results Compared with the blank group, the incremental ratio of volume, tumor weight,proliferation index, SDF-1mRNA and protein, CXCR4mRNA and protein in rHAd-P53 group were significantly decreased, while the apoptosis index was significantly increased. The incremental ratio of volume, tumor weight and proliferation index in iodine 125 particle group or rHAd-P53+ iodine 125 particle group were significantly decreased, while the tumor inhibition rate, apoptosis index and SDF-1mRNA and protein, CXCR4 mRNA and protein of rHAd-P53+ iodine 125 particle group were significantly increased. The incremental ratio of volume, tumor weight, proliferation index, SDF-1 mRNA and protein, CXCR4 mRNA and protein of rHAd-P53+iodine 125 particle group decreased the most, while the tumor inhibition rate and apoptosis index increased the most. Conclusion rHAd-P53 and iodine 125 particle can induce apoptosis of pancreatic xenograft tumors in nude mice. rHAd-P53 can inhibit the expressions of SDF-1 and CXCR4 and enhance the sensitivity of iodine 125 particle radiotherapy.
[Key words] Pancreatic cancer; Iodine 125 particle; Adenovirus P53; SDF-1; CXCR47446B079-CD28-4F0C-9935-95246411BD8B
胰腺癌是恶性程度极高的消化系统恶性肿瘤之一,发病机制复杂,预后差,整体5年生存率仅为6%[1]。近年来研究发现生长因子在胰腺癌的发生发展过程中发挥重要作用,SDF-1是胰腺癌微环境中一种重要的趋化因子,可激活多条下游信号传导通路,参与胰腺癌的发生发展演变进程,调控造血干细胞迁移及归巢、肿瘤的侵袭与转移[2]。125I粒子局部放疗能有效治疗胰腺癌[3],rHAd-P53能有效调节细胞周期、诱导肿瘤细胞死亡、抑制放疗抵抗相关基因,从而提高放疗的敏感性[3]。本研究应用rHAd-P53和125I粒子治疗裸鼠胰腺癌移植瘤,以观察rHAd-P53和125I粒子单独作用及联合作用的效果,现报道如下。
1 材料与方法
1.1 材料
本实验得到南方医科大学附属萍乡医院实验动物伦理委员会的批准,符合国家有关实验动物保护规范和管理条例。本研究时间为2019年12月至2020年12月,BALB/c-nu裸鼠(5~6周龄,体重18~22 g)购自江西中医药大学动物部[许可证号SYXK(赣)2008-2006)],rHAd-P53(1×1012VP/支)购自深圳赛百诺公司,SDF-1蛋白一抗和CXCR4蛋白一抗、GAPDH蛋白一抗从美国Abcam公司购买,125I粒子(粒子活度为0.6 mCi)购自原子高科股份有限公司。
1.2 方法
1.2.1 裸鼠胰腺癌模型制备及治疗方案 取对数生长的人胰腺癌PANC-1细胞(美国ATCC公司)6×107/ml细胞制成单细胞悬液,取0.1 ml接种于裸鼠右腋下,制备皮下移植瘤模型。当瘤体直径达10~15 mm左右时开始实验,将裸鼠随机分为空白组、rHAd-P53治疗组、125I粒子治疗组及;rHAd-P53+125I粒子治疗组,每组各12只。空白组:裸鼠胰腺癌移植瘤内注射0.9%氯化钠注射液0.1 ml,隔天注射1次,共注射6 d。rHAd-P53治疗组:给裸鼠胰腺癌移植瘤内注射rHAd-P53 1×1010VP,隔天1次,共6 d。125I粒子治疗组:18 G穿刺针在距肿瘤边缘10 mm处穿破皮肤,将一粒125I粒子(0.6 mCi)置入穿刺针,改用圆头针芯后将125I粒子推入肿瘤组织内。rHAd-P53+125I粒子治疗组:用穿刺针将1颗125I粒子置入瘤体中央,继之给裸鼠瘤内注射rHAd-P53 1×1010VP,隔天1次,共6 d。
1.2.2 肿瘤体积计算 体积计算公式:体积=0.52×长径×短径×短径;抑瘤率(inhibitory rate,IR)=[(空白组瘤体重-治疗组瘤体重)/空白组瘤体重]×100%。体积增量比=[(治疗后体积-治疗前体积)/治疗前体积]×100%。
1.2.3 细胞增殖和凋亡情况观察 采用免疫组织化学方法检测Ki-67蛋白的表达,用以计算肿瘤细胞增殖指数; 每张切片随机选取5个高倍视野(400×),分别计算肿瘤细胞总数和阳性细胞数,从而得出增殖指数(proliferation index,PI)。PI%=[阳性细胞数/肿瘤细胞总数]×100%。TUNEL法检测细胞凋亡,得出凋亡指数(apoptosis index,AI),AI%=[凋亡细胞数/肿瘤细胞总数]×100%。
1.2.4 Real-time PCP检测SDF-1和CXCR4的表达 设计基因引物序列(表1),由生工生物工程(上海)股份有限公司合成。以β-actin为内对照,配制20 μl的多聚酶链反应体系:加入上游引物0.5 μl,下游引物0.5 μl SYBR Enzyme 10 μl,cDNA 1 μl,无酶水8 μl。PCR反应条件为:95℃预变性 10 min,95℃变性30 s,60℃延伸 1 min,共40 个循环。计算SDF-1和CXCR4的相对表达量。
1.2.5 Western blot免疫印迹法检测SDF-1蛋白和CXCR4蛋白的表达情况 提取组织总蛋白,以10%十二烷基硫酸钠-聚丙烯酰胺胶电泳1 h,使用转移电泳装置,在 4℃、300 mA恒流条件下电转 150 min,将蛋白转移到聚偏二氟乙烯膜上。用含5%脱脂牛奶的TBST 溶液室温封闭1 h,加入一抗(兔抗SDF-1抗体或兔抗CXCR4抗体),4℃孵育过夜;TBST洗膜3次,每次10 min,加入荧光二抗,室温避光孵育1 h,洗膜后滴加适量混匀的超灵敏化学发光(enhanced chemi luminescence,ECL)液,放置在化学显色仪中进行曝光显像。使用Image J软件分析计算各条带灰度值,以目的蛋白与内对照GAPDH蛋白条带的比值分析目的蛋白的相对表达量。
1.3 统计学方法
运用SPSS 22.0统计学软件进行数据分析。计量资料以均数±标准差(x±s)表示,计量资料均符合正态分布且方差齐,组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD法和SNK法。计数资料采用百分率表示,两组间或多组间比较均采用χ2检验(Chi-Squared test),P<0.05为差异有统计学意义。
2 结果
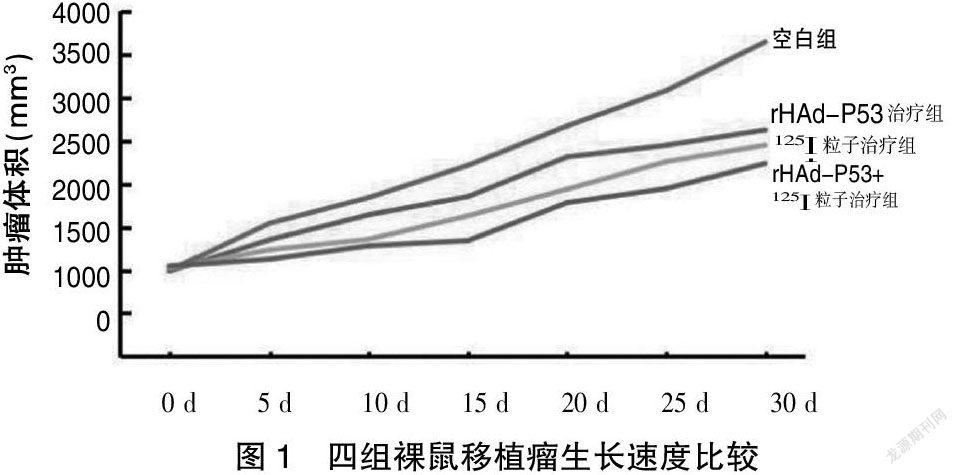
2.1 四组裸鼠移植瘤生长速度比较
四组裸鼠移植瘤体积生长速度趋势为:空白组>rHAd-P53治疗组> 125I粒子治疗组>rHAd-P53+125I粒子治疗组。见图1。
2.2 四组裸鼠移植瘤体积增量比和抑瘤率比较
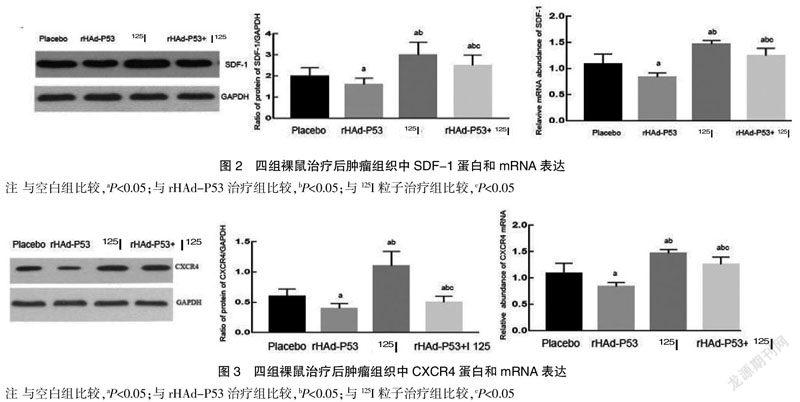
对治疗后第30天体积增量比分析,空白组(6.7±0.3)>rHAd-P53治疗组(3.8±0.2)>125I粒子治疗组(2.0±0.2)>rHAd-P53+125I粒子治疗组(0.9±0.1);空白组、rHAd-P53治疗组、125I粒子治疗组、rHAd-P53+ 125I粒子治疗组瘤重分别为(2.6±0.2)g、(2.0±0.1)g、(1.4±0.1)g、(0.8±0.1)g;抑瘤率分析,rHAd-P53治疗组(21.2%)<125I粒子治疗组(46.8%) 2.3 HE染色检测胰腺癌细胞凋亡 空白组凋亡不明显、rHAd-P53治疗组和125I粒子治疗组及rHAd-P53+125I粒子治疗组凋亡细胞增多。凋亡细胞分析,rHAd-P53治疗组或125I粒子治疗组或rHAd-P53+125I粒子治疗组较空白组显著性增多,rHAd-P53+125I粒子治疗组较125I粒子治疗组增多。见封三图1。 2.4 四组裸鼠治疗后增殖指数与凋亡指数情况比较 对治疗后增殖指数比较,rHAd-P53治疗组或125I粒子治疗组或rHAd-P53+125I粒子治疗组较空白组显著性降低,rHAd-P53+125I粒子治疗组最低;治疗后凋亡指数比较,rHAd-P53治疗组或125I粒子治疗组或rHAd-P53+125I粒子治疗组较空白组显著性增加,rHAd-P53+125I粒子治疗组最高。见封三图2。 2.5 四组裸鼠肿瘤组织中SDF-1mRNA和蛋白表达量比较 对SDF-1 mRNA和蛋白表达量分析,rHAd-P53治疗组较空白组显著性降低,125I粒子治疗组或rHAd-P53+125I粒子治疗组较空白组显著性升高,125I粒子治疗组或rHAd-P53+125I粒子治疗组较rHAd-P53治疗组显著性升高,rHAd-P53+125I粒子治疗组较125I粒子治疗组显著性降低。见图2。 2.6 四组裸鼠肿瘤组织中CXCR4 mRNA和蛋白表达量比较 对CXCR4 mRNA和蛋白表达量分析,rHAd-P53治疗组较空白组显著性降低,125I粒子治疗组或rHAd-P53+125I粒子治疗组较空白组显著性升高,125I粒子治疗组或rHAd-P53+125I粒子治疗组较rHAd-P53组显著性升高,rHAd-P53+125I粒子治疗组较125I粒子治疗组显著性降低。见图3。 3 讨论 胰腺癌恶性程度高、手术机会少,化疗和体外放疗的疗效均不理想[5]。碘125粒子能释放γ射线、破坏DNA双链结构从而杀灭或抑制腫瘤细胞生长[6]。SDF-1与其受体CXCR4结合形成SDF-1/CXCR4轴,参与肿瘤增殖、转移、侵袭、血管生成等过程[7]。rHAd-P53是一种抑癌基因,与放疗联用后能增强放疗的敏感性[8-12]。 本研究中,采用裸鼠胰腺癌移植瘤模型作为研究对象,发现与空白组比较,rHAd-P53组的体积增量比、瘤重、增殖指数、SDF-1 mRNA和蛋白、CXCR4 mRNA和蛋白均显著性降低,而凋亡指数显著性升高,125I粒子治疗组或rHAd-P53+125I粒子治疗组的体积增量比、瘤重、增殖指数均显著性降低,而抑瘤率、凋亡指数、SDF-1 mRNA和蛋白、CXCR4 mRNA和蛋白均显著性升高[13-15];与rHAd-P53治疗组比较,125I粒子治疗组或rHAd-P53+125I粒子治疗组的体积增量比、瘤重、增殖指数均显著性降低,而抑瘤率、凋亡指数、SDF-1 mRNA和蛋白、CXCR4 mRNA和蛋白显著性升高;与125I粒子治疗组比较,rHAd-P53+125I粒子治疗组的体积增量比、瘤重、增殖指数、SDF-1 mRNA和蛋白、CXCR4 mRNA和蛋白均显著性降低,而抑瘤率和凋亡指数显著性升高,说明125I粒子和rHAd-P53均能促进裸鼠胰腺癌移植瘤癌细胞凋亡,125I粒子+rHAd-P53联用后,效果增加[16-18]。由于125I粒子可引起肿瘤细胞死亡以及肿瘤微环境的炎症,在发挥癌细胞杀伤作用的过程中,细胞内多条信号通路被激活、抗凋亡蛋白反馈性表达升高,导致放疗抵抗,其中SDF-1是一个典型的促增殖和抗凋亡蛋白,能与受体CXCR4结合激活下游信号通路,导致一系列效应蛋白发挥促增殖和抗凋亡作用,本研究证明rHAd-P53能抑制SDF-1和CXCR4的表达而增强125I粒子放疗的敏感性。 [参考文献] [1] Mcguigan A,Kelly P,Turkington RC,et al. Pancreatic cancer:A review of clinical diagnosis,epidemiology,treatment and outcomes[J].World J Gastroenterol,2018,24(43):4846-4861. [2] Tamas K,Domanska UM,vandijk TH,et al.CXCR4 and CXCL12 expression in rectal tumors of stage IV patients before and after local radiotherapy and systemic neoadjuvant treatment[J].Curr Pharm Des,2015,21(17):2276-2283. [3] Wang H,Wang J,Jiang Y. The investigation of 125I seed implantation as a salvage modality for unresectable pancreatic Carcinoma[J].J Exp Clin Cancer Res,2013,32(1):106. [4] Su X,Chen WJ,Xiao SW,et al. Effect and safety of recombinant adenovirus-p53 transfer combined with radiotherapy on long-term survival of locally advanced cervical cancer[J].Hum Gene Ther,2016,27(12):1008-1014.7446B079-CD28-4F0C-9935-95246411BD8B [5] Torphy RJ,Fujiwara Y,Schulick RD. Pancreatic cancer treatment:Better, but a long way to go[J].Surg Today,2020, 50(10):1117-1125. [6] Li D,Jia YM,Cao PK,et al. Combined effect of 125I and gemcitabine on PANC-1 cells:Cellular apoptosis and cell cycle arrest[J].J Cancer Res Ther,2018,14(7):1476-1481. [7] Xu Q,Wang Z,Chen X,et al. Stromal-derived factor-1α/CXCL12-CXCR4 chemotactic pathway promotes perineural invasion in pancreatic cancer[J].Oncotarget,2015,6(7):4717-4732. [8] Zhang WW,Li L,Li D,et al.The first approved gene therapy product for cancer rHAd-P53 (Gendicine):12 years in the clinic[J].Hum Gene Ther,2018,29(2): 160-179. [9] 中國抗癌协会胰腺癌专业委员会.胰腺癌综合诊治指南(2018版)[J].中华外科杂志,2018,56(7):481-494. [10] Fujitaita T,Satoh T,Timme TL,et al.Combined therape- utic effects of adenoviral vector-mediated GLIPR1 gene therapy and radiotherapy in prostate and bladder cancer models[J].Urol Oncol,2014,32(2):92-100. [11] Wang ZM,Lu J,Zhang LY,et al.Biological effects of low-dose-rate irradiation of pancreatic carcinoma cells in vitro using 125I seeds[J].World J Gastroenterol, 2015, 21(8):2336-2342. [12] Hu Y,Qi E,Liu F,et al.The application of a three-dimensional visualized seed planning and navigation systemin 125I seed implantation for pancreatic cancer[J].Onco Targets Ther,2018,11:619-627 [13] Ma DM,Luo DX,Zhang J.SDF-1/CXCR7 axis regulates the proliferation,invasion, adhesion,and angiogenesis of gastric cancer cells[J].World J Surg Oncol,2016,14(1): 256. [14] Wang D,Jiao C,Zhu Y,et al.Activation of CXCL12/CXCR4 renders colorectal cancer cells less sensitive to radio therapy via up-regulating the expression of survivin[J].Exp Biol Med (Maywood),2017,242(4):429-435. [15] Li YF,Liu ZQ,Zhang YS,et al.Implantation of radioactive 125I seeds improves the prognosis of locally advanced pancreatic cancer patients:A retrospective study[J].J Huazhong Univ Sci Technolog Med Sci,2016,36(2):205-210. [16] Li J,Pan J,Zhu X,et al.Recombinant adenovirus-rHAd-P53(Gendicine) sensitizes a pancreatic Carcinoma cell line to radiation[J].Chin J Cancer Res, 2013,25(6):715-721. [17] Xu YH,Liu SH,Han FR,et al.Recombinant adenovirus rHAd-P53 combined with radiotherapy improves efficacy and safety in the treatment of head and neck lymphoma[J].Cancer Biomark,2018,23(2):213-220. [18] Shi Y,Riese DJ,Shen J.The role of the CXCL12/CXCR4/CXCR7 chemokine axis in cancer[J].Front Pharmacol,2020, 11:574 667. (收稿日期:2021-04-08)7446B079-CD28-4F0C-9935-95246411BD8B

