食用槟榔废弃籽的活性成分提取及抗氧化、α-葡萄糖苷酶抑制活性分析
张培月,唐敏敏,宋 菲,刘 璨,陈 华,3,
(1.华中农业大学食品科学技术学院,湖北武汉 430070;2.中国热带农业科学院椰子研究所,海南文昌 571339;3.海南省槟榔产业工程研究中心,海南文昌 571339)
槟榔是一种棕榈科常绿乔木植物的果实,可药用和食用[1]。全球槟榔生产与消费有3000年历史,目前,世界上有十分之一的人嚼食槟榔[2-3]。在我国,槟榔主要有两种食用方式,一种是鲜食,即把槟榔鲜果切开后,包上涂有贝壳粉的蒌叶直接嚼食;另一种食用的是加工后的槟榔干果[4]。海南省是我国槟榔种植规模最大的省份,2019年末全省槟榔面积超过11.51万 hm2,总产量超过28.70万吨,槟榔已成为海南230万农民的主要经济来源[5]。湖南省是我国食用槟榔的主要加工省份,加工食用槟榔已成为中国食品加工的一大产业,其消费已经遍布全国各地,2019年全国槟榔产业年产值超过400亿元,带动物流、包装、食品添加剂等相关产业产值超500亿元[6]。槟榔废籽由槟榔鲜果经过多个加工工艺加工后切开除籽而来,据统计,食用槟榔每年加工剔除的槟榔籽多达35000吨,被剔除的槟榔籽一般被当做废弃物处理,基本被焚烧,甚至丢弃,既污染环境,又造成了资源浪费。
槟榔含有多种活性成分,对于槟榔中多酚[7-8]和生物碱[9-10]等活性成分的功效功能已有较多研究。槟榔碱是槟榔的主要药用成分之一[11]。有研究表明,一定含量的生物碱可以增加小鼠脑中乙酰胆碱的浓度,激活下丘脑-垂体-肾上腺皮质轴[12],改善老年性痴呆症[13],明显地增强小鼠肠道和离体肠蠕动,兴奋胃肠道平滑肌,影响离体豚鼠回肠自发收缩,槟榔碱还可在一定程度上对抗血栓形成[14],抗炎[11]和抑制骨质疏松[15]。也有研究指出,槟榔生物碱有致口腔粘膜下纤维性变、损害神经系统和生殖系统等的作用[16]。黄酮类化合物被证明有抗氧化的作用[17-18],韩林等发现未经加工的槟榔籽提取物具有抗氧化活性,且抗氧化活性的大小与总酚的含量及组成有关[19],宋菲等认为未经加工的槟榔籽多酚提取物具有降血糖功能[20],张璐等检测到经初加工的槟榔籽提取物具有抗氧化能力[21],而对于槟榔废籽的活性成分含量、抗氧化活性和降血糖功能的系统研究较少。
因此,本文以食用槟榔废籽为研究对象,以75%乙醇为提取溶剂进行超声辅助提取,测定了其总多酚、总黄酮、原花青素含量及槟榔生物碱等活性成分,检测了部分黄酮组分,并且利用体外抗氧化评价体系和降血糖评价体系对其进行抗氧化能力和降血糖能力研究,以期为槟榔废弃籽的开发利用提供理论参考。
1 材料与方法
1.1 材料与仪器
槟榔废弃籽 某食用槟榔加工企业提供;L-抗坏血酸(维生素C) 上海麦克林生化科技有限公司;没食子酸、芦丁和儿茶素等标准品、α-葡萄糖苷酶(来源于酿酒酵母,14.5 U/mL) 西格玛奥德里奇(上海)贸易有限公司;1,1-二苯基-2-苦基肼(DPPH)、阿卡波糖 北京索莱宝科技有限公司;2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS+) 上海阿拉丁生化科技有限公司;对硝基苯基-α-D-吡喃葡萄糖苷(P-nitrophenyl-α-D-glucopyranoside,PNPG)上海源叶生物科技有限公司;其他试剂均为分析纯国药集团化学试剂有限公司。
A11BS25 高速中药粉碎机 德国IKA 公司;ALLPSE-40 超声波清洗机 深圳市超艺达科技有限公司;AL204-IC 电子天平 梅特勒-托利多仪器(上海)有限公司;DK-98-11A 电热恒温水浴锅 天津市泰斯特仪器有限公司;Varioskan Flash 全波长多功能酶标仪 美国 Thermo 公司;MVA15G0014 紫外可见分光光度计 翱艺仪器(上海)有限公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;DP-406DG 真空冷冻干燥机 无锡德普仪器制造有限公司;ExionLC AD超高效液相、QTrap 6500高灵敏度质谱 美国应用生物系统公司。
1.2 实验方法
1.2.1 槟榔废弃籽活性物质提取 清除杂物后,将槟榔废籽60 ℃低温烘干,然后用高速中药粉碎机粉碎,以75%的乙醇作为提取溶剂,超声辅助提取。料液比1:10 (g/mL),超声波频率40 kHz,提取3次每次30 min,400 目纱布过滤,合并滤液,1500 r/min,离心30 min,收集上清液,低温旋蒸除去乙醇后冷冻干燥。取适量提取物溶于甲醇,得到200 mg/mL的储备液,过0.20 μm的微孔滤膜后存于-20 ℃备用。
1.2.2 活性成分含量测定
1.2.2.1 总多酚含量的测定 总多酚含量的测定采用福林酚氧化法[22]。在波长765 nm处测定吸光值,用甲醇溶液作为空白对照,以浓度C(Y,μg/mL)对吸光值(X)作图,得到没食子酸的标准曲线。没食子酸浓度C=86.966×A765-7.0379,R2=0.9987。样品按照相同的方法测定其吸光值,总多酚含量以每克提取物中的没食子酸含量计。
1.2.2.2 总黄酮含量的测定 总黄酮含量的测定采用亚硝酸钠-硝酸铝法[22]。在波长510 nm处测吸光值,用甲醇溶液作为空白对照,以浓度C(Y,μg/mL)对吸光值(X)作图,得到芦丁的标准曲线。芦丁浓度C=296.84×A510-15.207,R2=0.9987。样品按照相同的方法测定其吸光值,总黄酮含量以每克提取物中的芦丁含量计。
1.2.2.3 原花青素含量的测定 原花青素含量的测定采用香草醛-盐酸法[23],于暗处反应30 min,然后在波长510 nm处测吸光值,用甲醇溶液作为空白对照,以浓度C(Y,μg/mL)对吸光值(X)作图,得到儿茶素的标准曲线。儿茶素浓度C=415.1×A510-15.304,R2=0.9994。样品按照相同的方法测定其吸光值,原花青素含量以每克提取物中的儿茶素含量计。
1.2.2.4 黄酮类化合物组分测定 黄酮类化合物组分测定测定参照文献[24]。
黄酮类化合物提取:取10 mg PSE加入5 mL离心管,加入2000 μL提取液A(75%甲醇含1%乙酸)涡旋30 s后冰水浴超声60 min后,12000 r/min离心15 min;取1500 μL上清液氮气吹干,加入1500 μL提取液B(50%甲醇含0.1%甲酸)复溶;涡旋30 s后冰水浴超声15 min,12000 r/min离心15 min;取上清于2 mL进样瓶上机检测。
色谱条件:色谱柱:ACQUITY ULC BEH C18色谱柱(1.7 μm×21 mm×150 mm);柱温箱温度设为40 ℃,自动进样器温度设为8 ℃,进样体积为2 μL。液相色谱流动相,A:0.1%甲酸水溶液;B:100%乙腈;总流速为300 μL/min;流动相B梯度洗脱程序为:0~0.50 min,0%~10%;0.51~15.00 min,10%~60%;15.01~18.00 min,60%~98%;18.01~20.00 min,98%~10%。
质谱参数:数据采集时,以多反应监测(MRM)模式进行质谱分析。离子源参数如下:离子喷雾电压,+5000/-4500 V;气帘气压力,35 Psi;温度,500 ℃;离子源气体压力1,55 Psi;离子源气体压力2,60 Psi。
1.2.3 抗氧化能力的测定
1.2.3.1 DPPH清除率测定 参照文献[25],在暗处反应20 min后用酶标仪在波长492 nm处测吸光值。以甲醇作为空白对照,以VC溶液作为阳性对照,按照以下公式计算清除率:

式中:A样品为样品与DPPH 反应后的吸光值,A对照为样品本身的吸光值,A空白为DPPH本身的吸光值。
1.2.3.2 ABTS+自由基清除率测定 参照文献[25],取10 μL不同浓度的样品与200 μL 0.1 mmol/L的ABTS自由基工作液添加到96微孔板中,用酶标仪测在734 nm处测吸光值。以甲醇作为空白对照,VC溶液作为阳性对照,按照以下公式计算清除率:
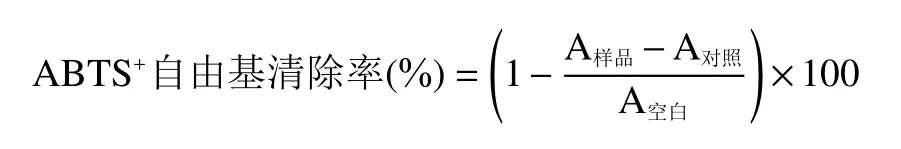
式中:A样品为样品与ABTS反应后的吸光值,A对照为样品本身的吸光值,A空白为ABTS本身的吸光值。
1.2.3.3 还原力测定 参照文献[26],取1 mL样品,先后向其中加入2.5 mL pH6.6的磷酸盐缓冲液,2.5 mL 1%铁氰化钾溶液,混匀,于50 ℃水浴20 min,加入2.5 mL 10%三氯乙酸以及0.5 mL 0.1%三氯化铁,混匀,静置10 min,于700 nm测吸光值,以超纯水为空白调零,VC溶液为阳性对照,吸光值越高,表明抗氧化效果越好。
1.2.4α-葡萄糖苷酶活力抑制试验 参照文献[27],取0.4 mL浓度为0.04 U/mL的α-葡萄糖苷酶溶液(由0.1 mol/L的pH6.8磷酸盐缓冲溶液稀释配制而成)和不同浓度的样品于试管中,37 ℃水浴5 min,然后加入0.2 mL物质的量浓度为0.5 mmol/L的pNPG溶液,混匀,37 ℃水浴反应30 min后加入0.5 mL物质的量浓度为0.2 mol/L的Na2CO3溶液终止反应。室温静置5 min后,于波长405 nm处测吸光值。如表1所示,以适当浓度的阿卡波糖溶液作为阳性对照,以磷酸盐缓冲溶液作为空白调零。每组作3次平行重复,取平均值,按照以下公式计算清除率:

表1 α-葡萄糖苷酶活力抑制试验反应体系Table 1 Experimental reaction system of α-glucoside enzyme vitality inhibition experimental reaction system

式中:A0、A1、A2、A3分别表示空白对照管、样品管、样品对照管、对照管的吸光值。
1.3 数据处理
所有试验数据均为3次平行试验,测试结果以平均值±标准偏差来表示。用Excel 2019 软件和SPSS 26.0软件处理数据。
2 结果与分析
2.1 生物活性物质含量分析
2.1.1 生物活性物质总含量 由表2可知,PSE的总多酚含量为(127.29±5.16) mg/g,总黄酮含量较高,为(421.84±13.82) mg/g,而且含有一定的原花青素,其含量为(87.83±6.60) mg/g。

表2 槟榔废弃籽中总多酚、总黄酮和原花青素的含量Table 2 Total polyphenols, total flavonoids and progesterone content in processed betel nut seeds
由于提取方法的不同,所得样品中的槟榔生物活性成分的含量也有所不同。张丹等[28]以海南9月份的新鲜槟榔果为试验材料,用70%的乙醇提取后又分别萃取了其乙酸乙酯部位和正丁醇部位,槟榔提取物乙酸乙酯部位总多酚含量(7.47±0.047) mg/g和总黄酮含量(121.25±1.25) mg/g均大于正丁醇部位的总多酚含量(4.91±0.034) mg/g和总黄酮含量(34.07±0.88) mg/g,均小于本试验PSE的总多酚含量(127.29±5.16) mg/g和总黄酮含量(421.84±13.82)mg/g。而唐敏敏等[29]通过对成熟槟榔果的槟榔籽研究得出,总多酚和原花青素的含量从大到小依次为:正丁醇部位>乙酸乙酯部位>乙醇提取物>水相>石油醚部位,总黄酮含量从大到小依次为:乙酸乙酯部位>水相>正丁醇部位>乙醇提取物>石油醚部位。
另外,不同的加工方法对活性物质的影响也有所不同。袁源等[25]对经过不同炙法加工方式的槟榔果皮进行了研究,结果表明:经过不同炙法加工后总黄酮的含量、总酚和鞣质的含量均高于空白组(获得新鲜果皮后不进行任何加工,只低温烘干而来),其中空白组总黄酮含量为(3.76±0.62) mg/g,总酚含量为(3.91±0.78) mg/g。总黄酮含量以姜炙法得到的样品最高,其含量为(6.96±0.36) mg/g,酒炙法次之,其含量为(5.50±0.47) mg/g,干炙法和甘草炙法稍好,其含量分别为(4.29±0.81)和(4.12±0.93) mg/g。总酚含量也以姜炙法得到的样品最高,其含量为(8.54±0.69) mg/g,其他加工方法所得提取物的总酚含量从高到低依次是酒炙法,其含量为(7.53±0.41) mg/g,干炙法,其含量为(5.18±0.32) mg/g,甘草炙法,其含量为(4.77±0.62) mg/g。鞣质含量的趋势与总黄酮和总酚一致。
2.1.2 黄酮类化合物组分相对含量测定 黄酮类化合物(flavonoids)又名类黄酮,泛指2个芳香环(A环和B环)通过中央3个碳原子联接而成的一系列化合物,基本骨架为C6-C3-C6。黄酮类化合物分为二氢黄酮(2H-flavanones)、黄酮(flavones)、异黄酮(isoflavones)、黄酮醇(flavonols)、黄烷醇(flavanols)和花色素六大类(anthoyanidins)[30-31]。对多种细菌、真菌、病原体等致病微生物有抑制作用[32],同时具有扩张血管、降糖降脂、美白等功效,有较高的实用开发价值[33]。由表2可知,总黄酮的含量最高,为明确PSE中各黄酮类化合物组分的相对含量,本实验筛选了86种黄酮类化合物作为标准品,对PSE中的黄酮类化合物组分进行靶向定性鉴定。结果表明,从PSE中共鉴定出44种黄酮类化合物,表3列出了20种相对含量大于0.10%的黄酮类化合物,其中儿茶素的含量最高,为77.27%,其次为表儿茶素(8.53%)、原花青素 B1(4.66%)、原花青素 B2(3.45%)等。原花青素又称缩合单宁,其基本组成单元被称为单倍体,一般指儿茶素和表儿茶素[34],已有研究表明这些物质具有多种药理活性,是天然的自由基清除剂和抗氧化剂,具有抗衰老、抗辐射、抗肿瘤、抗癌变,预防心脑血管疾病,预防动脉粥样硬化等功能[35-36]。

表3 PSE中的类黄酮组分相对含量Table 3 Relative contents of flavonoids in PSE
2.2 抗氧化能力
2.2.1 对DPPH自由基的清除作用 由图1可以看出,在实验浓度范围内,PSE对DPPH自由基的清除能力与浓度呈正相关,即随着浓度的增加而增强。从总体上看,在任何一个相同浓度下,阳性对照VC的清除能力均强于PSE。当浓度范围是0~1000 μg/mL时,PSE的DPPH自由基清除率随浓度急剧增大,随后再增加浓度,清除自由基的能力基本不变。当浓度范围是10~200 μg/mL时,PSE和VC清除DPPH自由基的能力相差越来越大,然后随着浓度的增加,两者清除效率的差距逐渐变小,最终趋于不变。PSE的DPPH自由基清除能力(IC50值为(310.10±0.62)μg/mL)弱于阳性对照组VC(IC50值为(177.53±0.89)μg/mL),约是VC的二分之一,且具有显著性差异(P<0.05)。
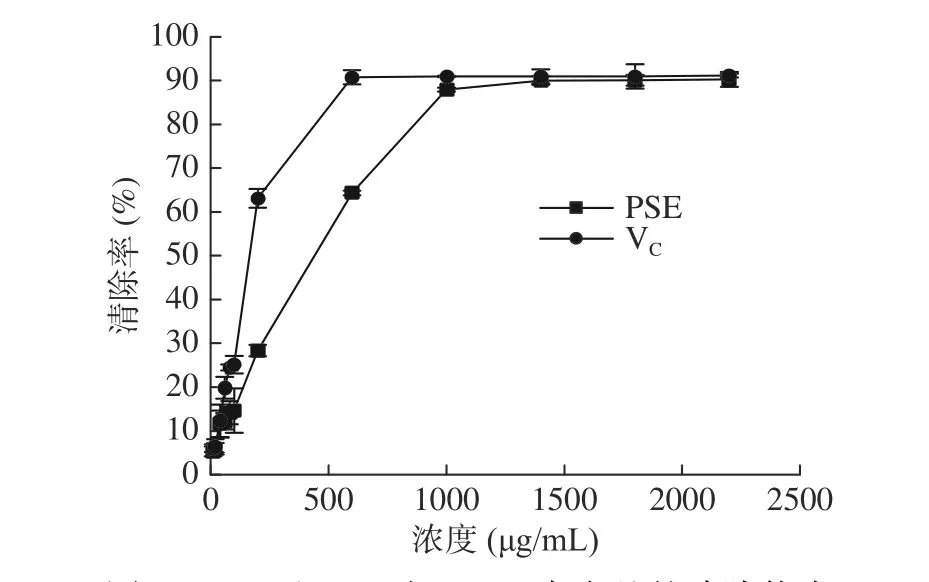
图 1 PSE和VC对DPPH自由基的清除能力Fig.1 Ability to scavenge DPPH radicals of PSE and VC
Lin等[37]评价了产于海南槟榔果的种子清除DPPH自由基能力,结果显示,当提取物浓度为200 μg/mL时,对DPPH自由基的清除率为60.37%。而本试验的PSE浓度为200 μg/mL时,对DPPH自由基的清除率为28.34%。由此可以看出,槟榔废弃籽虽然清除DPPH自由基能力相对较弱,但是仍然拥有一定的清除能力。张丹等[28]研究结果表明,新鲜槟榔籽乙酸乙酯部位和正丁醇部位均有一定的DPPH自由基清除能力,IC50值分别为14.60和44.32 μg/mL,均强于本试验PSE的DPPH自由基清除能力(IC50值为310.10 μg/mL)。
由以上结果可以看出,不同的提取方法和不同的萃取部位均会对槟榔的清除DPPH自由基的能力产生不同程度的影响。新鲜槟榔在被加工成食用槟榔的过程中需要经过多个加工环节,而杀青、发籽等工艺的高温和浸泡的工艺条件对槟榔籽中的抗氧化成分造成了流失或分解,从而使PSE的抗氧化作用相对减弱。
2.2.2 对ABTS+自由基的清除作用 由图2可以看出,在实验浓度范围内,PSE对ABTS+自由基的清除能力与浓度呈正相关,即随着浓度的增加而增强。从总体上看,在任何一个相同浓度下,阳性对照VC的清除能力均强于PSE。当浓度范围是0~200 μg/mL时,PSE对ABTS+自由基清除率均随浓度的增大而急剧增大,随后再增加浓度,清除率几乎不变,当浓度是600 μg/mL时,PSE对ABTS+自由基的清除能力几乎达到100%。PSE的ABTS+自由基清除能力(IC50值为(150.10±11.57) μg/mL)弱于阳性对照组VC(IC50值为(64.12±2.55) μg/mL),约是VC的二分之一,且具有显著性差异(P<0.05)。

图 2 PSE和VC对ABTS+自由基的清除能力Fig.2 Ability to scavenge ABTS+ radicals of PSE and VC
Lin等[37]对产于海南槟榔果的种子清除ABTS+自由基能力进行了研究,当浓度为100 μg/mL时,PSE对ABTS+自由基的清除率为42.20%。本实验结果表明,当提取物浓度为100 μg/mL时,对ABTS+自由基的清除率为45.27%,与本实验PSE对ABTS+自由基的清除能力差异不大。由此可见,加工后的槟榔籽与鲜果的槟榔籽相比,对ABTS+自由基的清除能力几乎没有减弱。而且,加工后的槟榔籽对ABTS+自由基的清除能力(IC50值为(150.10±11.57) μg/mL)相比于对DPPH自由基的清除能力(IC50值为310.10 μg/mL)较强。
2.2.3 还原Fe3+的能力 还原能力与抗氧化活性有一定的相关性,因此还原能力的测定常用于评价抗氧剂活性,而且这种方法的测定结果反映的不是针对某一种自由基的清除效果,而是被测物的总抗氧化能力,已经被应用于测定多种抗氧化物质[38]。抗氧化剂将铁氰化钾中的三价铁还原为二价铁离子,二价铁离子进一步生成普鲁士兰,其在700 nm处有最大吸收波长。因此在700 nm下的吸光值越高,表明该抗氧化剂的还原力越高,抗氧化性越强。由图3可以看出,在实验浓度范围内,PSE的还原能力总体低于VC,但是两者相差不大,尤其是200~2200 μg/mL的浓度范围内。由图3可以看出,在10~200 μg/mL浓度范围内,随浓度的增加,两者的还原能力相差较大,VC的还原能力明显强于PSE,但是当浓度超过200 μg/mL时,在浓度相同的条件下,两者的还原能力差距变小,且随后差距基本维持不变。这个结果与DPPH以及ABTS自由基的清除能力测定结果相同,进一步说明了测定结果的可靠性。

图 3 PSE和VC的还原能力Fig.3 Reducing power of PSE and VC
2.3 对α-葡萄糖苷酶活力的抑制作用
由图4可知,PSE和阳性对照阿卡波糖对α-葡萄糖苷酶的活性均有抑制作用,PSE的抑制能力(IC50值为(90.10±1.89) μg/mL),强于阳性对照阿卡波糖(IC50值为(453.60±4.02) μg/mL)两者的降血糖能力具有显著差异(P<0.05)。另外,在实验浓度范围内,PSE和阳性对照阿卡波糖对α-葡萄糖苷酶的抑制作用随着浓度的增大而增大。

图 4 PSE和阿卡波糖对α-葡萄糖苷酶活性的抑制作用Fig.4 Inhibition of PSE and acarbose on α-glucosidase activity
宋菲等[39]对新鲜槟榔的种子进行了酶活力抑制试验,结果表明,槟榔籽提取物和阳性对照阿卡波糖的IC50值分别为(1.50±0.31)和(710±0.09) μg/mL。由此可见,虽然相对于未加工的新鲜槟榔籽来说,加工后的槟榔籽对α-葡萄糖苷酶的抑制作用有所减弱,但是仍然具有一定的抑制作用,有开发成为降血糖药物的潜能。
3 讨论
槟榔原果的主要成分为31.1%的酚类,18.7%的多糖,14.0%的脂肪,10.8%的粗纤维,9.9%的水分,3.0%的灰分和0.5%的生物碱[40],槟榔中的多酚类物质主要是黄酮醇,包括10%的儿茶素,2.5%的表儿茶素和12%的无色花青素,其余的是不同聚合度的黄酮类化合物。槟榔经过加工其组分会发生不同程度的变化[41]。本次试验研究结果表明,食用槟榔加工废弃籽富含总多酚、总黄酮、原花青素等多种活性物质,其含量受提取材料、提取方法以及加工方式的影响,含有大量的黄酮类化合物,其中儿茶素的相对含量高达77.27%。经过初步检测,PSE中各生物碱的含量为槟榔碱:(13.75±0.04) mg/g;槟榔次碱:(3.82±0.82) mg/g;去甲基槟榔碱:(4.82±0.07) mg/g;去甲基槟榔次碱:(3.98±0.10) mg/g。而槟榔生物碱是否对废籽提取物的生物活性产生影响,是正面的还是负面的,需要体内试验进一步研究。本试验测定出槟榔废弃籽具有一定的抗氧化能力,能够对DPPH自由基和ABTS+自由基在一定程度上进行清除,对Fe3+具有一定的还原能力,而且还表明槟榔废弃籽具有较强的α-葡萄糖苷酶抑制能力,其对α-葡萄糖苷酶活力抑制的IC50值为(90.10±1.89) μg/mL,显著(P<0.05)强于阳性对照阿卡波糖,槟榔废弃籽具有被开发为治疗糖尿病药物的潜力。综上所述,对食用槟榔废弃籽进行回收,进而再加工利用是十分必要的,且对环境保护有重要意义。然而对于槟榔废弃籽的抗氧化和降血糖的具体机制还需要进一步探索。

