苹小吉丁自然种群肠道微生物多样性*
贾斐然 周忠福 赵文霞 孙荟荃 姚艳霞
(国家林业和草原局森林保护学重点实验室 中国林业科学研究院森林生态环境与自然保护研究所 北京 100091)
新疆野苹果(Malussieversii)也称塞威氏苹果,是第三纪孑遗植物,为现代栽培苹果的祖先(林培钧等, 2000); 在我国境内主要分布于新疆巩留至新源的南部低山,霍城至伊宁的北部低山; 这些地区主要为1 200~1 600 m的阴坡、半阴坡以及河谷地带,并与哈萨克斯坦中亚山地野苹果林相连(李利平等, 2011)。然而,近年来,苹小吉丁(Agrilusmali)(鞘翅目Coleoptera: 吉丁甲科Buprestidae)在新疆野苹果林内暴发成灾,导致新疆野苹果损失惨重; 苹小吉丁主要以幼虫蛀食苹果等蔷薇科果树的韧皮部、造成寄主枝条干枯,严重时使整株植物死亡(Bozorovetal., 2019; 崔志军等, 2018; 王智勇, 2013; 周忠福等, 2020)。
为揭示苹小吉丁成灾机制,探讨其在危害过程中肠道微生物可能产生的作用,本研究拟对苹小吉丁肠道真菌和细菌多样性开展研究。众所周知,昆虫体内栖息着大量的微生物,这些微生物主要以肠道菌群(gut microbiota)的形式定殖在消化道内(Dongetal., 2009),与宿主昆虫在长期协同进化过程中形成了相互依存的共生关系,参与了昆虫绝大多数的生命活动,对宿主的生长和发育具有重要作用(王四宝等, 2017),因此,在研究害虫危害时,不仅要着眼于昆虫本身,还要关注与之密切相关的肠道菌群。昆虫肠道独特的结构和理化性质为多种多样的微生物定殖提供了特殊环境,肠道菌群组成与宿主昆虫的生长发育、新陈代谢、繁殖、防御等生命活动密切相关(Brummeletal., 2004; Hosokawaetal., 2010; Kikuchietal., 2007); 这种相对稳定的关系对昆虫整个生命周期具有极其重要的作用(张静等, 2017): 一方面,肠道为菌群提供稳定的生存环境和必要的营养物质(Pangetal., 2016; Petersonetal., 2016),昆虫肠道微环境可以影响肠道菌群结构和代谢活动,从而赋予肠道菌群种类多样性和宿主特异性的特点(Kuraishietal.,2013); 另一方面,昆虫肠道菌群参与调控宿主生长发育、营养代谢和环境适应性等诸多生物学过程,是调控宿主生物学性状的重要调节因子(Douglas, 2015; Hammeretal., 2015)。
我国学者已初步开展了苹小吉丁肠道微生物群落多样性研究(Zhangetal., 2018; Bozorovetal., 2019),奠定了良好的基础,然而,就目前的数据来看,苹小吉丁肠道细菌群落较为复杂且多变,并未呈现较为一致的研究结果,而真菌群落研究较少。为此,本研究在前人的基础上,通过Illumina MiSeq测序技术对真菌ITS基因和细菌16S rRNA基因进行分析,对我国新疆伊犁地区不同虫期(幼虫和成虫)、不同环境条件(栽培果园和野果林)的苹小吉丁自然种群肠道微生物群落多样性进行研究,并运用PICRUSt2 软件进行功能预测,以期为下一步探讨苹小吉丁肠道菌群功能提供科学数据。
1 材料与方法
1.1 试验样地
新疆伊犁自治州巩留县受苹小吉丁危害较为严重,因此本研究选择在受害最为严重的新疆野果林和人工栽培苹果(M.pumila)园内设置样地,每个样地大小为100 m×100 m。
1.2 试验材料
1.2.1 苹小吉丁幼虫取样方法 在苹小吉丁幼虫出蛰危害季节于样地中随机选取30枝带虫枝条作为试验样品(表1)。将样品带回实验室后在无菌条件下解剖枝条,剥取幼虫放入-80 ℃冰箱备用。
1.2.2 苹小吉丁成虫的取样方法 在成虫羽化高峰期使用捕虫网,在样地内捕捉成虫,将样地内的成虫分别放入贴有标签的收集管中,再放入有冰袋的冰盒内立即带回实验室,随后将成虫放入-80 ℃冰箱备用。
1.2.3 肠道获取 将保存于-80 ℃冰箱的苹小吉丁取出,随后用75%的酒精对虫体表面消毒3次,每次1 min,再用无菌水清洗3遍。将体式解剖镜置于超净工作台中,与超净工作台一起紫外灭菌20 min,用已灭菌的镊子和解剖针在PBS缓冲液中解剖虫体,分离出肠道,将肠道置于已灭菌的2 mL离心管中,如表1编号。

表1 苹小吉丁样品信息①Tab.1 Sample information of Agrilus mali
1.3 DNA提取和PCR扩增
使用DNeasy Blood & Tissue Kit(Qiagen,Hilden,德国)试剂盒、参照说明书提取苹小吉丁肠道总DNA。以该总DNA为模板,分别以通用引物对333F/806R(5′-ACTCCTACGGGAGG CAGCAG-3′; 5′-GGACTACHVGGGTWTCTAAT-3′)和FITS7/RITS4(5′-GTGARTCATCGAATCTTTG-3′; 5′-TCCTCCGCTTATTGATATGC-3′)扩增真菌ITS2区域(Blaalidetal., 2013)和细菌16S rRNA V3+V4 区域(张军毅等, 2015)。PCR扩增体系总体积均为50 μL: DNA模板2 μL,TransStartTaq DNA Polymerase 0.5 μL,10×Buffer 5 μL,引物338F/806R(10 mmol·L-1)各1 μL,dNTPs(各2.5 mmol·L-1)4 μL,ddH2O 36.5 μL。PCR扩增条件: 94 ℃预变性5 min; 94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环; 72 ℃延伸 10 min。PCR扩增反应重复3次,PCR扩增产物合并后经1%琼脂糖凝胶电泳检测,随后采用Illumina MiSeqPE300测序平台进行双端测序。
1.4 高通量测序数据分析
MiSeq测序完成后,对获得的原始序列(raw reads)进行质量控制,舍弃低质量序列(50个连续碱基平均质量<25,序列长度<50bp,模糊碱基≥1)。运用Flash V1.0.3软件将双端数据进行拼接,去除嵌合体,剔除宿主自身、叶绿体和线粒体序列后,获得优质序列(clean reads)数据。用软件QIIME对优质序列在97%水平上进行操作分类单元(operational taxonomic unit,OTU)聚类,并利用Silva和UNITE数据库分别对1.3节扩增获得的苹小吉丁肠道真菌ITS和细菌16S rRNA序列进行物种注释。基于OTU的统计结果,利用Mothur软件计算Alpha多样性指数,用于反映样本内菌群的多样性。本研究选取Shannon、Simpson、Ace、Chao、coverage 5 个常用指数来分析苹小吉丁肠道菌群的多样性。Chao和Ace指数反映样品中群落丰富度,二者数值越大,表示样品中群落丰富度越高; Shannon指数和Simpson指数反映样品中物种多样性,Shannon指数越高,Simpson指数越小,说明样品中的物种多样性越高; coverage常用在微生物16S/18S/ITS测序中,作为反映测序深度的指标。其值越接近于1,说明测序深度越合理,测序深度已经基本覆盖到样品中所有的物种。
1.5 PICRUSt2功能预测
利用PICRUSt2软件进行ITS和16S rRNA基因数据功能预测,将测序样品中的基因数据通过EC基因家族到途径的结构化映射,在PICRUSt2中计算出COG、KO的丰度信息和MetaCyc途径的丰度。
2 结果与分析
2.1 序列拼接组装与OTU聚类分析
苹小吉丁成虫肠道真菌ITS2与细菌16S rRNA高通量测序质控拼接后共获得OTU分别为285和1 470个(表2)。从不同虫态来看: 苹小吉丁幼虫肠道真菌和细菌OTU数均大于成虫肠道; 从不同寄主来看: 新疆野苹果苹小吉丁肠道真菌OTU数大于栽培苹果苹小吉丁肠道,而细菌则相反。
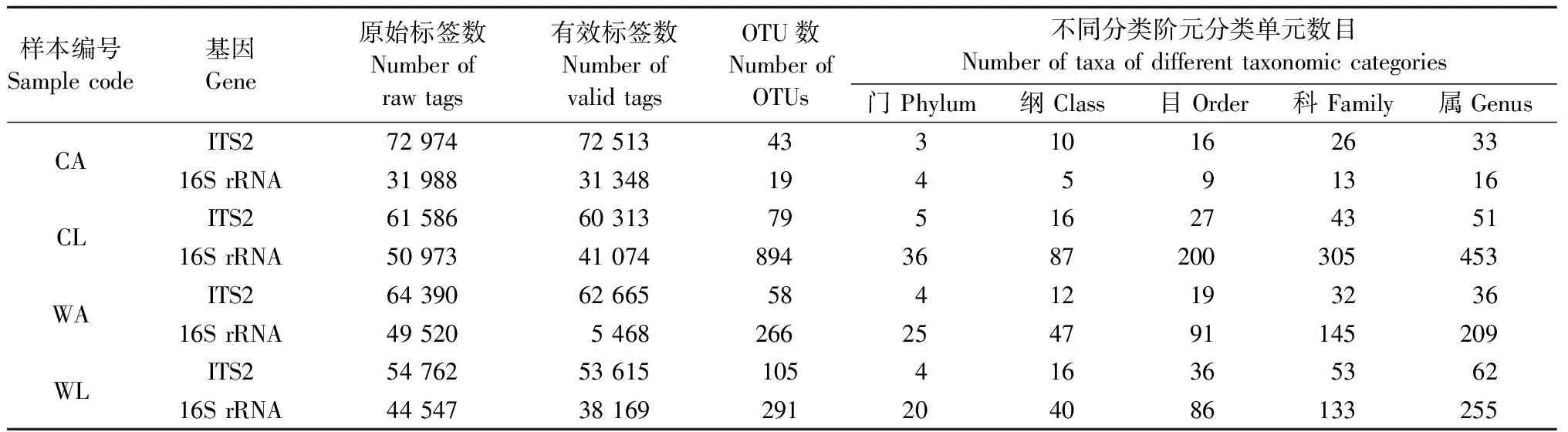
表2 不同寄主不同虫态苹小吉丁肠道真菌ITS2和细菌16S rRNA高通量测序基本信息Tab.2 Basic information of high-throughput sequencing of fungal ITS2 and bacterial 16S rRNA in gut of A. mali with different hosts and stages
2.2 苹小吉丁肠道真菌和细菌鉴定
通过序列比对,共鉴定真菌5门22纲50目92科和122属,细菌40门103纲231目364科和594属。其中真菌主要隶属于3门,即担子菌门(Basidiomycete)、子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota),12纲,即座囊菌纲(Dothideomycetes)、粪壳菌纲(Sordariomycetes)、银耳纲(Tremellomycetes)、散囊菌纲(Eurotiomycetes)、伞菌纲(Agaricomycetes)、囊担子菌纲(Cystobasidiomycetes)、酵母纲(Saccharomycetes)、子囊菌纲(Ascomycota)、锤舌菌纲(Leotiomycetes)、圆盘菌纲(Orbiliomycetes)、担子菌纲(Basidiomycota)、伞形束梗孢菌纲(Agaricostibomycetes); 细菌主要隶属于7门,即变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、Bacteroidota、Patescibacteria、绿弯菌门(Chloroflexi)、疣微菌纲(Verrucomicrobiota),11纲,即γ-变形菌纲(Gammaproteobacteria)、放线菌纲(Actinobacteria)、梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)、α-变形菌(Alphaproteobacteria)、芽孢杆菌纲(Bacilli)、纤细菌纲(Gracilibacteria)、厌氧绳菌纲(Anaerolineae)、俭菌总门未确定纲(Parcubacteria)、疣微菌纲(Verrucomicrobiae); 其中,γ-变形菌纲、放线菌纲、α-变形菌纲、芽孢杆菌纲、座囊菌纲、粪壳菌纲、银耳纲在每个样品中均有分布(图1)。

图1 苹小吉丁肠道真菌和细菌组成(纲级分类阶元)Fig. 1 Gut microbiota composition of Agrilus mali (at the class level)
2.3 肠道细菌和真菌Alpha多样性分析
Alpha多样性分析结果表明(表3),测序深度基本覆盖到样品中所有的物种,已获得的测序数据量足以覆盖苹小吉丁肠道大多数微生物类群; 野果林苹小吉丁肠道真菌群落丰富度和物种多样性成虫均大于幼虫,而细菌群落丰富度成虫小于幼虫,但物种多样性成虫却大于幼虫,说明在苹小吉丁不同的发育阶段,肠道微生物群落变化较大,此外,苹小吉丁幼虫肠道微生物群落和物种多样性在栽培果园远大于野果林。
2.4 不同虫态、不同环境苹小吉丁肠道细菌和真菌的差异性
从属级分类阶元来看,不同虫态、不同环境苹小吉丁肠道细菌和真菌组成存在差异,其中CA特有真菌11属,特有细菌2属; CL特有真菌28属,特有细菌223属; WA特有真菌37属,特有细菌47属; WL特有真菌12属,特有细菌68属。而在4组样品的核心菌群中,真菌7属,细菌21属(图2),其中共有真菌为枝孢菌属(Cladosporium)、Cutaneotrichosporon、篮状菌属(Talaromyces)、曲霉菌属(Aspergillus)、青霉菌属(Penicillium)、假丝酵母属(Candida)、顶孢霉菌属(Acremonium);可供比对的 共有细菌为肠杆菌属(Enterobacter)、隆布次氏菌属(Romboutsia)、梭状芽孢杆菌属(Clostridium)、乳酸杆菌属(Lactobacillus)、纤维单胞菌属(Cellulomonas)、鞘氨醇单胞菌属(Sphingomonas)、副球菌属(Paracoccus)、拉尔斯通氏菌属(Ralstonia)、诺卡氏菌属(Nocardioides)、微杆菌属(Microbacterium)、鼠李杆菌属(Rathayibacter)、曲棍杆菌属(Curtobacterium)、漆螺科未确定属(Lachnospiraceae)、伯克霍尔德菌属(Burkholderia)、假单胞菌属(Pseudomonas)、拟黑杆菌属(Paeniglutamicibacter)、拟杆菌属(Planomicrobium)、泛菌属(Pantoea)、需氧菌属(Aeromicrobium)。
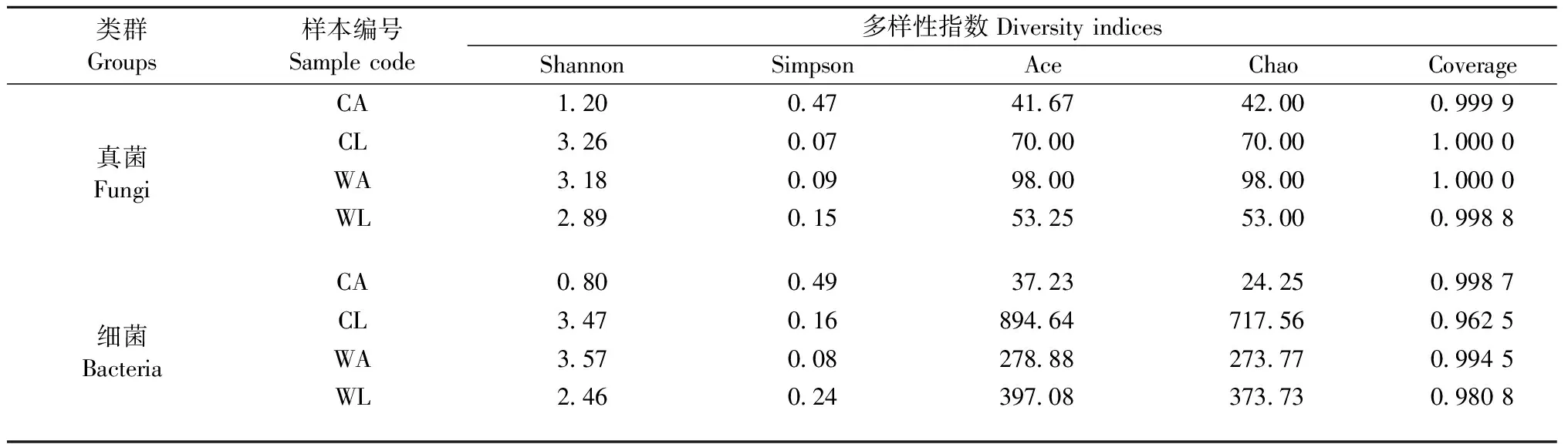
表3 不同寄主不同虫态苹小吉丁肠道内真菌和细菌多样性指数统计Tab.3 Diversity indices of fungi and bacteria in gut of A. mali at different hosts and stages

图2 肠道真菌和细菌维恩图Fig. 2 Venn diagram of gut fungi and bacteria
2.5 PICRUSt2功能预测
通过COG功能预测获得苹小吉丁肠道细菌总共拥有23个功能(图3),并且野果林苹小吉丁肠道细菌拥有的功能总体比栽培果园苹小吉丁肠道细菌的高(表4); 通过MetaCyc代谢途径分析,共注释到74条真菌代谢通路,426条细菌代谢通路,并且各样品之间代谢通路Top20丰度存在一定差异(图4、5),其中,栽培苹果苹小吉丁肠道真菌代谢通路数量远大于野苹果苹小吉丁肠道真菌代谢通路数量,且成虫肠道真菌代谢通路数量大于幼虫肠道真菌代谢通路数量,这可能与寄主和环境有关; 通过KEGG代谢途径分析,共注释到871条真菌代谢通路,426条细菌代谢通路。同时,酶功能热图(Enzyme Heatmap)显示各样品之间酶的丰度存在较大差异(图6),并且成虫肠道真菌酶的丰度明显多于幼虫,而细菌则相反,成虫酶的丰度小于幼虫,说明苹小吉丁肠道真菌对成虫生长发育具有重要作用,而肠道细菌则对幼虫生长发育起着关键性作用。

图3 肠道细菌COG功能基因预测Fig. 3 Prediction of COG functional gene in gut bacteria

表4 不同寄主不同虫态苹小吉丁肠道内COG预测功能类别占比Tab.4 The proportion of COG prediction function categories in gut of A. mali with different hosts and stages

续表 Continued

图4 肠道真菌MetaCyc代谢途径Top 20丰度统计Fig. 4 Top 20 MetaCyc pathway of abundance for the gut fungus
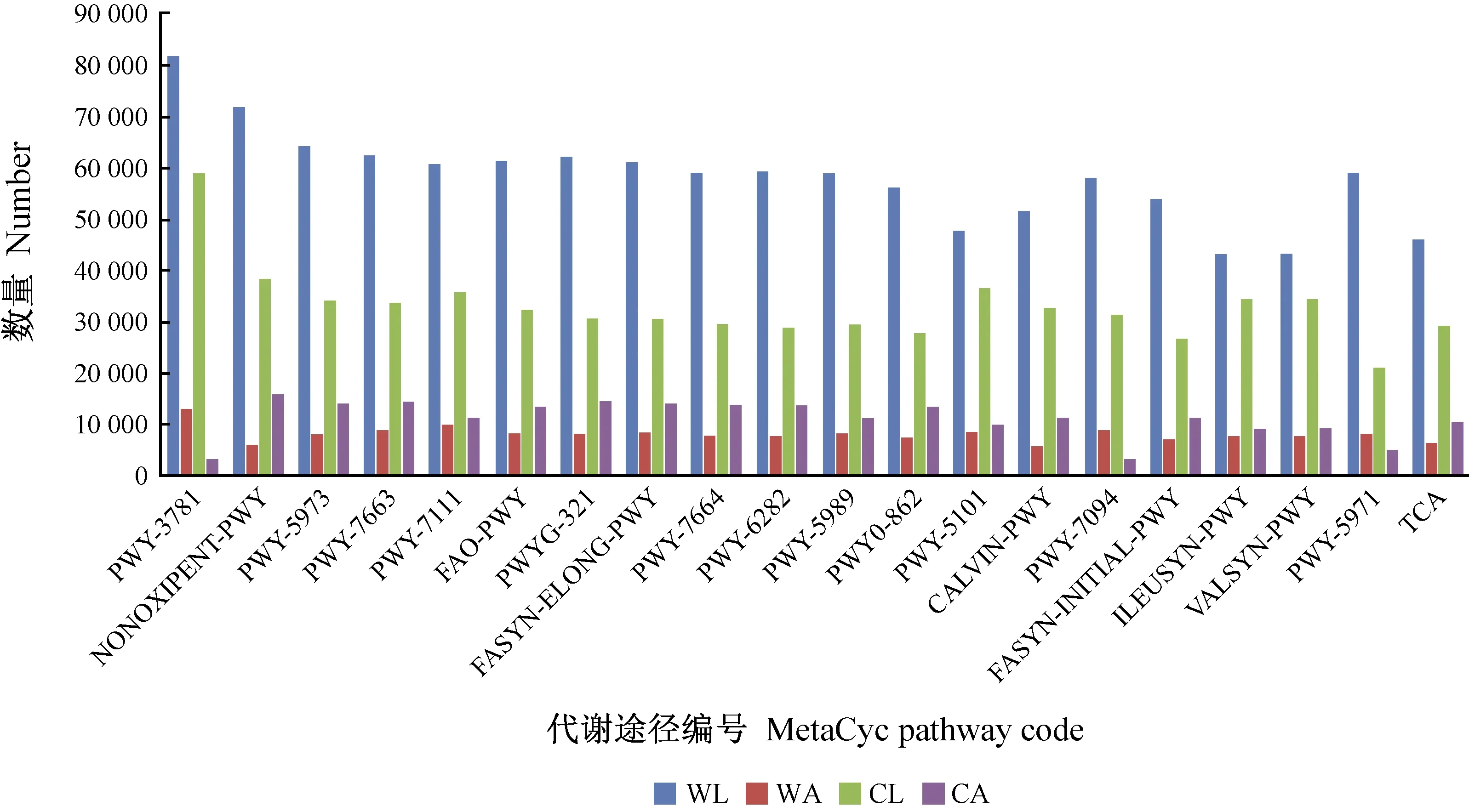
图5 肠道细菌MetaCyc代谢途径Top 20丰度统计Fig. 5 Abundance statistics of gut bacteria MetaCyc pathway Top 20
3 讨论
3.1 序列拼接组装与OTU聚类分析
从获得的OTU数量来看,苹小吉丁肠道细菌CA远小于其他3个组(CL、WA和WL),推测可能的原因是: 取样时CL、WA、WL来自新鲜虫体,而CA虫体曾保存在液氮中3个月,CA肠道部分细菌已降解; 但是真菌CA与其他组差异不大,说明真菌并未受样品的影响。此外,苹小吉丁幼虫肠道真菌和细菌OTU数量均大于成虫,这可能是由于昆虫肠道结构不同所导致,也可能与取食寄主植物成份有关,苹小吉丁幼虫取食韧皮部,而成虫取食叶片,不同的饮食导致肠道产生不同的生化反应从而形成出不同的微生物群落,类似的结果在大头金蝇(Chrysomyamegacephala)和蜣螂(Coprisincertus)中有过报道(Wangetal., 2018; Surez-Mooetal., 2020),并且,已证实食木昆虫肠道细菌丰富(Engeletal., 2013),因此,细菌为苹小吉丁幼虫肠道微生物的优势种。同时,昆虫肠道细菌与真菌之间具有复杂的相互作用(Zhangetal., 2018),细菌可以促进真菌的生长(Briardetal., 2016),待成虫羽化后,其食物发生了改变,细菌不再是优势菌群,真菌也出现了相应的变化。再者,造成野苹果和栽培苹果苹小吉丁肠道菌群OTU数量上的差异,可能与寄主有关,也可能与人为干扰有关,野果林有放牧活动,而栽培果园林下种植苜蓿(Medicago),定期割除,对此,还需更多的数据支持方可进一步探讨。
3.2 苹小吉丁肠道细菌和真菌鉴定及多样性研究
在肠道核心真菌类群中,本研究与Zhang 等(2018)所报道的曲霉菌属、枝孢菌属、假丝酵母属、青霉菌属所相同,其中念珠菌属、曲霉菌属及青霉菌都为常见的致病菌,本研究测得的顶孢霉菌属、Cutaneotrichosporon和曲霉菌属为核心真菌类群未见报道,同时本研究核心菌群不包括Zhang等报道的隐球菌属、茎点霉属、镰刀菌属和节担菌属真菌,茎点霉属和镰刀菌属的很多种类是植物致病菌(杨文等, 2016; Chengetal., 2019),并且镰刀菌属是苹小吉丁伴生菌的主要类群(周忠福等, 2020)。肠道微生物群落的不同可能是由于捕捉苹小吉丁的地点不同,其寄主品种出现了差异所致(Colmanetal., 2012)。本研究结果肠道细菌中有3门4纲,与Bozorov等(2019)研究结果一致,即变形菌门、厚壁菌门、放线菌门和γ-变形菌纲、放线菌纲、梭菌纲、芽孢杆菌纲,并且在细菌Top 20属都存在泛菌属和假单胞菌属,泛菌属对苹小吉丁纤维素分解具有重要作用(Bozorovetal., 2019),该菌也是本研究中4个样品的共有菌群,而Zhang 等(2018)在研究苹小吉丁肠道细菌时未报道存在该细菌,说明在一定的条件下,泛菌属细菌可能对苹小吉丁纤维素分解起到一定作用,但是否与苹小吉丁形成共生关系需进一步研究; 而假单胞菌属细菌由于其具有能固定穿入组织、产生弹力应蛋白和具有粘连活性等特性,常被作为潜在的致病菌(钱伯钦,1986),可引起植物立枯病的劳尔氏菌属(Ralstonia)(林海云等, 2011)和引起的植物病害发生率位居十大细菌性植物病害之首的假单胞菌属(王丹丹等, 2017)同样也在苹小吉丁肠道细菌Top 20中存在。 总体而言,苹小吉丁肠道中细菌和真菌都有较多的植物致病菌,但苹小吉丁与致病菌是否存在协同作用共同危害寄主植物也需进一步研究。
此外,本研究在苹小吉丁成虫和幼虫肠道中均发现大量厚壁菌门细菌,其在宿主的物质和能量代谢过程中起着非常重要的作用,并且其对食物的消化起着重要作用(Hongetal., 2011; Ruthetal., 2008)。苹小吉丁幼虫以苹果枝条韧皮部为食,其中含有大量的纤维素和半纤维素组分,食物中纤维素和半纤维素在苹小吉丁肠道内首先被这些厚壁菌门的细菌所分解,分解产物进而被其他细菌利用,如梭菌纲细菌和拟杆菌纲细菌在丁酸的生成中起着非常重要的作用(Zhuetal., 2011),因此推测这些细菌都参与了苹小吉丁肠道内食物的消化过程。同时,笔者在苹小吉丁肠道中的共有菌群检测到了乳杆菌属细菌,该属细菌还具有合成碳水化合物降解酶(糖苷水解酶、果胶降解酶、多糖水解酶)的能力,由此推测其与苹小吉丁的营养代谢有关(张筠等, 2009),也曾有报道该属对肠黏膜具有很强的黏附能力,具有拮抗有害菌定植、减少肠道疾病发生和改善肠道菌群分布的能力; 并且能产生广谱抗菌物质,广泛且有效的抑制细菌、酵母、真菌和病原虫等的生长,对昆虫提高免疫力方面发挥着重要的作用(Olofssonetal., 2008; Pangetal., 2011)。另外,目前也有报道称乳杆菌属细菌对昆虫抗药性具有一定作用,并且苹小吉丁肠道的共有菌群中还发现了伯克霍尔德菌属细菌,可能参与有毒物质解毒过程的细菌(Xiaetal., 2013),但这些肠道菌与苹小吉丁是否具备抗药性以及与其抗药性的产生是否相关需要进一步验证。
3.3 不同虫态不同环境的苹小吉丁肠道微生物的差异性
本研究4组不同样本中均存在枝孢菌属、篮状菌属、曲霉菌属、青霉菌属等7属真菌和肠杆菌属、乳酸杆菌属、伯克霍尔德菌属等21属细菌,这些真菌和细菌可能与苹小吉丁建立了某种共生关系,对苹小吉丁具有非常重要的生理功能,这些功能有待进一步深入研究。
昆虫从幼虫到成虫形态会发生变化,消化道的结构和物理化学性质出现了较大的差异,对于食物的摄取表现出较大的不同。尽管昆虫达到成虫阶段前的多次蜕皮过程中,前肠或后肠壁会逐渐形成适于细菌定殖的表面结构,有些肠道微生物可以保留下来,然而,肠道微生物群落结构仍然受到了影响(曹乐等, 2018)。本研究从Alpha多样性分析结果来看,野果林苹小吉丁肠道真菌群落丰富度和物种多样性成虫大于幼虫,说明成虫肠道真菌种类多而且均匀度好,和Zhang等(2018)的研究结果一致; 对于野果林苹小吉丁肠道细菌群落而言,丰富度成虫小于幼虫,但物种多样性成虫却大于幼虫,说明细菌在幼虫肠道中种类较多,但是各个种类的数量分布并不均匀,存在明显的优势类群,这在许多昆虫肠道微生物研究中得到证实(Tsuchida, 2002; 黄胜威, 2012; Engeletal., 2013; Zhangetal, 2018; 王争艳等, 2020)。
此外,苹小吉丁幼虫肠道真菌和细菌群落丰富度和物种多样性在栽培果园大于野果林,这应该与寄主存在密切关系,苹小吉丁在栽培果园取食苹果树,而在野果林取食新疆野苹果树。Zhang等(2018)曾发现喂食苹果叶片会使苹小吉丁成虫肠道微生物Alpha多样性升高。可见,即使同属不同种之间的寄主差异也可以引起昆虫肠道微生物群落发生变化。
3.4 PICRUSt2功能预测
PICRUSt2分析通过与数据库比对,将微生物的多样性情况与功能联系起来。对比发现,在不同样品中肠道微生物种类和丰度虽有较大的差别,但其功能大致相同,所以推测在苹小吉丁肠道中发挥功能的为一固定类群,可能是其与宿主长期协同进化的结果。从图6可以看出,细菌注释到Enzyme功能幼虫肠道中的丰度明显多于成虫,而真菌注释到Enzyme功能成虫肠道中的丰度明显多于幼虫,推测其与不同发育阶段固有的饮食特殊化和个体发育特征有关(Shuklaetal., 2016)。细菌群落中纤维素分解细菌包括假单胞菌属都在以苹果树的形成层和韧皮部为食的幼虫肠道中更为丰富,并且在取食不同食物叶片的成虫之间的细菌群落相似(Zhangetal., 2018),因此其功能未发生大的改变,只是有所降低; 相比之下,真菌群落更容易受到不同食物的影响,许多昆虫肠道真菌都来自于周围环境,包括食物的叶子表面(Zhangetal., 2018),所以成虫取食叶片后,肠道中真菌数量增加,从而的整体功能呈现增加的变化。
4 结论
不同虫态、不同环境苹小吉丁肠道真菌和细菌种类和丰度存在差异,肠道真菌种类和丰度成虫大于幼虫,而细菌幼虫大于成虫,说明真菌对于成虫的生长发育起着关键性作用,而细菌对于幼虫的生长发育起着关键性作用。此外,不同的肠道微生物结构与组成,呈现出大致相同的功能,因此推测在苹小吉丁肠道中发挥功能的为一些固定类群,这可能是与其宿主长期协同进化的结果。

