胃癌突变基因与患者预后及免疫功能的相关性
曾周 龚拯 刘丽丽 柯丁心 王斌, 张万明,
(1 青岛大学基础医学院,山东 青岛 266071; 2 青岛大学华赛医学细胞和蛋白质药物研究院)
胃癌是目前癌症相关死亡的第三大原因,2020年全球新增胃癌病例超过100万[1]。由于传统治疗手段(如手术、放疗和化疗)在晚期胃癌患者中的治疗效果不佳,因此迫切需要新的治疗方式。近年来,免疫治疗显著改善了胃癌患者的预后[2-3],但也只有少部分患者能够从中受益[4]。研究发现黑色素瘤、胃癌和非小细胞肺癌患者的肿瘤突变负荷(TMB)与免疫治疗反应性及更好的预后相关[5-7]。而胃癌某些基因突变与患者预后的相关性尚不清楚。因此,需要了解更多胃癌基因突变对患者预后的影响。本研究从TCGA和ICGC数据库中下载胃癌患者的体细胞突变基因,通过R软件筛选出与患者生存率和预后密切相关的共同高频突变基因,然后使用GSEA软件进行基因富集分析,运用CIBERSORT算法计算肿瘤浸润免疫细胞(TIICs)的相对丰度,探究共同高频突变基因对患者TIICs的影响,旨在为胃癌患者的免疫治疗提供理论和数据参考。现将结果报告如下。
1 资料和方法
1.1 资料来源
从TCGA数据库(https://portal.gdc.cancer.gov)中下载433例胃癌患者的体细胞基因突变数据及其临床信息,时间截至2020年11月20日。排除某些临床信息缺失者,最后389例胃癌患者纳入本研究。从ICGC数据库(http://dcc.icgc.org/releases/current/Projects) 中下载523例胃癌患者的体细胞基因突变数据。
1.2 高频突变基因的筛选及其与患者预后和TMB的相关性分析
通过R软件分析TCGA和ICGC数据库中胃癌患者的体细胞突变数据[8],对两个数据库中突变频率位于前30位的基因取交集,获得共同高频突变基因,通过R软件对共同高频突变基因与患者预后的相关性进行Kaplan-Meier生存分析和Cox风险回归分析,获得与患者预后密切相关的突变基因。通过蛋白编码区的非同义突变位点总数除以蛋白编码区的总长度来计算每例患者的TMB[9]。最后利用Mann-Whitney检验分析共同高频突变基因与TMB评分的相关性。
1.3 生物信息学分析
使用GSEA软件4.1.0中的两个基因集(c2.cp.kegg.v7.2.symbols.gmt和c7.all.v7.2.symbols.gmt)对与预后密切相关的突变基因进行基因富集分析[10],通过标准化富集分数(NES)比较上述共同高频突变基因在两个基因集中的富集程度,以P<0.05和错误发现率(FDR)<0.25为显著富集。使用CIBERSORT反褶积算法计算每例胃癌患者组织样本TIICs的相对丰度[11],并使用R软件分析突变基因与TIICs的相关性。
1.4 统计学处理
使用R软件4.0.2版本对数据进行统计分析。采用Kaplan-Meier法和对数秩检验估计患者总生存率。采用单变量Cox回归分析确定患者总生存率的危险因素。以P<0.05为差异有显著性。
2 结 果
2.1 胃癌突变基因与患者TMB评分及生存预后的关系
使用R软件分析显示,对TCGA和ICGC数据库中突变频率前30位的基因取交集后获得21个共同高频突变基因。Kaplan-Meier生存分析和Cox风险回归分析显示,21个共同高频突变基因中,仅FAT4及MUC16突变与胃癌患者的总生存率相关,由于MUC16基因突变与胃癌的相关性已有相关研究报道[12],故本研究后续只针对FAT4进行分析。Mann-Whitney检验分析显示FAT4突变患者的TMB评分显著升高(P<0.001)。
2.2 FAT4基因突变的富集分析
GSEA软件分析显示,FAT4基因突变患者主要富集于TMB评分相关的通路,例如KEGG碱基切除修复、KEGG DNA复制、KEGG错配修复(图1A)以及MEMORY-CD4-TCELL-VS-TH2-DN通路(图1B);FAT4基因未突变的患者则主要富集于FOXP3-FUSION-GFP-TREG-UP通路(图1B)。
2.3 高频突变基因与TIICs的相关性分析
通过CIBERSORT反褶积算法计算结果显示,每例胃癌患者的组织样本中都含有22种TIICs,这些TIICs的种类名称及其表达水平如图2A所示。FAT4基因突变与TIICs的相关性分析的结果显示,FAT4基因突变患者的组织样本中活化的记忆性CD4+T细胞和滤泡辅助性T细胞浸润丰度较高(P<0.05),但Treg细胞和初始B细胞浸润丰度较低(P<0.05)。见图2B。
3 讨 论
由于胃癌恶性程度高、异质性强,手术切除仍然是目前临床常用的治疗方法。但胃癌晚期患者往往术后预后较差。随着分子生物学在肿瘤免疫治疗中的应用,近年来晚期癌症患者的治疗取得了一定进展。一项针对胃癌患者的随机对照试验显示,接受Nivolumab治疗患者的总生存期较安慰剂组患者显著延长[13],提示免疫治疗有望改善胃癌患者的治疗效果。但目前免疫治疗的受益群体有限。因此,寻找胃癌患者的预后生物标志物来指导免疫治疗,具有重要的临床价值。
本研究首先通过R软件对TCGA数据库以及ICGC数据库中胃癌患者的体细胞突变情况进行分析并筛选出21个共同高频突变基因。通过Kaplan-Meier生存分析方法和Cox风险回归分析方法对这21个共同高频突变基因进行分析,结果显示,FAT4及MUC16突变与胃癌患者的总生存率及更高的TMB评分密切相关。FAT4是编码原钙黏蛋白家族的成员之一,在平面细胞极性的调节中起着重要作用。有研究发现FAT4在胃癌中高频突变[14],但具体机制尚不清楚。MUC16基因编码一种膜系黏蛋白,该黏蛋白在其氨基末端包含一个胞外域、一个大串联重复域和一个具有短胞质域的跨膜域。已有研究发现MUC16是胃癌中最常发生突变的基因之一,且其突变与胃癌患者更高的TMB评分、更强的抗肿瘤免疫反应及更好的临床预后相关[15]。也有研究发现MUC16突变与免疫应答、抗原处理、细胞周期检查点和DNA复制与修复相关的信号通路上调有关[16]。本研究对MUC16基因突变的后续分析与上述研究高度重复,因此本研究后续主要针对FAT4进行分析。TMB评分在基于肿瘤新抗原的表达来预测多种类型肿瘤的免疫检查点阻断反应中起重要作用。研究显示,TMB评分是机体免疫反应的预测因子[17],针对膀胱癌、黑色素瘤、肾细胞癌和头颈部鳞状细胞癌等研究发现,TMB评分升高的患者预后更好[18]。在本研究中,通过GSEA软件针对FAT4基因突变的富集结果分析显示,FAT4突变与错配修复、DNA复制和碱基切除修复密切相关。有研究发现错配修复、DNA复制和碱基切除修复是TMB评分升高的主要原因[19]。此外,高TMB评分与淋巴细胞对肿瘤细胞的识别关系密切[20],这提示FAT4突变可能增强了淋巴细胞对肿瘤细胞的识别作用,从而提高了抗肿瘤免疫反应。本研究GSEA富集分析结果还显示,在FAT4基因未突变的胃癌患者中,与FOXP3-FUSION-GFP-TREG-UP相关的信号通路上调。FOXP3蛋白是维持Treg细胞内环境稳定的重要转录因子[21]。Treg细胞是一种抑制性免疫细胞,维持免疫耐受,并下调过度的免疫反应[22]。因此,FAT4突变可能破坏Treg细胞介导的免疫耐受,进而促进抗肿瘤免疫反应。本研究通过CIBERSORT算法和R软件针对FAT4突变与TIICs的相关性进行分析显示,在FAT4突变患者中,活化的记忆性CD4+T细胞和滤泡辅助性T细胞浸润丰度较高,Treg细胞浸润丰度较低。有研究显示,活化的记忆CD4+T细胞在肿瘤进展的早期阶段发挥抗肿瘤免疫的主导作用[23];在高TMB评分的乳腺癌患者中,滤泡辅助性T细胞通过激活B细胞使患者对免疫检查点阻断的反应更强[24]。在多种肿瘤中,例如乳腺癌、肾癌和非小细胞肺癌中,Treg细胞浸润增加与患者较差的临床预后情况有关[25-27]。在本研究中FAT4突变患者中活化的记忆CD4+T细胞和滤泡辅助性T细胞比例升高,提示FAT4突变可通过改变TIICs的比例来增强抗肿瘤免疫反应,延长患者的生存期。
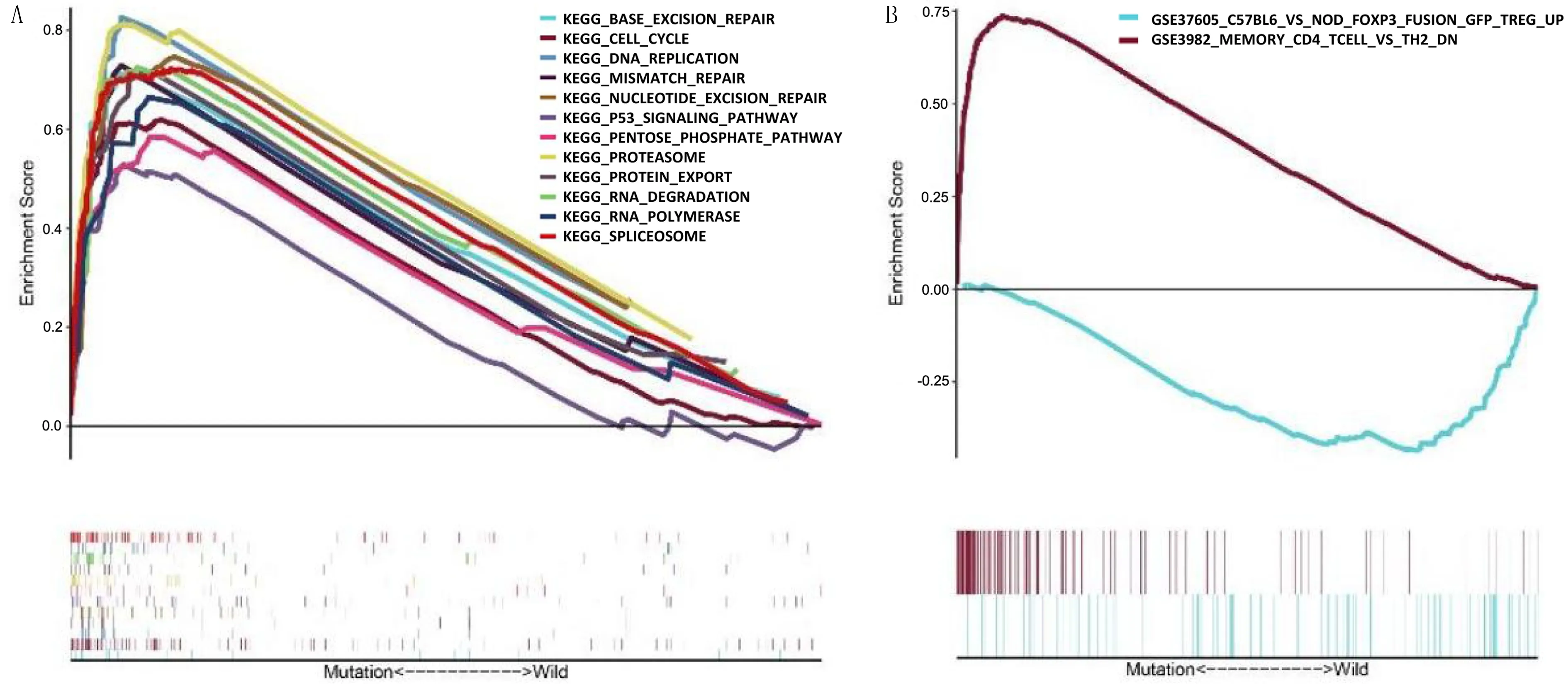
A:KEGG通路的富集分析,B:免疫通路的富集分析

A:每例患者组织样本中TIICs的相对丰度,B:FAT4基因突变患者(红色)和FAT4基因未突变患者(蓝色)与TIICs的相关性
综上所述,本研究结果显示,胃癌患者FAT4突变频率较高,且与患者更好的临床预后及较高的TMB评分有关。此外,FAT4突变可引起TIICs浸润程度的改变,并增强抗肿瘤免疫功能。本研究对评估胃癌患者的预后有重要意义,可为胃癌患者的免疫治疗提供理论和数据参考。

