TFE3对胆汁淤积分子调控作用的整合生物信息学分析
迟乃玉, 郭瀚泽, 李佳芮, 朱莹莹, 迟 彦
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁师范大学 生命科学学院 七鳃鳗研究中心,辽宁 大连 116081)
胆汁淤积一般由胆汁酸形成、分泌和排泄障碍所导致,胆汁不能正常地流入十二指肠,反而进入血液循环,随着时间增加导致肝损伤、肝纤维化、肝硬化、肝功能衰竭和肝癌等疾病发生,对人类生命健康造成极大威胁[1].关于胆汁淤积发生的分子机制目前还未完全阐明.生理条件下,胆汁酸的两亲特性促进了脂类及脂溶性维生素的消化吸收.另外,胆汁酸还可以作为信号分子,同细胞内核受体法尼醇X受体(Farnesoid X receptor,FXR)及细胞表面受体相互作用,参与信号转导,调节细胞生物学过程[2].但在病理条件下,过多的胆汁酸,尤其是疏水胆汁酸在肝脏中的积累,导致氧化应激和线粒体损伤,最后导致炎症因子的释放,引发炎症反应.炎症因子进一步招募中性粒细胞和其他免疫细胞,从而损伤肝实质细胞,导致肝纤维化、肝硬化,最后导致肝衰竭[3].
自噬是响应细胞压力应激而对细胞产生的适应性保护反应,其通过降解细胞内受损的细胞器、未折叠蛋白等对细胞进行质量控制,从而减少压力应激下细胞损伤,促进细胞的存活[4-5].自噬对于胆汁淤积性疾病发挥重要调节作用.有研究显示在胆汁淤积性疾病,如:原发性胆汁性胆管炎(Primary biliary cholangitis, PBC)、原发性硬化性胆管炎(Primary sclerosing cholangitis,PSC)、继发性硬化性胆管炎(Secondary selerosing cholangitis,SSC)以及遗传性胆汁淤积肝组织中,LC3和P62水平显著升高[6];CFTR基因突变导致的囊性纤维化和遗传性胆汁淤积症,同样发现P62阳性聚集物的形成[7];胆结石病人受损的肝脏中,LC3和P62水平显著增加[8],以上均表明在胆汁淤积性肝病中,自噬水平显著降低.利用雷帕霉素抑制mTOR信号通路激活自噬,可以清除肝组织中P62包涵体的形成[9].激活自噬降低了肝损伤,抑制自噬则加重了肝组织损伤[10],这些均表明自噬对于保护胆汁淤积性疾病起到重要作用.
转录因子结合IGHM增强子3(TFE3)是调节自噬的重要转录因子.TFE3为MIT/TFE(Microphthalmia-associated transcription/transcription factor E)家族成员,位于细胞核内,含有同DNA结合的bHLH-zip保守结构域[11].当受饥饿刺激后移位入细胞核,独立或协同TFEB,与核内具有CLEAR(Coordinated lysosomal expression and regulation)序列的基因启动子序列结合,启动相应基因表达,促进了自噬和溶酶体生成.不仅如此,TFE3还作为响应细胞各种应激状态下的感受器,在感受线粒体、内质网以及溶酶体应激下迅速入核,启动启动子上同样具有CLEAR序列的基因表达,进而抵御细胞器的压力,维持细胞正常功能和稳态[11].胆汁淤积性疾病,胆汁酸抑制自噬流的发生,并且由于疏水胆汁酸去污特性,破坏了脂膜结构,造成线粒体活性氧增加,内质网Ca2+离子释放,从而启动线粒体和内质网应激,启动线粒体自噬,促进细胞凋亡发生而抵御细胞器的压力[12].由此推测,TFE3作为促进自噬、响应细胞器压力的感受器,可能通过诱发自噬、启动细胞适应性保护反应而在胆汁淤积疾病过程中发挥重要的保护作用.但目前关于TFE3对胆汁淤积疾病的保护分子机制还未有报道.
本研究拟利用生物信息学手段,首先对胆道闭锁GEO(Gene expression omnibus)数据库进行加权基因共表达网络分析(Weighted gene co-expression network analysis, WGCNA),筛选出与疾病呈负相关的模块.模块内基因再与胆汁淤积GEO数据库差异表达基因以及TFE3下游靶基因共同取交集,获得TFE3可能调节的对于胆汁淤积性疾病具有抑制作用的候选基因.最后利用JASPAR数据库分析TFE3与候选基因启动子CLEAR序列结合的可能性.该研究首次从生物信息学角度全面解析了TFE3对胆汁淤积性疾病保护作用的调节机理,为以TFE3为新靶点,开发防治胆汁淤积性肝病的药物提供理论依据.
1 材料与方法
1.1 GEO数据库
从NCBI(https:∥www.ncbi.nlm.nih.gov/)下载GEO数据库(GSE46960,GSE152494、GSE169072).GSE46960为人胆道闭锁数据库,使用的基因平台为[HuGene-1_0-st]Affymetrix Human Gene 1.0 ST Array[transcript(gene)version],包括64个胆道闭锁患者样本和17个对照.GSE152494、GSE169072为体外胆汁酸处理细胞的数据库,所使用的基因平台均为GPL570[HG-U133_Plus_2]Affymetrix Human Genome U133 Plus 2.0 Array,均分别有3个对照和3个处理组样本.
1.2 WGCNA分析
WGCNA是一种使用基因表达数据构建无标度网络的系统生物学方法[13].首先,对数据库GSE46960内的基因表达情况及离群值进行质量检验,之后利用R语言中的 WGCNA包进行分析,根据主要连接关系和皮尔森相关性建立相关矩阵,利用WGCNA包内的“pick Soft Threshold”函数计算软阈值β,选择适当的β值使构建的网络更符合无标度网络的标准.将邻接矩阵转化为拓扑重叠矩阵(Topological overlap matrix,TOM),并基于此进行基因层次聚类,得到基因层次聚类树.对系统聚类树进行动态切割,以模块内最少基因数为30的参数将基因分组为模块,对模块特征基因(Module eigengenes,MEs)进行聚类,以便将相似的模块合并,计算基因显著性(Gene significance,GS)和模块显著性(Module membership,MS),以分析模块与临床信息的关联程度.
1.3 差异表达基因的筛选
从NCBI的GEO数据库下载探针文件和平台文件.使用Perl语言脚本将基因探针注释为基因名称,再使用R语言中的“limma”包获取差异表达基因,设置筛选条件为P-value<0.5,|lb(Fold Change)|>1.0,得到差异表达基因数据集.
1.4 TFE3下游靶基因筛选
GTRD(http://gtrd.biouml.org/)从SRA(Sequence read archive)、GEO等公共数据库中收集转录因子相关的Chip-seq数据,采用标准流程进行peak calling分析,并基于已有的转录因子motif数据,预测转录因子的结合位点[14].TFE3下游靶基因预测主要由GTRD完成,共预测12 062个TFE3潜在的靶基因.
1.5 靶基因上游转录因子预测
通过UCSC(https:∥genome-asia.ucsc.edu/index.html)数据库获得潜在靶基因的启动子,并将启动子输入JASPAR[15](http:∥jaspar.genereg.net/),评估TFE3对潜在靶基因启动子的结合能力.
2 结 果
2.1 WGCNA分析
利用R语言的WGCNA包,根据皮尔森相关性建立相似矩阵.再通过“pick Soft Threshold”函数计算软阈值(powerβ)(图1A).结果显示当选定软阈值为16时,相关系数R2>0.9,此时该阈值对应的网络平均连接度接近0,说明该网络近似无标度网络(图1B).最后,将邻接矩阵转化为拓扑重叠矩阵(TOM),计算相应的相异度(dissTOM).基于相异度进行基因层次聚类,获得基因聚类树(图2A).对得到的系统聚类树进行动态切割,以模块内最少基因数为30的参数将基因分组为不同模块(图2B).为了进一步分析模块,计算了模块内特征基因(Module eigengenes,ME)的差异性,并以此进行聚类以合并相似模块,最终共获得21个模块(图2C).还计算了每个模块与临床特征的相关性,当相关性r>0.6,P-value<0.5时,认为与疾病显著相关.共发现有7个与胆道闭锁显著相关的模块,其中,4个模块与疾病呈负相关,3个模块与疾病呈正相关(图2D).选取与疾病呈负相关模块内基因进行下一步分析.

图1 软阈值β的选择及无尺度网络的构建

图2 模块的构建及与临床性状相关热图
2.2 差异表达基因的获取
为了寻找胆汁淤积后的差异表达基因,筛选胆汁酸处理组差异于非处理组的基因.在GSE152494数据库中获得101个下调差异表达基因和58个上调差异表达基因(图3A),GSE169072数据库中获得68个下调表达基因和54个上调表达基因(图3B).
图3 差异表达基因火山图
2.3 胆汁淤积负相关相关基因筛选
胆道闭锁发生后通常会产生胆汁淤积,为筛选到与胆汁淤积呈负相关的差异表达基因,将WGCNA分析得到的4个与疾病呈负相关模块的基因与上述两个体外胆汁酸处理细胞模拟胆汁淤积的数据库的差异表达基因取交集,共获得27个基因(图4A).

图4 TFE3靶基因的筛选
2.4 TFE3负调控胆汁淤积的可能靶基因筛选
为筛选TFE3负调控胆汁淤积的靶基因,将上述27个基因与通过GTRD预测的受TFE3调控的潜在靶基因取交集,共获得了14个基因(图4B).为验证TFE3对这些潜在靶基因的调控,利用UCSC数据库获得14个基因的启动子序列.导入JASPAR网站预测TFE3与这些基因启动子的结合位点,并将结合分值高于9.0认定为TFE3潜在靶基因.共筛选出补体4结合蛋白(Complement componet 4 binding protein,C4BPB)、补体9(Complent 9,C9)、二氢乳清酸脱氢酶(Dihydroorotate dehydro-genase,DHODH)、羟酸氧化酶2(Hydroxyacid oxidase 2,HAO2)、3-羟基-3-甲基-辅酶A合成酶1(3-hydroxy-3-methylglutaryl-CoA synthase 1,HMGCS1)和甾醇C5去饱和酶(Sterol-C5-desatur-ase,SC5D)6个基因(表1).
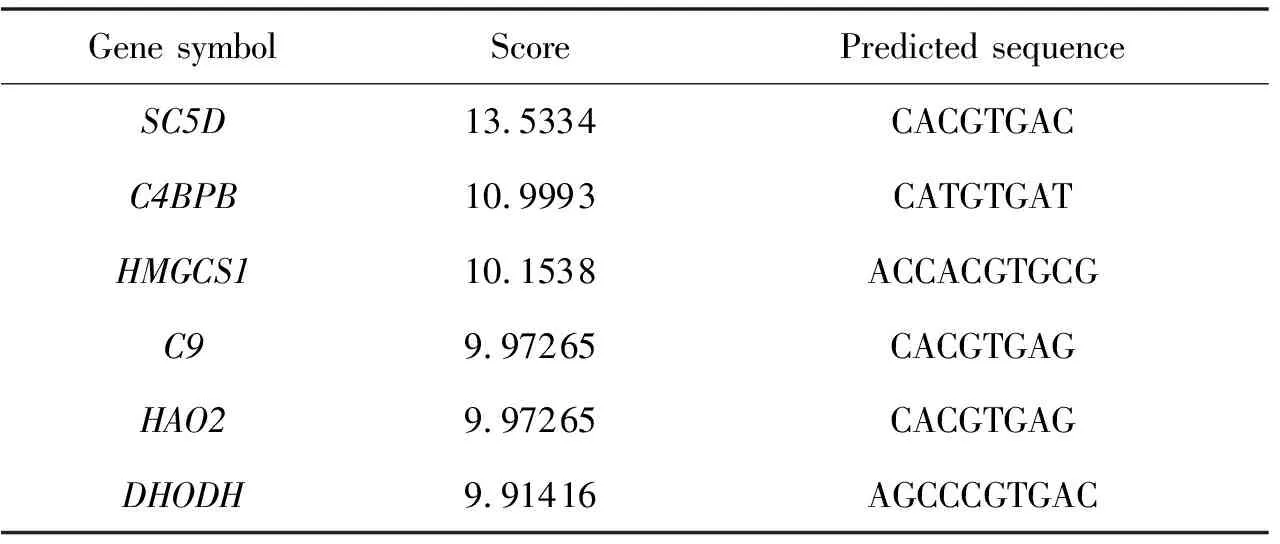
表1 JASPAR预测TFE3的结合位点
3 讨 论
目前,对胆汁淤积的治疗尚无特别有效的手段.熊去氧胆酸(Ursodeoxycholic acid,UDCA)及其衍生物是唯一经美国FDA(Food and drug administration)批准的、世界公认的治疗胆汁淤积的药物.但是,熊去氧胆酸对约1/3~2/3的胆汁淤积病人,如原发性胆管硬化性胆汁淤积治疗效果不佳或无效,甚至可能导致病情恶化.寻找新的靶点治疗胆汁淤积性疾病显得尤为重要.本研究期望通过生物信息学手段,全面解析TFE3保护胆汁淤积性肝病的分子机理,为以TFE3为新靶点,开发防治胆汁淤积性肝病的药物提供理论依据.胆道闭锁是造成胆汁淤积的重要病因.首先对胆道闭锁GEO数据库的基因进行了WGCNA分析,筛选到4个与疾病呈显著负相关的模块,4个模块基因共为2 658个.为进一步筛选到与胆汁淤积性肝病呈负相关的差异表达基因,又将上述基因与两个混合胆汁酸处理肝细胞的GEO数据库中差异表达基因取交集,获得27个基因.为筛选到TFE3可能参与负向调节胆汁淤积的靶基因,将这27个基因与GTRD数据库中TFE3下游靶基因取交集,得到14个候选基因.最后,利用JASPAR数据库分析,共有6个基因的启动子上具有CLEAR序列,并且能被TFE3所识别.经过整合生物信息学分析,表明这6个基因可能是TFE3调节的靶分子,TFE3可能通过调节这6个靶基因在胆汁淤积性疾病中发挥保护作用.经HPA(Human protein atlas)数据库(https:∥www.proteinatlas.org/)分析,发现这6个基因均是在肝组织中特异表达.
研究认为,在肝脏中积累的疏水性胆汁酸能够产生较强的免疫反应,促炎因子的分泌会进一步影响胆汁酸核受体及其所调控的胆汁酸转运蛋白的活性,进而导致胆汁酸代谢紊乱,加重了胆汁淤积[16-17].补体系统是免疫系统中进化较为保守的组成部分,除其广泛被熟知的抗菌作用外,补体系统激活的片段还与免疫细胞表面受体相互作用,在天然和适应性免疫方面发挥重要调节作用[18].有报道显示,在肝脏疾病,如非酒精性肝炎(Nonalcoholic steatohepatitis,NASH)、肝癌(Hepatocellular carcinoma,HCC)中补体系统异常激活,而降低补体系统的活化对于疾病起到一定抑制作用[18].C4BP是由肝脏合成并分泌到血液循环中的血浆糖蛋白,其通过与凋亡或坏死细胞结合阻止了由于补体激活而产生的炎症,是补体经典途径和凝集素途径的主要可溶性抑制剂.也有研究报道口服石斛酚可抑制补体C9水平进而抑制了C5b-9复合物的形成,从而降低了肝脏氧化应激和炎症反应[19].鉴于胆汁淤积性肝病免疫反应的失调,因此推测TFE3可能通过调节补体系统,如C4BP以及C9的活性调节胆汁淤积性肝病.
肝脏胆汁酸的合成及分泌是调节肝细胞内胆固醇平衡的重要手段[18].而胆汁淤积情况下,胞内胆固醇平衡就被打破,胆汁淤积病人往往具有高胆固醇血症的并发症[20-21].在胆汁淤积的情况下,调节胆固醇的平衡对于抵抗胆汁淤积的损伤可能具有重要意义.3-羟基-3-甲基-辅酶A合成酶1(3-hydroxy-3-methylglutaryl-CoA synthase 1,HMGCS1)是胆固醇前体甲羟戊酸的合成酶,甾醇C5去饱和酶(Sterol-C5-desaturase,SC5D)负责将7-胆甾烯醇转化为7-脱氢胆固醇.两者均为胆固醇合成过程中的关键酶.通过生物信息学分析,HMGCS1以及SC5D可能是TFE3的新靶基因,TFE3可能通过调控HMGCS1以及SC5D基因而抵御胆汁酸过多积累造成的胆固醇失调.
肝细胞富含线粒体,而线粒体是ROS的主要来源,因此,肝细胞易于受ROS的攻击.在病理条件下,过多的胆汁酸干扰线粒体呼吸链和电子传递过程,使得氧化呼吸链解偶联,导致大量ROS的产生.ROS进一步刺激线粒体通透性转换孔使其不可逆开放,最后导致大量物质进入线粒体,线粒体肿胀,引起线粒体膜损伤,ATP水解,释放细胞色素C,导致肝细胞凋亡[12,22].同时,ROS的产生也会激活线粒体和内质网应激,导致炎症因子的释放,引发炎症反应.因此,过多胆汁酸损伤线粒体而产生大量ROS可能是胆汁淤积性疾病的主要病理事件.二氢乳清酸脱氢酶(Dihydroorotate dehydrogenase,DHODH)是嘧啶核苷酸从头合成途径的限速酶,定位于线粒体内膜.2013年,Fang等研究显示DHODH通过与线粒体内膜呼吸链复合物相互作用而影响线粒体功能.缺失DHODH降低了线粒体膜电位,增加了线粒体活性氧的大量产生[23].DHODH可能起到了线粒体抗氧化防御的作用.羟酸氧化酶2(Hydroxyacid oxidase 2,HAO2)是一种肝脏特异性过氧化物酶体酶,可氧化乙醇酸盐生成乙醛酸,同时生成H2O2,下调其表达对于降低氧化损伤具有重要作用[24].DHODH以及HAO2启动子上均有CLEAR序列,因此,推测TFE3可能通过调控DHODH以及HAO2而对胆汁酸造成的线粒体损伤起到一定保护作用.

