多孔石墨相氮化碳的制备及其作为硫宿主材料在锂硫电池中的应用
李东胜,朱开兴
(青岛科技大学 机电工程学院,山东 青岛 266061)
随着锂离子电池的能量密度逐渐难以满足人们的需求,探索各种具有更高安全系数和能量密度的先进储能体系已经愈发的紧迫与重要[1]。在新一代的储能体系中,锂硫电池(LSBs)因其独特的优势引起了愈来愈多的关注[2]。首先,锂硫电池具有商业锂离子电池3~5倍的理论比容量,为1 675 m Ah·g-1;此外,硫属于地壳较丰富的元素,以硫作为阴极,在经济和环保方面都具有很大优势。然而,一些亟需解决的问题,成为了锂硫电池发展的阻碍[3]。首先,硫和Li2S/Li2S2的电导率较差,只有10-15S·m-1,这限制了电子在硫阴极中的传递和硫的利用。二是硫的还原是一个多步骤的过程,所生成的中间体可以溶解在有机电解质中,在循环途中不仅会在两极之间转移,造成穿梭效应,而且还会在锂阳极表面形成Li2S,导致阻抗增加。此外,放电过程中硫的体积膨胀(80%)和充电过程中的体积收缩会导致电极粉化和结构毁坏。
面对上述这些问题,人们以多孔碳、碳纳米管/纤维、石墨烯、空心碳纳米骨架等[4-7]多种碳材料作为导电基体封装硫,并作为吸附位点提高循环性能。然而,多硫化物与碳基体前者是极性的,后者是非极性的,这导致它们之间的范德华键难以稳定存在,结合较弱,基体材料对溶解的中间体的捕获能力十分有限。因此,在锂硫电池当中,迫切地需要一种低成本、制作简单、高电荷极性的新材料充当硫的宿主。
近年来,掺杂在碳框架中杂原子被证明可以改善碳材料对可溶硫化物的锚定,这使得石墨氮化碳(g-C3N4)是一种很有前途的宿主材料。g-C3N4相当于石墨环状结构里的部分碳原子被氮原子取代同时引入空位所得,具有与石墨相似的二维层状结构并具有非常高的氮含量[8]。其独特的层片状结构、高的含氮量和本征极性等特性使g-C3N4与多硫化物有很强的化学键合能力[9],因此,g-C3N4可以有效地抑制多硫化物的穿梭效应。例如,MENG等[10]通过调整g-C3N4的制备过程,合成了具有高氮含量、高比表面积的类石墨烯g-C3N4纳米片。由于所制备的g-C3N4纳米片具有更多可以作为化学位点的氮原子,这使得活性物质均匀地分散在g-C3N4的表面,与此同时,Li-N键的形成可以增强基体与可溶中间体的作用力,维持电池稳定运行。此外,通过对g-C3N4结构的重新设计,可以防止活性材料与有机电解液的直接接触,从而有效地抑制多硫化物的溶解。例如,YANG[11]和DI等[12]都用硬模板法制备了空心g-C3N4球,用来包裹活性材料,有效地阻止了活性材料与有机电解质直接接触,通过物理限制的方式提高电池的循环性能。最近,我们注意到掺杂的石墨碳可以有效地促进电子的转移,降低化学反应的阻力[13]。因此,制备具有优异结构和物理化学特性的g-C3N4作为锂硫电池正极宿主材料,并探究其在锂硫电池的作用和机理备受期待。
本研究采用尿素为原料,以柠檬酸为添加材料,通过一步热缩聚的方法,制备了多孔石墨相氮化碳(PCN)。并以S@PCN为正极测试了锂硫电池的电化学性能。
1 实验部分
1.1 试剂及仪器
尿素,国药集团化学试剂有限公司;柠檬酸,国药集团化学试剂有限公司;硫,麦克林试剂公司;多壁碳纳米管,麦克林试剂公司;BP2000导电炭黑,麦克林试剂公司;La133粘结剂,四川茵地乐科技有限公司;双三氟甲基磺酸亚酰胺锂/(1,3-二氧戊环/1,2-二甲氧基乙烷(体积比1∶1))电解液,北京百灵威有限公司。
蓝电电池测试系统,CT2001A型,武汉蓝电有限公司;电化学工作站,CHI660E型,上海辰华有限公司;X射线衍射仪(XRD),D/MAX/2500PC型,日本理学株式会社;比表面积与孔隙度分析仪(BET),ASAP2020型,美国麦克;透射电子显微镜(TEM),JEM-2100PLUS型,日本电子公司;场发射扫描电镜(FESEM),JSM-6700F型,日本电子株式会社;X射线光电子能谱仪(XPS),ESCALABXI+型,赛默飞有限公司;荧光分光光度计,F4600型,日本日立有限公司。
1.2 实验步骤
取20g尿素与1g柠檬酸混合研磨10min,之后将其置入带盖的坩埚中,按照2℃·min-1的速率,于550℃中烧结4h。冷却后,得到多孔石墨相氮化碳,记为PCN。作为对比实验,不添加柠檬酸,采用相同的合成过程制备了g-C3N4,记为CN。
取0.1gPCN和0.2g硫混合均匀,然后溶于10mL二硫化碳中超声10min。60℃烘干以去除二硫化碳,将干燥好的试样155℃保温12h,记为S@PCN。作为对照实验,采用相同的渗硫方法,将硫渗入到CN中,记为S@CN。
取0.21gS/PCN,0.03gBP2000导电炭黑和0.03g多壁碳纳米管,研磨均匀后,加入0.146g质量分数为15%的La133粘结剂水溶液,加水充分搅拌混合后,涂敷于铝箔表面。真空的环境下60℃干燥处理12h。裁成圆片,直径为12mm,作为电池正极。所制得电极片中硫的负载处于0.7~1.1 mg·cm-2之间。
1.3 吸附性能测试
量取相同体积的1,3-二氧戊环(DOL)和1,2-二甲氧基乙烷(DME)溶液,混合均匀后,向其中添加硫化锂与硫(物质的量比为1∶5),制备浓度为0.05 mol·L-1的Li2S6溶液。在75℃的恒温条件下,将溶液密封搅拌12 h,直到溶液为棕红色。分别取0.4 g CN和PCN加入4 m L上述溶液,吸附24 h后用荧光分光光度计进行吸附测试。
2 结果与讨论
2.1 制备过程与原理
图1是S@PCN的制备流程图。按照一定比例,将尿素和柠檬酸均匀混合,放入到带盖的坩埚中,然后在大气气氛中加热到所需的温度并进行保温。在高温过程中,柠檬酸受热分解放出的二氧化碳和水,可以对原始的g-C3N4的形貌进行调节,形成薄片多孔结构[14]。柠檬酸分解所得的一些活性碳会以适当方式掺杂到g-C3N4的晶格中,可以增强对硫的附着力。在渗硫过程中,这种多孔结构及特殊的化学特性,使得硫可以很好地分散于PCN基体中。
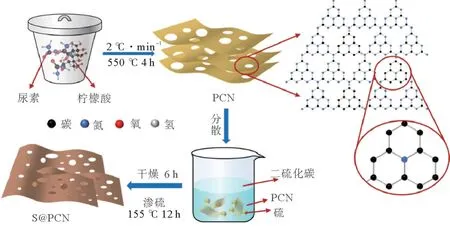
图1 S@PCN制备流程图Fig.1 Schematic formation of S@PCN
2.2 物相和形貌表征
图2(a)、(b)分别是CN和PCN的透射图片。从图2(a)、(b)中可以看到,CN呈现出很明显的三维块状结构,整个层片都堆叠在一起。而PCN则呈现出了非常薄的片状结构,在其表面上均匀分布大量的孔隙。虽然CN在图2(a)中也显露出很多孔洞,但是由于片层都堆叠在一起,这些孔洞都被包覆在氮化碳的内部,在渗硫过程中相当大程度上属于无效孔隙,无法提供足够的空间负载硫在转变过程中扩大的体积。相反,在制备PCN的过程中,前驱体释放的气体分子使堆叠在一起的薄片剥离开来,暴露了包覆在内部的片层和孔洞,因此制备的PCN具有更大的比表面积和更多的孔洞。这些比表面积和孔洞能提供大量的缓冲空间容纳变化的体积,有利于维持电极材料的完整性。图2(c)、(d)是PCN渗硫后的扫描电镜照片以及对应的元素分布图谱。从元素分布图谱中可以看到,硫均匀地分布在材料的表面,这是因为丰富的孔洞可以作为硫的附着点,防止硫团聚。同时,硫也可以牢牢地与PCN结合在一起,从而提高硫的利用率和电池的容量。
图3(a)是CN、PCN的XRD谱图。CN的XRD在13.1°和27.4°左右有2个峰。其中13.1°处的峰对应于(100)晶面,与平面内重复的3-s-三嗪单元有关;27.4°处的峰对应于(002)晶面,代表着石墨片状的堆叠[15]。由于碳等杂原子的引入改变了晶面间距,这使得PCN在27.4°处的峰发生了很明显的峰移,从之前的27.4°移向了26.4°。此外,峰的强度下降明显,半峰宽变大,意味着说明氮化碳的有序度,堆叠程度被破坏,反应在透射图上,则表示为更薄的片状结构。在13.1°处的峰消失,说明嵌入石墨碳后,平面内3-s-三嗪单元的重复排列发生了破坏。图3(b)是CN和PCN的BET曲线。PCN的BET曲线表现出了很明显的Ⅵ型特征,呈现出很明显的介孔结构。图3(c)的孔径分布也可以看到,PCN的孔径分布主要集中在2~30 nm之间。PCN的比表面积根据计算可以达到79.9 m2·g-1,而普通氮化碳的BET比表面积仅为7.1 m2·g-1,这种结果也与TEM形貌所对应。图3(d)是CN和PCN的XPS总谱图,所制备的试样主要含有C、N、O 3种元素。在CN中,C、N、O各原子所占的比例为42.38%,54.78%和2.84%,而PCN中C、N、O所占的比例则为48.11%,49.59%和2.29%。很明显地,试样中C原子有很明显的上升,说明在热缩聚的过程中有C原子掺入其中。此外,两者试样都含有少部分的O元素,归因于吸附的水,氧等所产生的表面污染[16]。
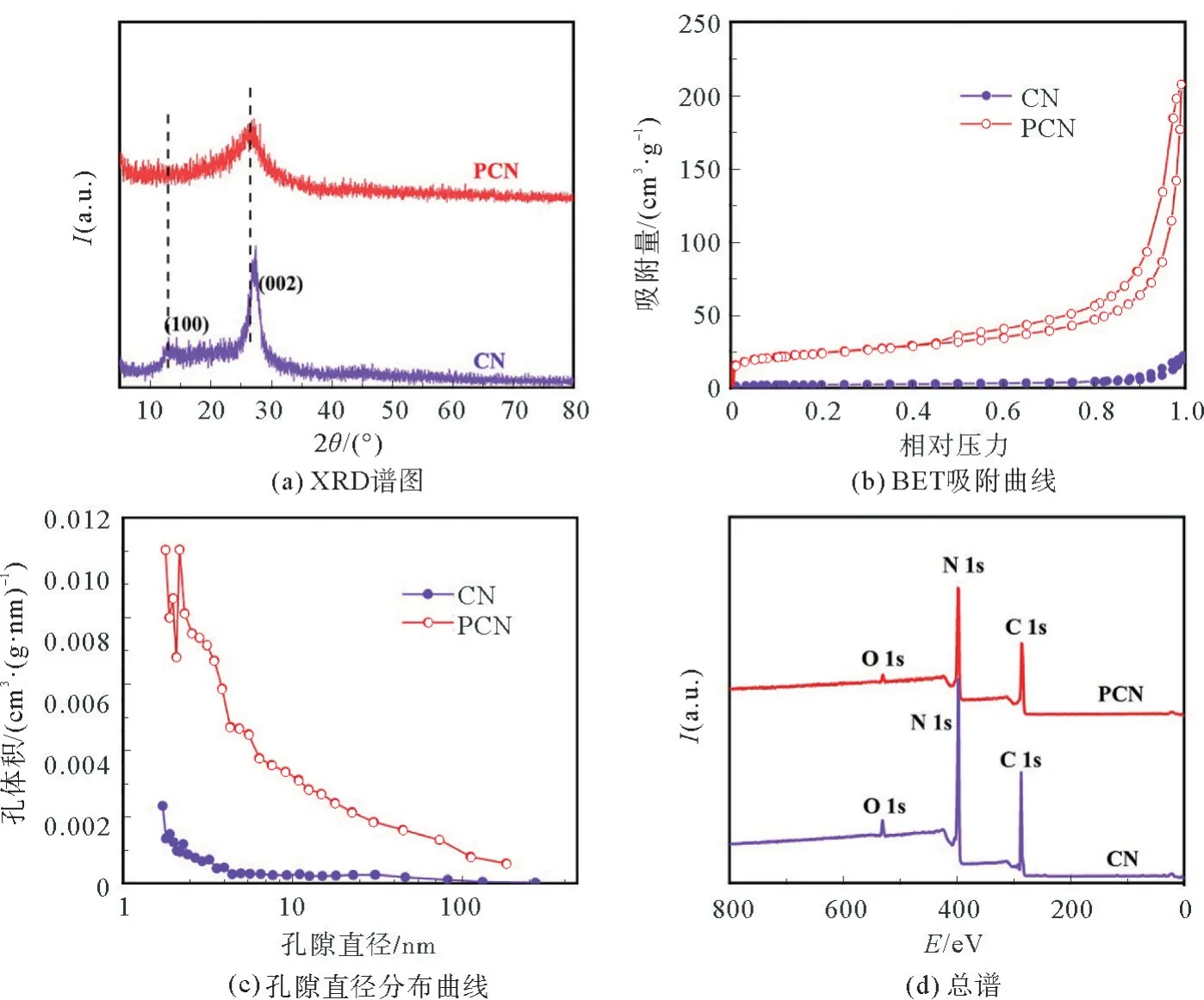
图3 CN和PCN的XRD,BET,孔径分布和XPS谱图Fig.3 XRD,BET,pore size distributions and XPS spectra of CN and PCN
CN和PCN的高分辨率谱图如图4所示。PCN的C 1s可以为分解为287.5,286.1,和284.8 e V 3个峰,分别对应着氮化碳框架中的N—C=N键,在三嗪单元的边缘C—NHx(x=1,2)键和位于石墨碳中的C=C/C—C键[17]。与CN的C 1s图谱相比,PCN在286.1的峰和284.8 e V的峰有着明显的上升,说明有大量的C—NHx(x=1,2)键和C=C/C—C键形成。这是因为碳等杂原子的嵌入,引入了大量的C=C/C—C键,同时部分C—N键断裂形成NH键,如示意图所示。此外,石墨碳的导电性优异,能够有效地弥补普通g-C3N4电子传输能力不足的问题,提高硫的利用率。PCN的N 1s谱图可以分解为398.6,400.2,401.1和404.3 e V 4个峰。398.6,400.2和401.1 eV分别对应着与2个C原子结合位于三嗪环上的芳香N键(C—N=C),与3个C原子连接的sp2N键(C—N(—C)—C),位于边缘的sp3N键(NH2)。而404.3 eV的峰还未确定,可能杂环中的正电荷限制导致的[18]。sp2N键(C—N(—C)—C)的提高说明N原子存在于石墨碳中心。同时,其结合能与吡咯N类似,可以使多硫化物锚定在正极,有利于电池正极材料的稳定性。
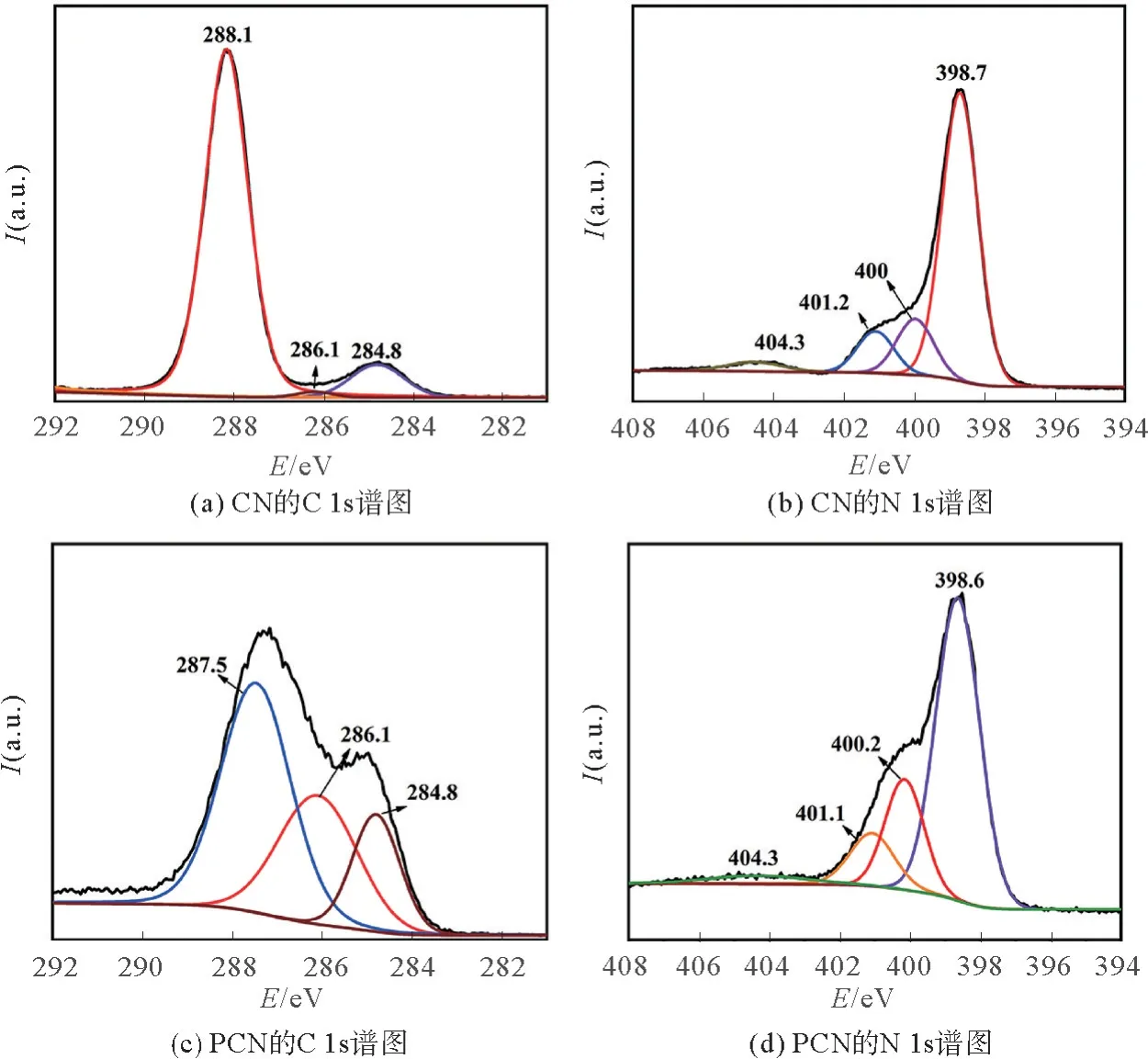
图4 CN和PCN的C 1s和N 1s谱图Fig.4 C1s and N 1s spectra of CN and PCN
2.3 电化学性能研究
图5(a)是S@PCN和S@CN第二圈循环伏安(CV)曲线。在1.7~2.8 V的测试范围内,S@PCN在2.3和2.05 V的峰代表着还原峰,氧化峰位于2.35 V。考虑到不同动力学的复杂反应路径以及聚硫化物在电池的扩散,硫的锂化过程是非常复杂的。其中,S8→Li2S8→Li2S6/Li2S4的转变可以由位于2.3 V处的还原峰表示,2.05 V的还原峰则可以表示Li2S4→Li2S2/Li2S的转变过程;位于2.35 V处的氧化峰则代表着S2-转变为S的过程[19]。与S@CN相比,S@PCN的还原转变开始电压更高,氧化转变开始的电压更低,峰形更加高耸。这说明PCN的导电性更好,能够降低电池的极化程度和化学反应阻力,提高材料的利用率。硫宿主材料对多硫化物的吸附对于抑制容量衰减十分重要。为了进一步说明PCN对多硫化物具有良好的吸附性能,采用荧光分光光度计测试了CN和PCN对Li2S6的吸附性能,结果如图5(b)所示。将等量的CN和PCN加入到Li2S6溶液中,吸附24 h后测试溶液的吸收度。可以发现,经PCN吸收后,峰的强度明显下降,说明溶液中的Li2S6更少,意味着PCN对多硫化物有着更为出色的吸附能力。这是碳等杂原子嵌入g-C3N4晶格以后,晶格中N元素的化合价状态发生了改变,使其能够更好地吸附多硫化物。
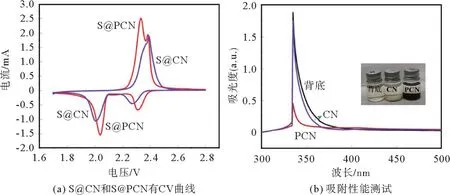
图5 CV曲线与Li2 S6的吸附曲线Fig.5 Curves for CV and Li2 S6 adsorption
图6是S@CN和S@PCN的电化学性能分析结果。如图6(a)的首圈电压-比容量所示,锂硫电池在2.3和2.05 V左右各有1个放电平台,其放电容量分别占总放电容量的1/4和3/4,分别代表着硫转变为可溶长链中间体以及进一步转变为不溶的硫化锂的过程。相比来说,PCN的充放电平台更长,放电比容量更高,达到了1 150 m Ah·g-1,而S@CN的放电比容量仅为830 m Ah·g-1。更长充放电比容量说明了有更多的硫参与了电池的反应过程,这进一步说明了所制备的PCN能够提高电导率,降低电化学阻力。此外,测试了S@PCN在多种电流条件下的性能,如图6(b)所示。在0.2,0.5,1.0,2.0 C的测试条件下,S@PCN的比容量分别为1 033,753,629,505 m Ah·g-1。而重新调整测试条件为0.2 C时,比容量恢复到786 m Ah·g-1,分别明显高于S@CN的590,487,409,391,663 m Ah·g-1。S@PCN在恢复为0.2 C时,恢复性能略低于S@CN,是因为PCN提高了硫的利用率,这使得需要捕获的多硫化物更多,导致硫更加容易损失,比容量更难以恢复到初始状态。可即便如此,S@PCN在放电倍率为0.2 C时,其恢复后的比容量也明显高于S@CN。较高的恢复比容量说明了PCN材料能够提高硫的利用率,维持电池的稳定性。为了证明所制备的PCN可以提高电荷转移速率,降低反应阻力,测试了S@PCN和S@CN的阻抗性能结果见图6(c)。从图6(c)中可以看到,电池的阻抗主要由R0,Rct和Zw构成[20]。其中,R0代表着电池的电阻,位于半圆开始与x轴相交处,大约为4Ω;电荷转移阻抗由位于高频区的半圆Rct表示,S@PCN和S@CN的Rct分别为50和75Ω。Zw则由锂离子扩散形成,由斜线表示。很明显地,以CN为宿主材料的电荷转移阻抗(75Ω)明显高于PCN的电荷转移阻抗(50Ω),这说明PCN试样的电荷传输能力得到加强,这与CV曲线的结论相一致。S@PCN和S@CN的恒流充放电如图6(d)所示。为了使硫充分参与反应,先用0.05 C活化两圈,随后用1.0 C测试。明显地,以PCN为正极导电基体,电池循环稳定性以及放电容量都显著优于以CN为导电基体的锂硫电池。在充放电150次以后,S@PCN比容量仍然高达700 m Ah·g-1,而用CN做宿主材料在相同的测试条件下比容量仅为480 m Ah·g-1。即使在2.0 C的高倍率循环测试中,S@PCN在工作350次以后,比容量依然有484 m Ah·g-1,容量保持率为74.46%,单圈的容量衰减仅为0.09%,库伦效率维持在90%以上。表1总结了一些以改性或掺杂氮化碳为宿主材料的电池性能。可以发现,本研究所制备的PCN宿主材料与CN的类似报道相比在容量保持率和能量密度等方面是很有优势的,进一步说明了PCN作为锂硫电池正极宿主材料的应用潜力。
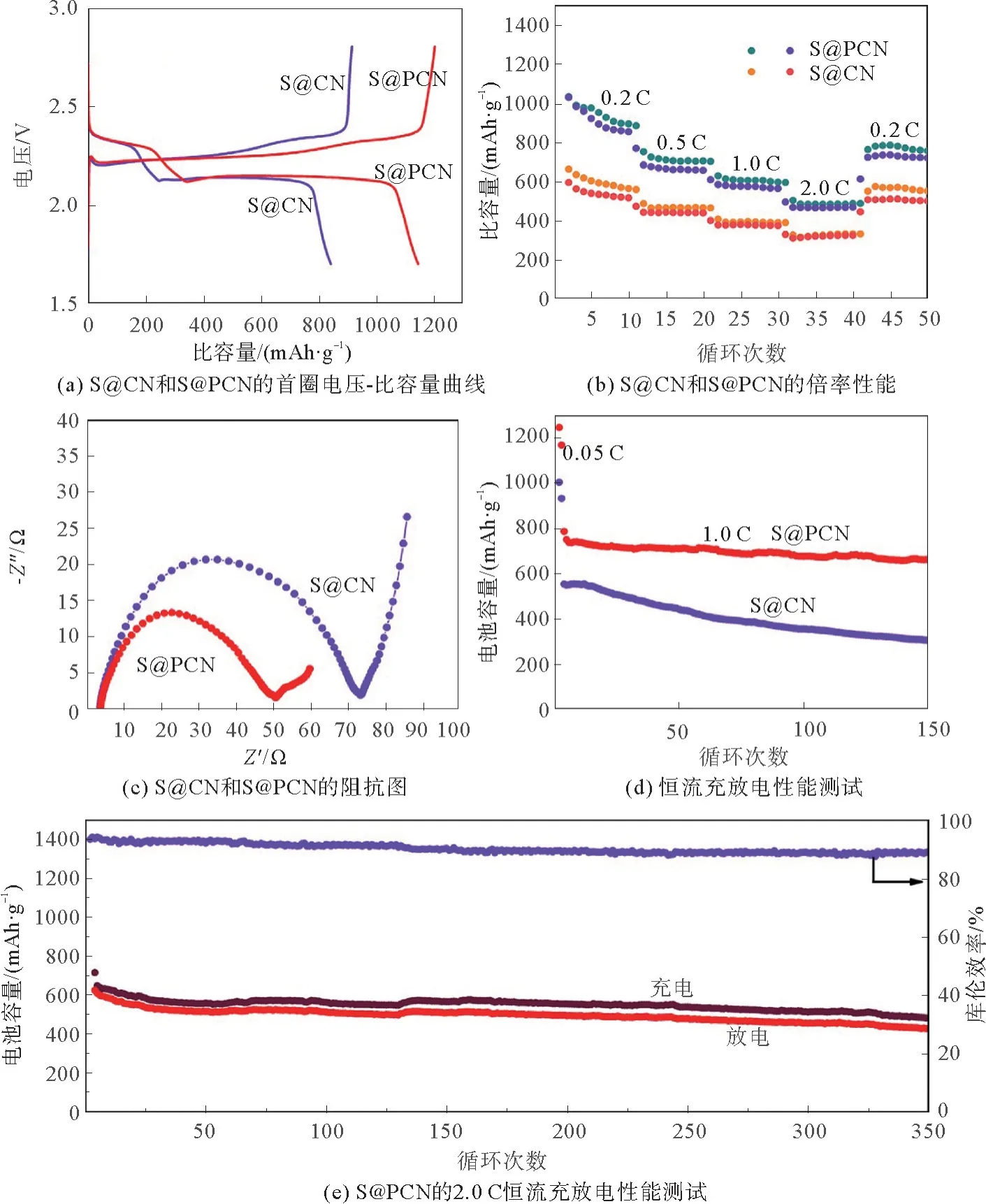
图6 S@CN和S@PCN的电化学分析结果Fig.6 Electrochemical analysis results of S@CN and S@PCN
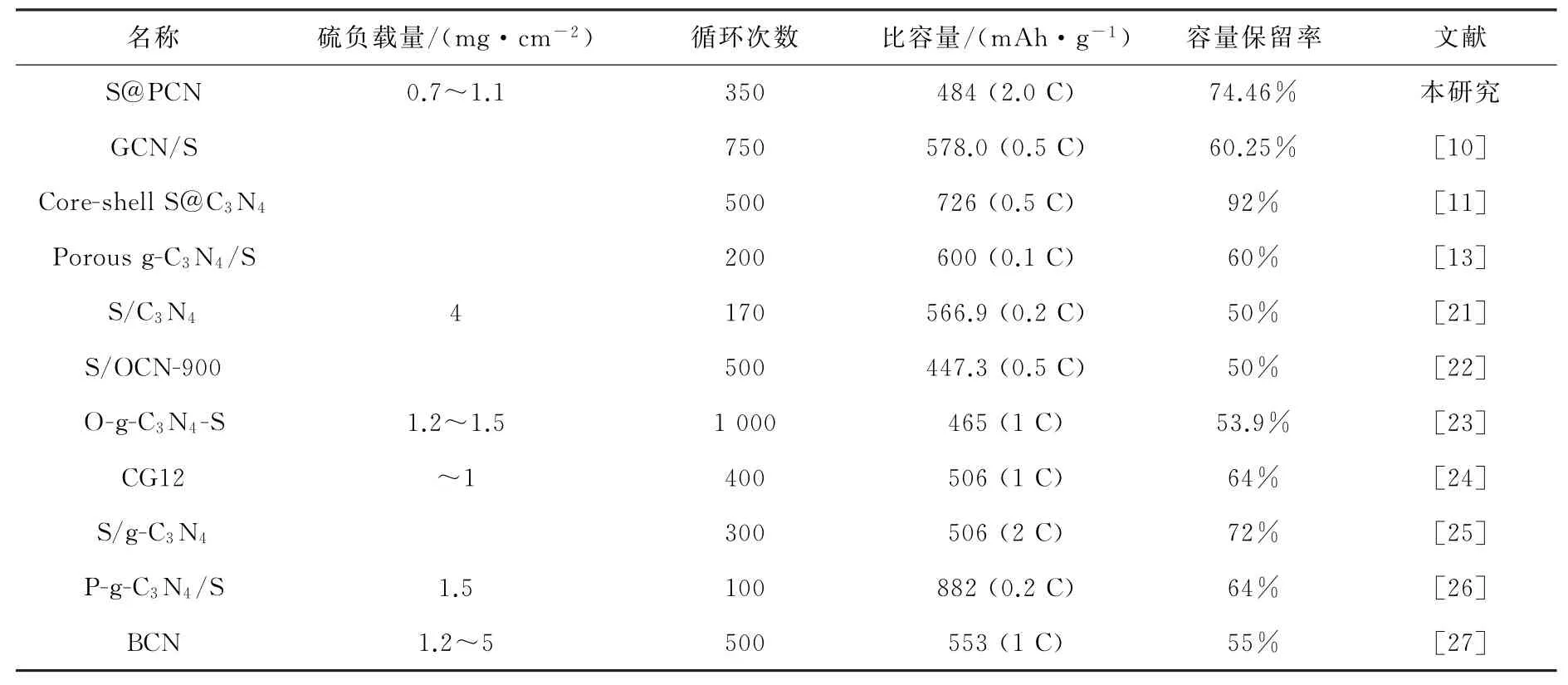
表1 锂硫电池中以掺杂或改性g-C3 N4为宿主材料的电化学性能对比Table 1 Comparison of electrochemical properties of doped or modified g-C3 N4 as host materials in lithium-sulfur batteries
通过实验可以发现,PCN作为宿主材料能够很好地提高锂硫电池的性能,这归因于以下几个方面:1)较薄的层片以及较多的孔隙提高了材料的比表面积,可以缓解硫膨胀的体积对正极结构的破坏,维持电池的正常运行;2)石墨碳能够改善PCN的导电性,减弱硫是绝缘体的不利影响,提高硫的利用率;3)杂质元素的嵌入,改变了基体中氮元素的化学态,有效地提高了对多硫化物的吸附性,保障了电池的稳定运行。
3 结 论
采用简单的一步热缩聚的方法,将尿素与柠檬酸共同加热,制备了多孔的石墨相氮化碳(PCN)。以S@PCN为正极测试了锂硫电池的电化学性能。在1.0 C下工作150次后仍然有高于700 m Ah·g-1放电比容量,即使在2.0 C的高电流密度测试条件下,循环350圈后仍然有74.46%的容量留存,以及484 m Ah·g-1的放电容量。虽然将多孔氮化碳作为正极材料应用到锂硫电池当中已有相关报道,但是通常使用CMK、SBA-15等作为硬模板获得多孔结构,步骤复杂、过程苛刻,本研究巧妙地利用柠檬酸在高温下分解直接获得多孔氮化碳,比其他报道方法简单易行,操作性及可复制性很强。实验结果表明,以PCN作为锂硫电池正极宿主材料,能够显著地提高电池的性能,作为锂硫电池正极硫的宿主材料有很大的应用潜力。这些性能虽然和理论容量1 675 m Ah·g-1相比还有一定距离,但仍然远远高于商用锂离子电池正极材料的比容量。出色的电化学性能归因于:PCN具有优异的多孔结构能够承载容纳更多的硫和提供更快的离子传输通道,以及对多硫化物更强的键合能力。

