国产经导管人工主动脉自膨胀瓣膜置入术后2年组织学分析
刘巍 邝大军 杨剑 杨立 刘兆刚 许莎莎 雷洋 王云兵
随着人口老龄化和生活水平的改变,退行性瓣膜疾病的患病率大幅上升。外科瓣膜置换术或修补术是目前瓣膜病患者的标准治疗方法。然而,在过去的十多年里,经导管技术迅速发展。经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)早期应用于外科风险极高的重度症状性主动脉瓣狭窄患者,目前,手术适应证逐渐向手术中危或低危患者过渡。既往研究显示无论是球囊扩张还是自膨胀瓣膜,在临床预后方面均不劣于甚至优于外科瓣膜[1]。但由于生物瓣膜面临着早期衰败的风险,限制了经皮导管手术在更为年轻的患者中的应用。所以也迫切地需要对置入瓣膜发生的组织学变化进行分析,以促进产品材料和性能的改进。现有经导管人工主动脉瓣膜材料基础研究报道主要为体外实验、大动物实验以及TAVR试验的数据,少有TAVR一段时间后的数据报道。本研究由北京积水潭医院(北京大学第四临床医学院)对TAVR术后2年后取出的国产经导管人工主动脉瓣膜Venus A valve进行外观、钙化情况、微观结构、组织切片以及免疫组化的分析和评价,有助于进一步了解国产瓣膜产品置入人体后的性能变化。
1 临床资料
1.1 研究对象
患者 男,58岁。于2018年5月11日因主动脉瓣狭窄伴关闭不全,主动脉瓣二瓣畸形,重度通气功能障碍,顺利置入26 mm Venus A valve瓣膜。术后因房室传导阻滞行永久起搏器植入术。于2020年5月7日因胸闷、气短、心悸1个月,发热3 d再次入住空军军医大学西京医院,诊断:感染性心内膜炎,TAVR术后,主动脉瓣瓣周漏, 美国纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅲ级,心脏起搏器植入术后。行体外循环下取出人工瓣膜,清除赘生物、切除病变主动脉瓣,将机械瓣缝合至主动脉瓣瓣环上。
1.2 外观观察
通过光学显微镜对样品进行外观检查,瓣膜的支架无变形、破损,缝线无断裂。图1为瓣膜在光学显微镜下拍摄的图片,从图中可以看出瓣膜支架大面积被人体组织覆盖。在瓣膜流出端,组织覆盖从瓣膜护耳处往上蔓延,并在瓣叶根部附近覆盖。在瓣膜流入端,裙体也基本被组织覆盖。瓣叶上下表面光滑,无明显血栓形成、无撕裂,瓣叶关闭功能正常,依旧保持柔软。

图1 光学显微镜下瓣膜外观
1.3 厚度测试
将样品与金属支架直接分离,再将瓣叶和裙体剪下(图2),用测厚仪测量其厚度。瓣叶和裙体的厚度见表1。正常瓣叶的厚度在0.3 mm左右,裙体的厚度在0.2 mm左右。表1中瓣叶和裙体的厚度已经超过了瓣膜出厂时瓣叶和裙体的厚度,说明在置入人体2年后,瓣叶和裙体表面有一层物质生成,且裙体增厚幅度要大于瓣叶的增厚幅度,这与外观图结果一致。

表1 瓣叶和裙体厚度

图2 瓣膜拆解
1.4 X线观察
测试条件为:Xray_voltage_kV=55.000000,Xray_current_mA=0.170000。设置好仪器测试条件后,拍片观察样品的钙化情况。用X线来分析瓣膜整体钙化情况。从图3可知,瓣膜整体基本没有钙化,只在由下往上第3个菱形格交叉附近有一处钙化点(红色箭头所示),图3C显示瓣膜中间瓣叶处没有钙化点。

图3 瓣膜X 线钙化分析(红色箭头所示)
1.5 扫描电镜(scanning electron microscope,SEM)观察
测试条件为样品在5-k V下,放大倍数由低往高观察。样品冷冻切片(-30℃)。样品分别逐级在50%、70%、90%、100%乙醇溶液中浸泡10 min,其中在100%乙醇溶液中浸泡2次;超临界干燥4 h;将干燥后的样品喷金;以SEM观察。将剪下的瓣叶按图4中箭头方向观察样品的横截面。图5是三个区域中比较有代表性的图片。图5A是猪心包膜的截面图,可以看出胶原纤维排列紧密,有明显的纤维层与纤维束。图5B中左下方纤维和右上方纤维在排列上有明显差异,右上方为心包组织,纤维排列紧致,纤维方向一致性较好,纤维间无明显撕裂、断裂情况。瓣膜置入人体2年,瓣叶纤维结构无显著变化。左下方为心包膜增生组织,纤维方向杂乱,结构松散。对左下方纤维和右上方纤维分别放大2000倍进行观察(图5C~D),可以发现图5D的截面空洞多,结构松散,没有层次感;图5C的横截面纤维排列相对紧密,能看到纤维束,有层次感,这与图5B中展现的形貌是一致的。本研究组认为瓣叶表面纤维化,使得瓣叶增厚,其表面的纤维结构松散。
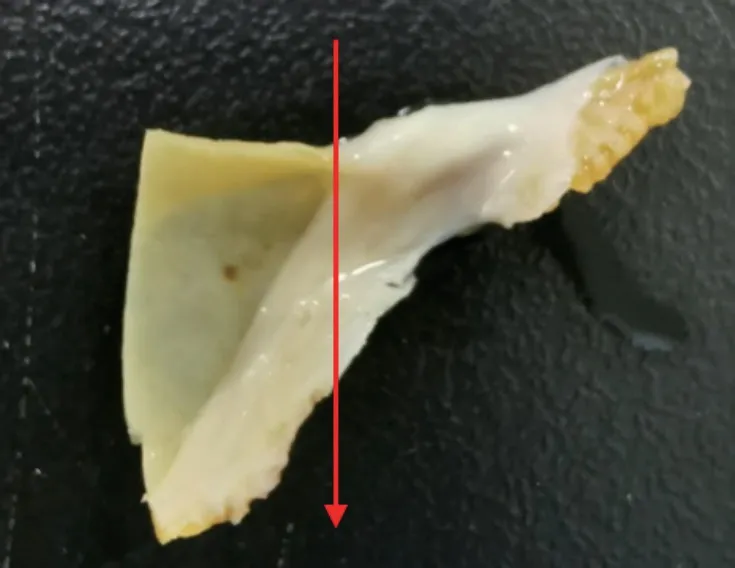
图4 瓣叶横截面方向

图5 样品扫描电镜图
1.6 苏木素-伊红(hematoxylin-eosin,HE)染色
将样 品用酒精梯度脱水后,用二甲苯透明处理,再将处理后的样品用石蜡包埋,用切片机切成4 μm的石蜡带,最后将样品进行烤片处理。将烘烤后的组织切片用二甲苯进行脱蜡,脱蜡后的组织切片用梯度酒精和蒸馏水处理,用HE染色,再用酒精和二甲苯处理后封片。用显微镜观察HE染色组织切片。
将样品按图6所示分成3个区域,所有切片按横向切,染色后对3个区域进行观察。从样品外观图就可以看到流出端瓣叶根部及护耳处有血管翳产生。图7是图6顶部区域的HE染色图。图7B、C是图7A的黑色矩形区域放大图。图7A的切片整体染色结果与图6顶部区域的外观保持一致。瓣叶开闭活动区域无明显增生,瓣叶根部及护耳处增生显著。从图7C中可知,增生的血管翳厚度可达约300 μm,主要分布在瓣膜流出端,也有少量分布于瓣膜流入端。
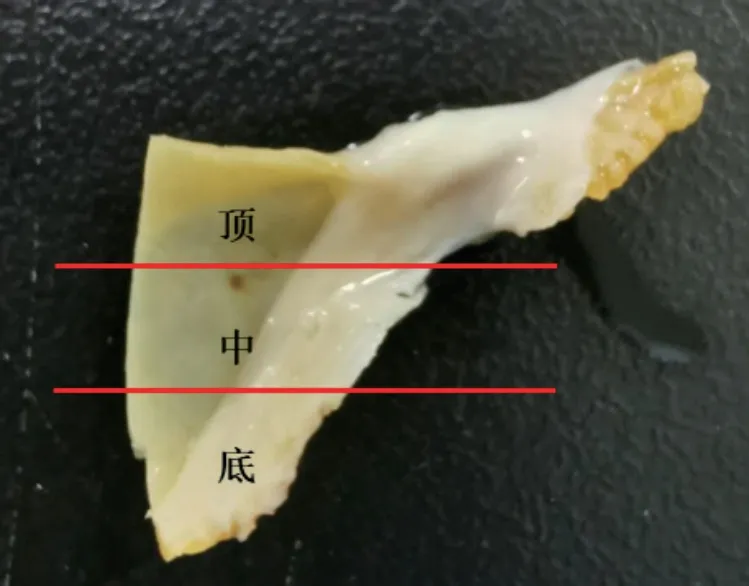
图6 瓣叶分区

图7 样品苏木素-伊红染色
1.7 V on Kossa染色
将样品用酒精梯度脱水后,用二甲苯透明处理,再将处理后的样品用石蜡包埋,用切片机切成4 μm的石蜡带,最后将样品进行烤片处理。将烘烤后的组织切片用二甲苯进行脱蜡,脱蜡后的组织切片用梯度酒精和蒸馏水处理。加入硝酸银在紫外灯照射下反应,用蒸馏水洗后加入硫代硫酸钠溶液染色,再用蒸馏水洗,用核固红染液染核,再用酒精和二甲苯处理后封片。用显微镜观察Von Kossa染色组织切片。
Von Kossa染色主要是观察瓣叶的钙化情况,该染色方法可以使钙结节呈现可见的黑颜色。从染色结果看,图8中没有看到明显的黑色钙化点。从X线分析中看到瓣膜钙化点仅有一处,主要分布在裙体上。Von Kossa染色结果与X线结果一致。

图8 样品Von Kossa 染色
1.8 Mo vat染色
将样品用酒精梯度脱水后,用二甲苯透明处理,再将处理后的样品用石蜡包埋,用切片机切成4 μm的石蜡带,最后将样品进行烤片处理。石蜡切片脱蜡至水,水洗;以1%阿利新蓝水溶液染色15 min;用已在60℃预热30 min的碱性乙醇分化3~5 s,具体以镜检为主;EVG染色30 min,5% FeCl₃分化,镜检弹力纤维黑色,弹力纤维间隙无色为好;番红O/酸性品红染色3~5 min,水稍洗;1%磷钼酸染1~2 min;直接入1%的冰醋酸分化2~5 min;水稍洗,入天狼猩红染色2 min,此步不可过长,否则黄色易遮盖黑色的弹力纤维;以两缸无水乙醇分化脱水,两缸二甲苯透明,中性树胶湿封。用显微镜观察Movat染色组织切片。
用Movat染色法将细胞核和弹力纤维显黑色,蛋白聚糖显蓝色,胶原纤维网状纤维显黄色,心肌平滑肌显红色,泡沫细胞显紫色。猪心包膜主要成分有胶原纤维、弹性纤维,因此在染色中猪心包膜的颜色应该是黄色夹杂黑色。图9中可以看到显黄色的猪心包膜厚度约为300 μm,其表面都有不同程度的增生物质存在。图9A看到样品流入端(上侧)表面纤维化,图9B和图9C显示在流出端(下侧)增生组织为棕黄色和蓝色相间,说明增生组织主要是胶原纤维、网状纤维和蛋白聚糖。据文献报道[2],随着时间的推移,蛋白多糖被Ⅰ型胶原取代,新生内膜组织细胞减少,纤维化程度增加,进而使得瓣叶增厚。

图9 样品Movat 染色
1.9 AB-PAS染色
将样品用酒精梯度脱水后,用二甲苯透明处理,再将处理后的样品用石蜡包埋,用切片机切成4 μm的石蜡带,最后将样品进行烤片处理。将烘烤后的组织切片,用二甲苯脱蜡,脱蜡后的组织切片用梯度酒精和蒸馏水处理。用阿利新蓝染色后水洗,高碘酸氧化后用雪夫试剂染色。再用酒精和二甲苯处理后封片。用显微镜观察ABPAS染色组织切片。
以AB-PAS染色法使糖原、中性黏液物质呈红色,酸性黏液物质呈蓝色,混合性黏液物质呈蓝紫色或紫蓝色,胞核呈蓝色。从图10可以看出,增生组织蓝色均匀分布,表明酸性黏多糖的存在。Movat染色结果与AB-PAS结果一致,说明增生组织中含有大量酸性黏多糖。

图10 样品AB-PAS 染色
1.10 Masson染色
将样品用酒精梯度脱水后,用二甲苯透明处理,再将处理后的样品用石蜡包埋,用切片机切成4 μm的石蜡带,最后将样品进行烤片处理。将烘烤后的组织切片用二甲苯脱蜡,脱蜡后的组织切片用梯度酒精和蒸馏水处理。用苏木素染细胞核后,再用丽春红染色,磷钼酸处理,苯胺蓝染色。用冰醋酸处理后,再用酒精和二甲苯处理后封片。用显微镜观察Masson染色组织切片。
1.11 免疫组化(CD31、CD68和α-SMA)
将样品用酒精梯度脱水后,用二甲苯透明处理,再将处理后的样品用石蜡包埋,用切片机切成4 μm的石蜡带,最后将样品进行烤片处理。将烘烤后的组织切片用二甲苯脱蜡,脱蜡后的组织切片用梯度酒精和蒸馏水处理。在EDTA(pH8.0)抗原修复液的修复盒中于微波炉内进行抗原修复,自然冷却后在脱色摇床上洗涤。在玻片上画圈,切片加上内源性过氧化物酶,在组化圈内滴加BSA封闭。加一抗二抗后用DAB显示,苏木素复染细胞核,再用酒精和二甲苯处理后封片。用显微镜观察组织切片。
(1)CD31和CD68染色:CD31与CD68分别是内皮细胞和炎性细胞的标记物。图11A和图11B分别是CD31与CD68标记的结果。从图11中可以看到样品在流入端表面存在内皮细胞,内皮化主要存在于瓣叶中、下部,自由端几乎没有发现内皮细胞。表明瓣膜中、下端有内皮化倾向。瓣膜的内皮化可使其表面形成光滑的内膜,有助于防止血栓沉积。在流出端和流入端表面局部区域存在少量炎性细胞,表明血管内一直伴有炎症。
图11 样品内皮与炎性细胞分析
(2)α-SMA染色:α-SMA是平滑肌细胞的标记物,有平滑肌细胞的地方被标记成黄色,结果见图12A和图12B。图中增生组织中含有大量平滑肌细胞,平滑肌细胞零散分布于增生组织内,在血管接触部分平滑肌细胞密度较高。Movat(图12C)和Masson(图12D)染色结果也可以表明平滑肌细胞在增生组织中大量存在。

图12 α-SMA(A、B)、Movat(C)和Masson(D)染色
2 讨论
本研究首次报道了国产自膨胀TAVR瓣膜(Venus A)置入后2年的病理变化。首先从外观上看瓣膜支架大面积被人体组织覆盖。在瓣膜流出端,组织覆盖从瓣膜护耳处往上蔓延,并在瓣叶根部附近覆盖。在瓣膜流入端,裙体也基本被组织覆盖。瓣叶上下表面光滑无血栓、无撕裂,瓣叶关闭功能正常,依旧保持柔软。从X线与Von Kossa染色分析所知,瓣膜整体基本没有明显的钙化点分布,只有一处分布在裙体上,瓣叶位置没有发生钙化。TAVR术后2年后,瓣叶和裙体都表现出不同程度的增厚,瓣叶增厚部分在微观上表现为截面空洞多,纤维结构松散,没有层次感,裙体增厚幅度要大于瓣叶的增厚幅度。从HE染色图中可知增生的血管翳厚度可达约300 μm,主要分布在瓣膜流出端,也有少量分布于瓣膜流入端。Movat、AB-PAS染色显示增生组织中存在蛋白聚糖。用CD31、CD68和α-SMA作为标记物,发现瓣膜瓣叶中下部有内皮化倾向,且带有轻微的炎症。同时增生组织中含有大量平滑肌细胞,而且从免疫组化结果来看,增生组织中还有大量无法标记的成纤维细胞。
目前,关于经皮主动脉瓣膜置入的组织学分析鲜有报道[2-5]。有研究报道了22例患者瓣膜置入时间从0~2583 d引起瓣叶增厚和瓣膜变性的过程,结果表明血栓形成、内皮增生、纤维化、组织重塑、蛋白酶表达和钙化等病理变化存在时间依赖性[3]。血栓形成最早发生于瓣膜置入数小时内,60 d后发生纤维化,而钙化多发生于4年后。与该文献报道相似,本研究Venus A valve瓣膜TAVR术后2年后出现内皮增生、纤维化导致的瓣叶增厚,但未出现明显钙化。根据既往病理研究报道,经皮主动脉瓣膜血栓发生率为20%~100%,且瓣膜纤维化多与血栓共存,提示瓣膜纤维化可能与血栓相关。但本病例中未发现血栓证据,发现内膜覆盖不完全及少许炎症,提示可能为纤维化的基础。
另有研究报道了21例采用Core Valve产品心脏瓣膜置入术患者从2005至2007年的置入物组织学分析结果,组织病理学检查表明在瓣膜置入后早期表现为纤维蛋白沉积和炎症反应,随着时间推移,炎症反应逐渐消退并产生新内膜覆盖[2]。本研究为首个国产瓣膜置入后的组织学研究,由于病例数少,很难包括各种临床场景,具有一定的局限性。但与国外同类产品相比,国产瓣膜置入TAVR术后2年后的基本组织变化相似。从未来开发上,针对于早期出现内膜过度增生及纤维化这一共性,或许会为仿生化瓣膜的改进提供一个更好的选择。
利益冲突 所有作者均声明不存在利益冲突

