芹菜素通过PDK1/AKT信号通路抑制小鼠肝纤维化
陈鑫栋,仲威龙,闫佩瑶,匡佳妮,乔锴亮,孙 涛,黄 飚,秦 源
(1. 浙江理工大学生命科学与医药学院,浙江 杭州 310018;2. 天津医科大学总医院消化内科,天津市消化疾病研究所,天津市消化病学重点实验室,天津 300052;3. 南开大学药学院,药物化学生物学国家重点实验室,天津 300350)
肝纤维化是一种肝脏的慢性疾病,晚期肝纤维化会发展为肝硬化与肝功能衰竭,全球每年有超过100万人死于肝纤维化导致的终末期肝病[1]。目前,针对肝纤维化的主要治疗思路包括:肝脏保护、抑制肝星状细胞活性和调节免疫。尽管针对肝纤维化的药物研究众多,但目前临床上缺乏治疗肝纤维化的特异药物,尚无FDA批准的专门治疗肝纤维化的药物上市[2]。上皮间充质转化(epithelial-nesenchymal transition,EMT)是指具有上皮属性的细胞因某些因素的作用,导致细胞去极性,转化为具有间充质属性细胞的过程。众多研究显示,EMT在肝纤维化形成过程中发挥了重要作用,抑制肝星状细胞的EMT可以有效治疗肝纤维化[3]。
黄酮类小分子是两个具有酚羟基的苯环通过中央三碳原子相互连结而成的一系列化合物,其广泛存在于各种植物之中。多种黄酮分子具有保肝、护肝,抑制肝纤维化的作用[4-5]。目前,黄酮类分子水飞蓟宾常在临床上作为保肝药物使用,也用于治疗肝纤维化[6]。芹菜素也是一种典型的黄酮分子,其广泛存在于各种蔬菜水果中,具有抗炎、抗癌等广泛作用[7-8]。本团队前期的研究发现[9],芹菜素可以通过抑制肝癌细胞EMT,发挥抑制肝癌细胞增殖、转移的作用。但芹菜素对肝纤维化的治疗作用和机制尚未有报道。由于芹菜素在日常的水果、蔬菜中含量丰富,其新的药理机制的发现,不仅有助于新型保肝、抗肝纤维化药物的研发,也有助于指导人们通过日常饮食,预防肝病的发生。本研究将对芹菜素治疗肝纤维化的药效和药理机制进行研究。
1 材料与方法
1.1 试剂与实验动物芹菜素、水飞蓟宾单体购自成都普思生物科技股份有限公司,CCl4及其他相关生化试剂购自上海阿拉丁生化科技股份有限公司,DMEM培养基购自Sigma公司(货号:D0819),RNA抽提试剂盒(货号:R0026)、qRT-PCR试剂盒(货号:D7268M)购自碧云天生物有限公司。用DMSO将芹菜素配制20 g·L-1母液,用生理盐水稀释成实验所需浓度。医用级玉米油购自西安晋湘药用辅料有限公司(货号:456),丙氨酸转氨酶(ALT)(货号:C009-2-1)、天冬氨酸转氨酶(AST)(货号:C010-2-1)、白蛋白(ALB)(货号:A028-2-1)及总蛋白(TP)(货号:A045-2-2)测定试剂盒购自南京建成生物工程研究所有限公司)。
实验动物为SPF级健康昆明小鼠,体质量18~22 g,购自中国人民解放军军事医学科学院实验动物中心,实验动物许可证号码:0039483。磷酸化AKT(p-AKT S473,货号:ab81283)、磷酸化PDK1(p-PDK1 S241,货号:ab131098)蛋白抗体及免疫组化二抗(货号:ab99697)均购于Abcam公司。
1.2 模型建立与给药治疗将60只小鼠置于SPF屏障环境下适应性喂养1周后,采用区间分组法将小鼠随机分组:所有小鼠称取体质量后按大小排列编号,按序号依次分成10个区,随机从每个区中取一只小鼠形成一个组,分为对照组、模型组、阳性对照水飞蓟宾组(Silibinin组)、芹菜素低剂量组(Apigenin-L组)、芹菜素中剂量组(Apigenin-M组)、芹菜素高剂量组(Apigenin-H组),每组10只。建模方案综合参考了先前的研究并做了适当调整[10-12]:对照组小鼠每只每次背部皮下注射玉米油2 mL·kg-1;其余各组小鼠每只每次背部皮下注射含50% CCl4的玉米油混悬液2 mL·kg-1,每隔3 d注射一次,持续12周,建模及给药方法如Fig 1A所示。
于实验第3周开始给予小鼠药物治疗10周,Silibinin组55 mg·kg-1·d-1、Apigenin-L组15 mg·kg-1·d-1、Apigenin-M组30 mg·kg-1·d-1、Apigenin-H组60 mg·kg-1·d-1,对照组和模型组给予相同体积的生理盐水,灌胃给药。期间观察小鼠体重、运动、饮食及毛发等情况。(芹菜素与水飞蓟宾同为黄酮类物质,结构相似,Silibinin组与Apigenin-M组给药的摩尔量一致)。
1.3 肝脏大体形态记录及肝脏系数统计给药结束后,所有小鼠称重,并进行解剖取出肝脏,体式显微镜记录各组小鼠肝组织大体形态并进行称重,计算各组肝脏系数,根据对照组计算相对值,肝脏系数=肝脏质量/小鼠体质量。
1.4 肝功能指标相关指标检测实验结束时,各组小鼠摘除眼球取血,室温静置30 min,低温离心,取上清液,按照试剂盒说明书操作进行各组小鼠血清ALT、AST、ALB及TP含量测定。
1.5 肝组织的病理学检测及免疫组化将肝组织进行固定和脱水后制作成石蜡组织切片,一部分切片使用苏木精-伊红(HE)和Masson染色评价各组肝组织的形态学变化及胶原纤维含量的变化。另一部分切片分别使用磷酸化AKT抗体和磷酸化PDK1抗体及相应免疫组化二抗孵育,DAB显色。病理切片评分规则:染色强度评分按照无染色、浅棕黄色、棕黄色、棕褐色分别计0、1、2、3分;染色面积评分按照1%~25%、25%~50%、50%~75%、>75%分别计1、2、3、4分;总评分为二者的乘积。
1.6 qRT-PCR检测EMT标志物基因表达水平取各组小鼠新鲜肝脏组织20 mg,液氮中研磨裂解,提取RNA并进行qRT-PCR,分别检测E-cadherin基因CDH1、Vimentin基因Vim的mRNA水平。相关引物序列如下:CDH1上游引物序列为5′-TCATGAGTGTCCCCCGGTAT-3′,下游引物序列为5′-TCTTGAAGCGATTGCCCCAT-3′;Vim上游引物序列为5′-GGACCAGCTAACCAACGACA-3′,下游引物序列为5′-AAGGTCAAGACGTGCCAGAG-3′。
1.7 Western blot检测小鼠肝脏组织中蛋白表达取适量肝脏组织充分裂解并收取总蛋白,利用BCA法测定蛋白浓度。SDS-PAGE电泳并转印至PVDF膜进行封闭。使用相应抗体和二抗进行孵育,显影拍照记录并计算灰度值进行统计。

2 结果
2.1 芹菜素改善CCl4诱导的肝纤维化小鼠生活状态、恢复小鼠体质量建模期间对小鼠的一般生活状态进行观察,发现对照组小鼠反应灵敏,食欲较好,皮毛顺滑有光泽;模型组小鼠反应迟钝,萎靡不振,食欲较差,皮毛杂乱无光泽;芹菜素低、中、高各剂量组及水飞蓟宾组小鼠反应速度、食欲及毛发色泽均较模型组有所好转,且芹菜素的药效具有量效关系。实验期间持续监测各组小鼠的体质量变化,结果显示,对照组小鼠体质量平缓上升,建模各组小鼠随建模时间波动变化、整体上升,至实验结束时,各组小鼠体质量平均值由大到小依次为:对照组、芹菜素高剂量组、芹菜素中剂量组、水飞蓟宾组、芹菜素低剂量组和模型组。与对照组相比,模型组小鼠的体质量明显降低;与模型组相比,给药的4组小鼠体质量明显升高;H组小鼠的体质量改善明显好于S组(Fig 1B)。

Fig 1 Modeling drug administration profile and body weight change of miceA:Model establishment and administration of mice in each group; B:The trend of body weight in each group.
2.2 芹菜素对CCl4诱导的肝纤维化小鼠肝脏形态、肝系数及肝功能的作用实验结束解剖小鼠,将肝脏置于体视显微镜下观察统计,结果显示,与对照组相比,模型组小鼠肝脏颜色变浅变暗,表面粗糙有小结节,质地较韧,体积缩小。水飞蓟宾和芹菜素均可以缓解模型小鼠肝脏病变,芹菜素的药效具有量效关系且高剂量组效果好于水飞蓟宾组(Fig 2A)。统计各组小鼠的肝系数并根据对照组计算相对值,结果显示与对照组相比,模型组小鼠肝系数明显高于对照组,水飞蓟宾、芹菜素中剂量和高剂量组均可以明显降低肝纤维化小鼠的肝系数,且高剂量芹菜素的效果好于水飞蓟宾组(Fig 2B)。分别测定各组小鼠血清中肝功能相关指标ALT、AST、ALB及TP的含量,结果显示,与正常组相比,模型组小鼠血清中ALT、AST水平升高,ALB、TP水平降低,显示模型组建模成功;与模型组相比,芹菜素组和水飞蓟宾组小鼠血清中ALT、AST水平降低,ALB、TP水平升高(Fig 2C)。
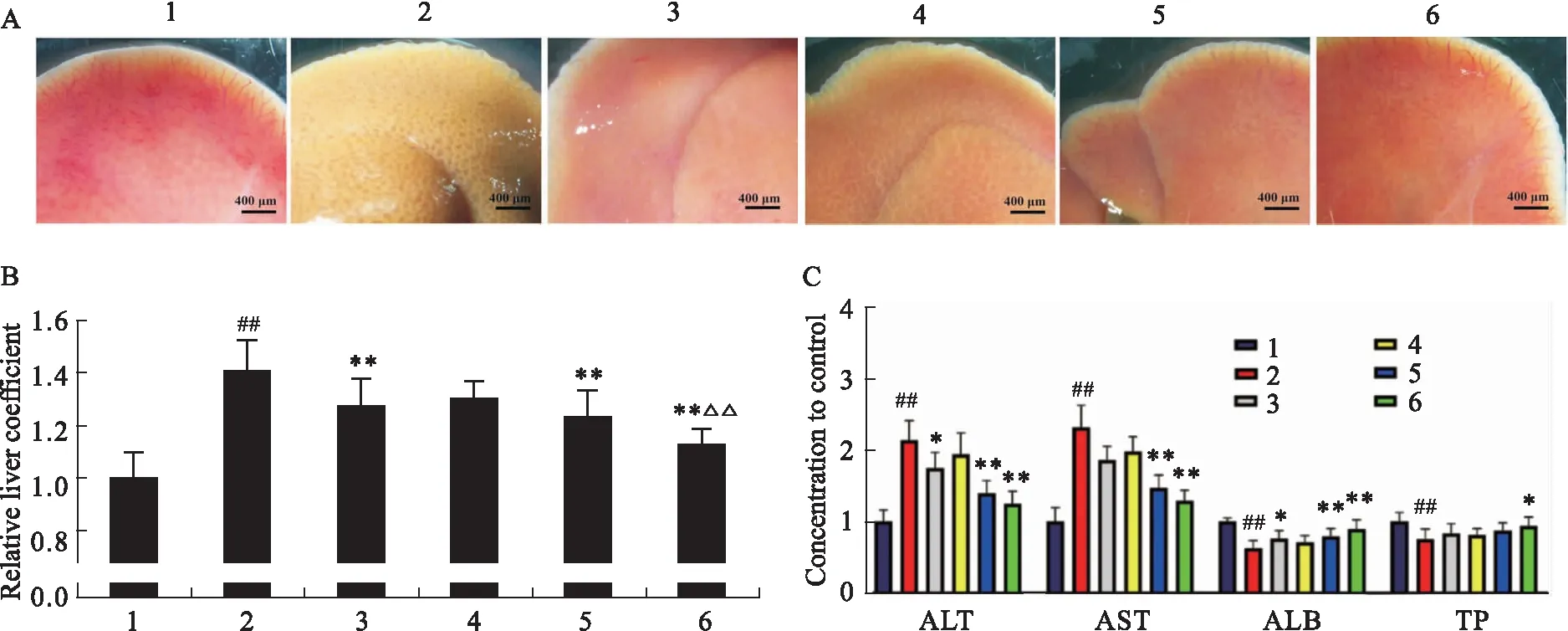
Fig 2 Morphology and liver coefficient levels of mouse liverA:Representative pictures of liver gross morphology in each group; B:Relative liver coefficient levels of mice in each 1:Control; 2:Model; 3:Silibinin; 4:Apigeniu-L; 5:Apigenin-M; 6:Apigenin-H. ##P<0.01 vs Control group;*P<0.05, **P<0.01 vs Model group;△△P<0.01 vs Silibinin group.
2.3 芹菜素降低CCl4诱导的肝纤维化小鼠肝脏组织病理损伤利用HE染色和Masson染色观察小鼠肝组织病理学改变。对照组小鼠肝细胞呈放射状排列,中央静脉清晰,无坏死、炎症及纤维化发生,病理学评分最低;模型组小鼠肝细胞小叶结构破坏,肝板排列紊乱,呈弥漫性改变。肝间质可见明显的脂肪变性、坏死,胶原沉积明显,炎细胞浸润。模型组肝纤维化程度明显高于其他各组,病理学评分最高;与模型组相比,4个给药组小鼠肝脏形态和结构病变均有明显改善,假小叶较少,胶原沉积和炎细胞浸润较少,病理学评分均低于模型组,且芹菜素给药组的病理学评分随剂量升高而降低,其中中剂量和高剂量芹菜素给药组病理学评分显著低于模型组(Fig 3A-D)。
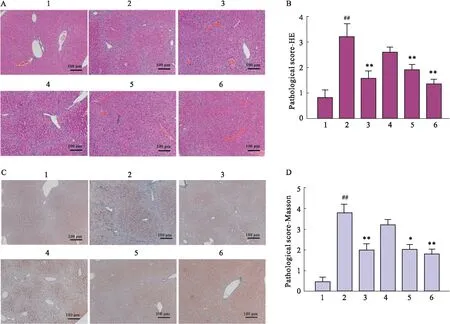
Fig 3 Pathological lesion staining of mouse A-B:Representative images of HE staining in liver tissue sections and statistics of pathological score; C-D:Representative images of Masson staining and pathological score statistics of liver tissue sections. 1:Control; 2:Model; 3:Silibinin; 4:Apigeniu-L; 5:Apigenin-M; 6:Apigenin-H. ##P<0.01 vs Control group;*P<0.05, **P<0.01 vs Model group.
2.4 芹菜素抑制肝细胞EMT前期研究显示,芹菜素可以抑制肝癌细胞EMT,从而发挥抗癌作用。本研究利用各组小鼠肝脏组织进行qRT-PCR,分别检测了EMT标志物E-cadherin和Vimentin蛋白的基因表达水平。结果显示,与对照组相比,模型组小鼠肝脏中上皮表型标志物E-cadherin基因CDH1表达水平明显降低、间充质表型标志物Vimentin基因Vim表达水平明显上高。芹菜素可以显著抑制模型鼠肝脏细胞EMT,提高E-cadherin表达水平、降低Vimentin表达水平,且中、高剂量具有量效关系,结果如Fig 4A和4B所示。利用Western blot对各组小鼠肝脏组织中E-cadherin和Vimentin蛋白进行检测,结果与qRT-PCR相似(Fig 4C)。

Fig 4 Effect of apigenin on EMT-related markers and signaling pathways in mouse A:Relative gene expression of E-cadherin; B:Relative gene expression of Vimentin; C:Expression levels of E-cadherin and Vimentin in liver tissues of mice in each group. 1:Control; 2:Model; 3:Silibinin; 4:Apigeniu-L; 5:Apigenin-M; 6:Apigenin-H. ##P<0.01 vs Control group; **P<0.01 vs Model group.
2.5 芹菜素抑制PDK1/AKT信号通路PDK1和AKT磷酸化在EMT过程中发挥了关键作用,也是引起肝纤维化的重要原因。本研究中,利用免疫组化评价了各组小鼠肝脏组织中磷酸化PDK(p-PDK S241)和磷酸化AKT(p-AKT S473)蛋白的表达水平。结果显示,与正常小鼠相比,肝纤维化小鼠肝脏组织中p-PDK和p-AKT表达水平明显升高,芹菜素可以显著抑制肝纤维化小鼠p-PDK和p-AKT表达,且中、高剂量具有量效关系(Fig 5A-D)。利用Western blot对各组小鼠肝脏组织中p-PDK S241和p-AKT S473蛋白进行检测,结果与免疫组化相似(Fig 5E)。

Fig 5 Effect of apigenin on PDK1/AKT signaling pathway in mouse liver A-B:p-PDK1 S241 immunohistochemical representative images and pathological score statistics; C-D:p-Akt S473 immunohistochemical representative image and pathological scores statistics; E:Protein expression levels of p-PDK1 S241 and p-Akt S473 in liver tissues of mice in each group. 1:Control; 2:Model; 3:Silibinin; 4:Apigeniu-L; 5:Apigenin-M; 6:Apigenin-H. ##P<0.01 vs Control group; **P<0.01 vs Model group
3 讨论
肝纤维化是指肝脏在各种致病因素作用之下,产生有活性的成纤维细胞,最终引起肝细胞外基质弥漫性过度沉积的病理过程[13]。近年来,国内外研究发现,天然小分子在抑制、逆转肝纤维化方面具有独特优势,其中黄酮类小分子的药效尤为显著[14]。芹菜素是一种典型的黄酮类分子,本研究利用CCl4建立了小鼠肝纤维化模型,并评价了芹菜素对模型鼠的治疗作用及药理机制。
CCl4是一种具有肝脏毒性的有机溶剂,能够引起肝细胞损伤、激活肝星状细胞并增加细胞外基质,从而引起肝纤维化。CCl4诱导的肝纤维化病程稳定,在病理学上与人肝纤维化具有很强的相似性[15]。本研究结果显示,芹菜素对CCl4诱导的小鼠肝纤维化具有显著的治疗效果,能够改善肝纤维化小鼠生活状态、降低肝组织的病理损伤。
进一步的机制研究显示,芹菜素通过PDK1/AKT信号通路抑制肝细胞EMT进而发挥药效。间充质细胞在肝纤维化形成中发挥了关键作用,EMT过程使得具有上皮表型的细胞转化为间充质表型。EMT过程在肝纤维化进程中发挥了关键作用,因此,抑制EMT对治疗肝纤维化具有重要作用,也是目前肝纤维化治疗领域研究的热点问题。芹菜素具有抗炎、抗癌的作用,能够通过抑制肝癌细胞EMT发挥抗肿瘤转移、增殖的作用[16]。本研究结果显示,芹菜素抑制了肝纤维化模型小鼠肝脏细胞Vimentin表达水平,同时提高了E-cadherin表达水平,Vimentin和E-cadherin蛋白分别为间充质表型细胞标志物和上皮表型细胞标志物,该结果表明芹菜素在发生肝纤维化的肝脏细胞中抑制了EMT过程。PDK1/AKT信号通路与多个EMT相关蛋白关系密切,在发生EMT的细胞中,PDK1和AKT往往以磷酸化激活状态存在[17]。本研究结果显示,芹菜素可以显著抑制PDK1磷酸化水平和AKT磷酸化水平,通过抑制PDK1/AKT通路发挥抗纤维化的作用。
黄酮类分子富含于日常水果、蔬菜和多种野生植物之中,具有广泛的药理作用。在本研究中,将水飞蓟宾作为阳性药进行对比研究,该分子亦为黄酮分子。水飞蓟宾能够起到稳定肝细胞膜、维持肝细胞完整的作用,在临床上作为保肝、护肝,预防、治疗肝纤维化的药物使用。本研究结果显示,芹菜素和水飞蓟宾对CCl4诱导的肝纤维化均有治疗作用,在相同摩尔浓度下,二者药效相当,进一步提高芹菜素的用药剂量,药效进一步提高且未发现明显毒副作用。本研究初步阐释了芹菜素的药理机制,也进一步丰富了黄酮类分子的药理作用,为研究黄酮类分子的共性药理特征提供了信息。
肝纤维化导致肝脏结构受到损伤,会导致肝硬化进而导致肝癌发生[18]。目前,肝硬化和肝癌暂时没有有效的且能够普及的治疗方案,但是肝纤维化具有可逆性,治疗肝纤维化为治疗慢性肝病提供了有效的早期窗口,具有重要意义。尽管针对肝纤维化治疗的药物研究众多,且取得较快发展,迄今为止,还没FDA批准的专门治疗纤维化的药物上市。针对病毒性肝炎,临床上常使用干扰素和核苷酸类药物阻止、延缓肝纤维化的进展,甚至可以达到逆转肝纤维化的效果。但其他病因的肝纤维化暂时缺乏有效的手段。
芹菜素来源于食物,安全性良好,具有潜在的应用价值,拥有进一步开发为保肝、护肝,治疗肝纤维化药物的潜力。同时芹菜素在日常的水果、蔬菜中含量丰富,芹菜素新的药效和药理机制的发现,有助于指导人们通过日常饮食调节,达到预防肝病的保健作用。
本研究存在一定的不足,尚缺少在细胞水平、动物水平的深入机制研究,缺少对芹菜素毒副作用、药物代谢动力学方面的系统研究。在未来的研究中,需对以上内容进行补充研究。此外,还可针对芹菜素预防肝纤维化的效果开展研究。在药物化学方面,可通过对芹菜素有针对性的改构进一步增强其药理活性。
综上所述,芹菜素可以通过抑制PDK1/AKT信号通路来抑制肝细胞EMT,发挥抗肝纤维化的作用。芹菜素具有进一步研发为保肝、护肝,治疗肝纤维化的药物的潜力。

