肿瘤相关巨噬细胞中程序性死亡受体配体1的表达及其与乳腺癌不良预后的关系
杨 菊, 李小静, 刘秀萍, 2, 杨 珂, 曹 丽, 舒维清
(1. 复旦大学附属上海市第五人民医院 病理科, 上海, 200240;2. 复旦大学基础医学院 病理学系, 上海, 200032)
乳腺癌是女性最常见的恶性肿瘤,是女性癌症的第二大死亡原因[1]。肿瘤微环境(TME)是肿瘤研究的热点,其主要由癌细胞及大量浸润性巨噬细胞、淋巴细胞等免疫细胞组成[2]。乳腺癌细胞可招募肿瘤相关巨噬细胞(TAMs), 肿瘤组织中高密度的TAMs浸润与乳腺癌患者的不良预后相关[3]。程序性死亡受体配体1(PD-L1)在乳腺癌中表达的研究较多,但其预后意义尚未完全清楚。原发性乳腺癌中癌细胞PD-L1的表达与高危临床病理参数和不良预后相关[4]。癌细胞上高表达PD-L1的患者在进行新辅助化疗后获得病理完全缓解的可能性增加,而癌细胞低表达PD-L1的患者具有更好的总体生存率(OS)[5]。乳腺癌中关于PD-L1的研究主要集中于癌细胞或肿瘤浸润淋巴细胞(TIL)中PD-L1的表达[6]。TAMs是TME中PD-L1表达的主要来源,且TAMs上PD-L1的表达比癌细胞上的更稳定[7]。目前,有关巨噬细胞中PD-L1表达的研究较少。本研究检测PD-L1在TAMs中的表达及其与临床病理的相关性,探讨其可能的机制,为乳腺癌的治疗提供新的理论依据。
1 材料与方法
1.1 生物信息学分析
使用肿瘤微环境单细胞转录组学数据库(TISCH)获取乳腺癌肿瘤组织单细胞水平转录组学信息。79个数据集中的4个数据集预测了TAMs中编码PD-L1的RNA(命名为CD274)的表达(http://tisch.comp-genomics.org/search-gene/)。 所有参数均设置为默认值。
1.2 患者队列
本研究由医院研究伦理委员会批准,并根据方案2019MHZ032进行。收集2014年1月—2019年12月复旦大学附属上海市第五人民医院病理科165例浸润性乳腺癌患者组织及相关临床病理资料。165例患者中,82例有淋巴结转移, 83例无淋巴结转移; 年龄29~88岁,中位年龄59岁。福尔马林固定的石蜡包埋组织切成4 μm的切片。根据世界卫生组织肿瘤分类标准,由病理医生进行诊断。
1.3 多色免疫荧光组织染色及抗体
所有组织均用福尔马林固定,常规技术包埋于石蜡中。组织切片(4 μm)经脱蜡、返水,并在0.1 mol/L柠檬酸钠(pH 6.0)中进行微波抗原修复,染色前用5%的羊血清封闭20 min。将载玻片上滴加2种抗体[CD68(KP1, ab955, Abcam, 1∶25)]和PD-L1(SP142, CST, 1∶250)的混合物(2种抗体来自不同的种属),在4 ℃冰箱中孵育过夜;然后在磷酸盐缓冲液(PBS)中洗涤载玻片,于暗室中与2种二抗的混合物[异硫氰酸荧光素(FITC)或Tesas红结合]37 ℃温箱中孵育1 h; 然后将载玻片在PBS中洗涤,并用Hoechst(ab228551, Abcam, 1∶1 000)孵育30 s进行复染,使细胞核着色;然后在自来水中短暂冲洗载玻片,封片。立即使用荧光显微镜(蔡司)观察并拍照。
1.4 免疫荧光染色的评估
荧光显微镜低倍镜下观察切片中CD68+PD-L1+细胞密集区域,从每个切片中选择5个高倍视野(放大400倍)计数,取平均值即为该组织切片中PD-L1+TAMs浸润数量。取PD-L1+TAMs计数的中位数,平均值大于中位数即为PD-L1高表达,否则为低表达。
1.5 患者的生存预后
通过门诊或电话定期回访患者。总生存期定义为患者确诊至任何原因导致死亡的时间。随访时间截至2021年12月或死亡。OS测量了所有病例的死亡率,用于预后分析。
1.6 细胞培养和试剂
THP-1单核细胞在添加10% 胎牛血清(FBS)(Gibco)和0.05 mmol/L β-聚体(Invitrogen)的RPMI 1640(Invitrogen)中培养。MCF-7和MDA-MB-231细胞在完全RPMI 1640培养基中培养。所有细胞系每2周检查1次支原体,使用前均为阴性。
佛波酯(PMA)购自Sigma Aldrich。白细胞介素(IL)-4和IL-13购自PeproTech。THP-1单核细胞经100 nmol/L PMA孵育72 h后,在RPMI培养基中孵育24 h分化为巨噬细胞。添加20 ng/mL IL-4和20 ng/mL IL-13孵育获得M2型巨噬细胞。在共培养实验中, THP-1单核细胞以100 000个细胞/孔的密度接种在24个Transwell板(康宁)中。巨噬细胞与MCF-7/MDA-MB-231细胞共培养24 h。
1.7 蛋白质印迹(Western blot)
使用Bio-Rad的标准Western blot方案。收集M2型巨噬细胞,提取蛋白,用二喹啉甲酸(BCA)法进行蛋白定量。取30 mg总蛋白/泳道装入凝胶中。使用抗PD-L1和vinculin(Sigma)的抗体来检测蛋白质,并用过氧化物酶结合的山羊抗兔二抗(Abcam)孵育。使用ImageJ软件进行密度分析以量化条带面积。
1.8 逆转录聚合酶链式反应(RT-PCR)
RNA提取和实时定量PCR, 使用Trizol试剂提取总RNA,使用SuperScriptTMⅢ First-Strand Synthesis for RT-PCR (Invitrogen, 18080-051)试剂盒合成cDNA,按照说明书使用PerfectStartTMGreen qPCR SuperMix (Tran,AQ601)试剂盒进行RT-PCR。热循环条件如下: 95 ℃初始激活30 s, 95℃进行40次循环10 s, 60 ℃ 20 s, 72 ℃ 30 s。实验分复孔进行。以β-actin为参照,使用2-△△Ct方法计算PD-L1基因组转录本的相对表达水平,正向和反向引物见表1。

表1 引物序列
1.9 统计学分析
所有分析均使用SPSS 18.0进行。PD-L1表达与患者临床病理特征之间的相关性采用χ2检验或Fisher′s精确检验进行评估。Kaplan-Meier方法用于估计OS, 对数秩检验用于比较亚组。P<0.05为差异具有统计学意义。
2 结 果
2.1 原发性乳腺癌组织和转移癌中PD-L1的表达
通过TISCH进行scRNA-seq分析,结果表明,转移性乳腺癌组织中巨噬细胞PD-L1的表达高于原发性乳腺癌组织,差异有统计学意义(P<0.05), 见图1。

A、B: 原发性乳腺癌; C、D: 转移性乳腺癌; E: 原发性乳腺癌(BRCA_GSE114727、BRCA_GSE138536)、转移性乳腺癌(BRCA_GSE110686、BRCA_GSE143423)图1 原发性乳腺癌组织和转移瘤中巨噬细胞PD-L1的表达
2.2 乳腺癌TAMs中PD-L1的表达
在乳腺癌组织样本的间质和癌细胞中均可观察到PD-L1和CD68的表达,其表达主要定位于细胞质中,呈颗粒状(图2)。为了检测乳腺癌TAMs(CD68阳性细胞)中PD-L1的表达,从每个切片选取5个高密度区域计算PD-L1+CD68+(图1中黄色部分所示)细胞的数量, 165例乳腺癌患者的中位数为(19.24±10.01)/高倍视野。为了研究TAM中PD-L1表达与临床病理特征之间的关系,根据PD-L1+CD68+细胞的中位数将乳腺癌患者分为PD-L1高表达组和PD-L1低表达组(图2)。
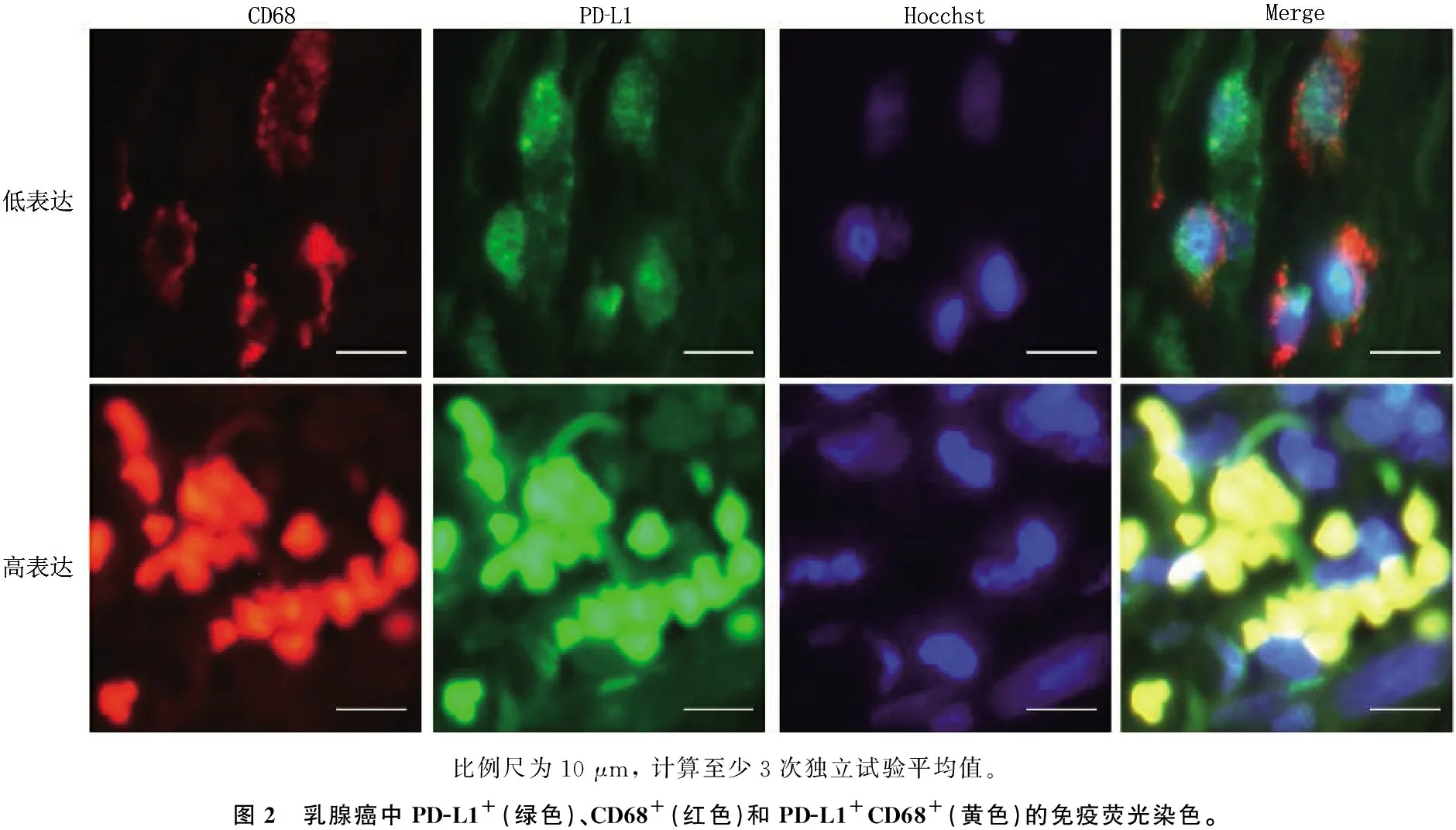
比例尺为10 μm, 计算至少3次独立试验平均值。图2 乳腺癌中PD-L1+(绿色)、CD68+(红色)和PD-L1+CD68+(黄色)的免疫荧光染色。
2.3 患者的临床病理特征及其与TAMs中PD-L1表达的相关性
165例乳腺癌患者均为女性, 122例患者年龄≥50岁, 43例年龄<50岁; 72例患者肿瘤≤2 cm, 78例患者肿瘤>2 ~5 cm, 15例患者肿瘤>5 cm。其中83例患者无淋巴结转移, 43例患者1~3个淋巴结转移阳性, 20例患者4~9个淋巴结转移阳性, 19例有≥10个淋巴结转移阳性。诊断时,6例患者处于Ⅰ期, 62例患者处于Ⅱ期, 97例患者处于Ⅲ期或Ⅳ期。PD-L1+TAMs浸润密度与组织学分级相关(P<0.05), PD-L1+TAMs浸润与年龄、肿瘤直径、淋巴结转移、分子亚型和远处转移无相关性(P>0.05)。见表2。

表2 患者临床病理特征及其与TAMs中PD-L1表达的关系
2.4 乳腺癌患者PD-L1+TAMs浸润密度与生存时间呈负相关
随访期间12例患者死于乳腺癌,最短生存时间为1个月。采用Kaplan-Meier生存分析, PD-L1+TAMs高表达和低表达患者的平均生存时间分别为88.70和78.58个月。PD-L1+TAMs高表达和低表达患者的生存曲线不同。PD-L1+TAMs的高表达与较差的OS相关(P=0.014)。见图3。

图3 TAMs 中PD-L1的表达对乳腺癌预后的影响
2.5 巨噬细胞中PD-L1的表达
通过与PMA、IL-4和IL-13孵育将THP-1单核细胞诱导为M2型巨噬细胞,并检测其中PD-L1的表达。Western blot结果显示与MCF-7或MDA-MB-231细胞共培养24 h后, M2型巨噬细胞中PD-L1蛋白表达水平增加(P<0.05或P<0.001)。见图4。在与MCF-7或MDA-MB-231细胞共同培养的M2型巨噬细胞中,PD-L1mRNA丰度更高(P<0.05或P<0.001), 见图5。

A: M2型巨噬细胞与MCF-7细胞系共培养24 h; B: M2型巨噬细胞与MDA-MB-231细胞系共培养24 h。与M2型巨噬细胞中PD-L1表达比较, *P<0.05, ***P<0.001。图4 M2型巨噬细胞中PD-L1的表达。

A: M2型巨噬细胞与MCF-7细胞系共培养24 h; B: M2型巨噬细胞与MDA-MB-231细胞系共培养24 h。与M2型巨噬细胞中PD-L1 mRNA表达比较, *P<0.05, ***P<0.001。图5 M2型巨噬细胞PD-L1 mRNA表达水平。
3 讨 论
乳腺癌是一种严重影响女性身心健康的恶性肿瘤,目前主要治疗方法为手术切除、局部放疗和化疗[1]。M2型TAMs与多种癌症的生长、迁移和侵袭有关。同时, M2型TAMs也可能通过表达免疫检查点蛋白PD-L1/程序性死亡受体配体2(PD-L2)和CD80/CD86促进免疫监视肿瘤逃逸,使TAMs成为免疫检查点抑制剂程序性死亡受体-1(PD-1)的直接靶点[8-9]。抑制M2型TAM中IL-10/STAT3/NF-κB信号通路,可阻断免疫抑制性TME的发展[8]。目前,多种针对肿瘤相关巨噬细胞的治疗策略已经被开发[9-13]。
本研究结果显示,原发性乳腺癌TAMs中PD-L1的表达与组织学分级显著正相关; 原发性乳腺癌中PD-L1+TAMs的浸润密度与患者的生存时间呈负相关; 与肿瘤组织TAMs中PD-L1低表达患者相比, PD-L1高表达患者总体生存率更差。TME在肿瘤侵袭和转移中的作用受到广泛关注[14]。目前, TME被认为是诊断治疗的靶点或预后的生物标志物。在免疫系统中, TAMs是癌症免疫抑制的主要驱动因素[15]。研究[4]表明,在乳腺癌患者中, TAMs浸润率高的患者OS较差。
乳腺癌中PD-L1的表达与高TIL水平和存在不良预后因素呈正相关[16]。肿瘤浸润性免疫细胞中PD-L1阳性表达与较差的OS显著相关。本研究中, PD-L1+TAMs浸润数量越多, OS越差。TISCH的scRNA-seq数据显示,与原发性乳腺癌相比,转移时巨噬细胞中PD-L1的表达显著上调。乳腺肿瘤组织PD-L1+TAMs浸润密度与患者生存时间呈负相关,高密度组的总体生存率显著降低。提示PD-L1+TAMs的高度浸润性是乳腺癌免疫逃逸的一个重要因素,这与单细胞分析[17]的结果一致。 巨噬细胞具有显著可塑性,使其能够有效地适应环境变化,并改变表型和生理学特性[15]。巨噬细胞的异质性最初被描述为2大类: M1(经典激活)和M2(交替激活),大多数TAMs更倾向于M2型巨噬细胞[18-19]。本研究发现,极化后M2型巨噬细胞中PD-L1的表达显著高于THP-1单核细胞。本研究将M2型巨噬细胞与乳腺癌细胞系MCF-7或MDA-MB-231共培养24 h, TAMs中PD-L1mRNA及PD-L1蛋白表达水平增高。相关研究[20-21]显示, 4T1细胞共培养后,巨噬细胞PD-L1水平增加; 口腔鳞状细胞癌患者的原代肿瘤细胞可通过IL-10刺激单核细胞上的PD-L1表达,与本研究结果一致。既往研究[6]表明, PD-L1表达主要通过I型和II型干扰素信号途径调节。一项研究[22]表明,TNF-α是一种细胞因子,可导致单核细胞PD-L1表达上调。TAMs中PD-L1表达的调节方式可能与肿瘤细胞自身不同。故PD-L1的表达是TAMs的一个重要特征,其调控理论有待进一步探讨。
综上所述,乳腺癌组织TAMs中PD-L1的表达是相关不良临床结果的独立预后因素。TAMs中PD-L1阳性表达与组织学分级和不良预后显著正相关,可能在肿瘤进展中起重要作用。靶向TAMs中的PD-L1可能为乳腺癌治疗提供一种新的治疗方法。但本研究存在一定局限性,本研究未明确调节TAMs中PD-L1表达的潜在信号通路,其次仅探讨了M2型TAMs中PD-L1的表达,以及未证实TAMs中PD-L1的表达在抗PD1/PD-L1治疗中的预测价值,仍需进一步研究阐明。

