甲状腺癌细胞中分化相关蛋白的筛选分析
荊晓萌,颜娇,李会敏,迟鑫明
(大连医科大学辽宁省蛋白质组学重点实验室,大连116041)
甲状腺癌是头颈部最常见的恶性肿瘤和最常见的内分泌恶性肿瘤,也是30年来全球范围内发病增长率最高的肿瘤[1]。根据肿瘤起源及分化差异,甲状腺癌又可分为:甲状腺乳头状癌 (papillary thyroid carcinoma, PTC)、甲状腺滤泡癌(follicular thyroid carcinoma, FTC)、甲状腺髓样癌(medullary thyroid carcinoma,MTC)以及甲状腺未分化癌(anaplastic thyroid Cancer, ATC)[2]。分化型甲状腺癌(differentiated thyroid carcinoma, DTCs)包括PTC和FTC,约占甲状腺恶性肿瘤的90%。分化型甲状腺癌的特点是与无害的临床过程相关,但少数病例可能表现出惊人的侵袭行为[3]。低分化甲状腺癌(poorly differentiated thyroid cancer, PDTC)和ATC较罕见(分别为5%和1%),其侵袭行为和中位生存时间(分别为5年和6个月)较短。MTC占甲状腺癌的5%,起源于滤泡旁C细胞[4]。
中国甲状腺癌的发病率显著上升[5],且所有阶段的甲状腺癌数量都在增加[6]。其中发病率的上升几乎完全是由于DTCs,特别是PTC诊断的增加。FTC、ATC和MTC的发病率在过去30年中保持相对稳定[7]。
目前国内外甲状腺癌指南均建议,可利用分子标志物检测提高诊断准确性[8]。因此我们希望找到甲状腺癌分化相关的蛋白质,作为临床甲状腺癌精准分类的生物标志物。
本研究利用蛋白质组学分析方法,对细胞全蛋白质组分进行蛋白质组分析,从整体的角度分析细胞动态变化的蛋白质组成成份、表达水平,揭示蛋白质功能与细胞生命活动规律,以期更全面、高效的找到甲状腺癌分化相关的生物标志物[9]。
材料与方法
1 材料
细胞系THJ-16T、FTC133、Nthy-ori 3-1,购买于美国模式培养物集存库(American Type Culture Collection, ATCC)。培养条件:美国Gibco公司产RPMI Medium 1640basic (IX)培 养 基,SAGECREATION公司产10%进口胎牛血清,5% CO2、37 ℃培养箱中培养。I型胶原α1(collagen type I α1,COL1A)、硫氧化还原蛋白(thioredoxin, TRX)、β-肌动蛋白(β-actin)、Rho关联含卷曲螺旋结合蛋白激酶1(Rho-associated protein kinase 1, Rock-1)、辣根过氧化物酶标记的山羊抗兔/鼠IgG均购于武汉三鹰(Proteintech)公司;角蛋白7(cytokeratin-7, KRT7)、角蛋白8(cytokeratin-8, KRT8)、I型胶原α2(collagen type I α2, COL1A2)、内凹陷蛋白(caveolin-1, Cav-1)、纤维束蛋白同源物1(fascin 1, FSCN1)、高迁移率族蛋白A1(high mobility group protein A1, HMGA1)、超氧化物歧化酶(superoxide dismutase, SOD2)均购于BIOWORLD公司。牛胰蛋白酶、尿素、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、甲醛(37%水溶液)、氘代甲醛(20%水溶液)、硼氢化钠(NaBH3CN)、氘代硼氢化钠(NaBH3CN)、甲酸(FA)购自Sigma Aldrich 公司;乙腈(色谱纯)购自Merck公司;其余试剂均为分析纯。实验用水经Milli-Q 超纯水处理系统(Millipore, Milford, MA)纯化。
2 细胞培养
含10%进口胎牛血清的RPMI1640培养基分别培养THJ-16T、FTC133和Nthy-ori3-1细胞,放置于5% CO2、37 ℃培养箱中培养,待细胞进入对数生长期,细胞覆盖培养皿的80%~90%,PBS冲洗,胰酶消化,离心后收取细胞,备用。
3 样品处理、酶解和标记
蛋白质样品的制备:将正常甲状腺细胞系和甲状腺癌细胞系分别用PBS清洗3遍,加入含有以下成分的细胞裂解液:8 mol/L尿素、50 mmol/L磷酸盐 缓冲液(pH 8.0)、1 mmol/L EDTA、5 mmol/L DTT、0.2 mmol/L Na2VO4、1 mmol/L NaF和1%蛋白质酶抑制剂。将此悬浊液在冰上超声100 s,然后25000 g离心30 min,以除去细胞核等不溶杂质,收集上清液,Bradford试剂盒测定蛋白质浓度。将蛋白质溶于含8 mol/L尿素的50 mmol/L磷酸盐缓冲液中,56 ℃变性10 min,再加入100 mmol/L DTT,于56 ℃反应1 h。冷却至室温后,加入20 μL 200 mmol/L IAA,在暗处反应30 min。用50 mmol/L 磷酸盐缓冲液稀释后,按照蛋白质:酶为25:1的质量比加入胰蛋白酶,于37 ℃酶解24 h后,-80 ℃保存待用。
取THJ-16T、FTC133、Nthy-ori 3-1细胞的酶解产物各1 mg,分别加入1 mL以下同位素标记溶液:2% CH2O - 0.3 mol/L NaBH3CN、2% CD2- 0.3 mol/L NaBH3CN2% CD2O - 0.3 mol/L NaDH3CN,室温下反应1 h。分别加入25%氨水20 μL反应10 min,加入4% FA 50 μL调溶液至酸性。将标记后的酶解产物等质量混合后,用C18捕集柱脱盐并冷冻干燥,-80 ℃保存待用。
4 纳升级RPLC-ESI-MS/MS分析及数据处理
HPLC系统包括四元梯度泵(Thermo Fisher Scientific Inc., San Jose, CA, USA)、实验室自填装的C18毛细管分离柱(75 μm i.d.×17 cm)以及反相捕集柱(150 μm i.d.×2 cm);填料均为XBP-C18 硅球(5 μm, 120Å,天津博纳-艾杰尔科技有限公司);流动相分别为A(2% ACN/ 0.1% FA)和B(98% ACN/ 0.1%)。梯度设置如下:0% B(0 min)→0% B(20 min)→10% B(25 min)→40% B(175 min)→80% B(180 min)→80% B(190 min);流量为200 nL/min。
LTQ-Orbitrap质谱(Thermo Fisher Scientific Inc., San Jose, CA, USA)采用数据依赖模式,在正离子模式下进行扫描,分辨率为60000;喷雾电压为2.1 kV;离子传输毛细管温度为250 ℃;质谱扫描条件设定为质荷比为300—1800的全扫描,并对其中的前15个最高峰进行MS/MS扫描,二级质谱碰撞能量设定为35%,采用多重激发;中性丢失设置如下:为+1、+2、+3离子分别对应于98.00、49.00、32.67Da。其中动态排除设定为:重复次数为1,重复容忍时间为30 s,动态排除时间为60 s。每个样品平行测试5次。
将所得质谱数据用MASCOT (版本2.3.02)及Mascot Distiller针对IPI Mouse正反合库数据库(V. 201110)进行搜索。肽段以胰酶完全酶解条件搜库(最多容许两个漏切位点)。允许的母离子质量偏差为10 ppm,碎片离子质量偏差为0.5 Da。搜库时半胱氨酸残基加烷基化固定修饰;可变修饰分别为:蛋氨酸残基加氧化修饰,丝氨酸、苏氨酸和酪氨酸残基上加磷酸化修饰。在要求蛋白鉴定P<0.05且至少含有一个鉴定到的可信肽段(bold red peptide)的前提下,将Ion score大于20的肽段用于定量,控制FDR<1%。
5 Western blot检测
常规方法进行Western blot,5%浓缩胶和10%分离胶进行分离,电泳仪电压分别为80 V和120 V,三明治法350 mA恒流条件下转模90 min,丽春红染色。随后将膜置于兔抗人COL1A1多克隆抗体(1:1000)、兔抗人COL1A2多克隆抗体(1:1000)、鼠抗人Cav-1单克隆抗体(1:1000)、兔抗人FSCN1多克隆抗体(1:1000)、兔抗人TRX多克隆抗体(1:1000)、兔抗人HMGA1多克隆抗体(1:1000)、兔抗人SOD2多克隆抗体(1:1000)、兔抗人Rock-1多克隆抗体(1:1000)、兔抗人KRT7单克隆抗体(1:1000)、兔抗人KRT8单克隆抗体(1:1000)、鼠抗人β-actin多克隆抗体(1:1000)孵育条件为4 ℃过夜,PBST洗膜5 min×3次后,置于辣根过氧化物酶标记的羊抗兔/鼠IgG(1:2000)中室温孵育90 min,PBST洗膜5 min×3次后,ECL孵育,凝胶成像仪(BIO-RAD, Universal Hood Ⅱ, USA)成像,应用Image Lab软件对蛋白质条带进行分析处理。
6 免疫细胞化学检测
使用北京中山金桥公司通用二步法试剂盒(小鼠/兔增强聚合物法检测系统)进行免疫组织化学检测。细胞爬片至70%密度时,4%多聚甲醛室温固定20 min;1% Tween 20室温通透1 h,山羊血清37 ℃封闭30 min,PBS洗3遍;使用内源性过氧化物酶阻断剂室温孵育10 min。鼠抗人COL1A单克隆抗体(1:500)、兔抗人TRX多克隆抗体(1:500)、兔抗人Rock-1多克隆抗体(1:500)4 ℃孵育过夜,反应增强液室温孵育20 min,辣根过氧化物酶(HRP)标记的羊抗鼠/兔lgG聚合物室温孵育20 min;1×DAB显色剂(DAB底物液:浓缩DAB溶液=20:1)显色7 min,苏木素复染1 min,盐酸乙醇、氨水冲洗返蓝,脱水透明后封片,显微镜观察、拍照。应用Image J软件进行显微图像分析,以阳性免疫反应产物平均积分光密度(average integrated optic density, Average IntDen)代表免疫反应性强度。
7 数据统计分析
统计学处理所有除免疫细胞化学以外实验数据,使用SPSS16软件进行方差分析,免疫细胞化学染色定量分析使用Graphpad Prism 7.0软件完成,采用t检验。数据使用平均值±标准差表示,P<0.05被认为差异有统计学意义。
结果
1 正常甲状腺细胞系与中低分化甲状腺癌细胞系差异表达蛋白质
通过Fold change和P-Value两个指标筛选蛋白质后,取t检验具有显著性差异(P<0.05)、且蛋白表达量变化1.5倍及以上的蛋白作为差异蛋白,分别筛选出甲状腺癌低分化细胞系与正常甲状腺细胞系差异表达蛋白101个;中分化甲状腺癌细胞系与正常甲状腺细胞系差异表达蛋白103个;低分化与中分化甲状腺癌细胞系间有显著差异表达的蛋白106个(图1)。
2 正常甲状腺细胞系与中、低分化甲状腺癌细胞系差异表达蛋白质关系
对正常甲状腺细胞系与中、低分化甲状腺癌细胞系间差异表达蛋白分析表明:低分化甲状腺癌细胞系与正常甲状腺细胞系差异表达的蛋白质中有38个蛋白质与中分化甲状腺癌细胞系与正常甲状腺细胞系间差异表达蛋白质相重叠,有63个蛋白质与低分化与中分化甲状腺癌细胞系间有差异表达的蛋白质相重叠;中分化甲状腺癌细胞系与正常甲状腺细胞系间差异表达蛋白质有53个与低分化与中分化甲状腺癌细胞系间有差异表达的蛋白质相重叠(图2)。部分差异表达蛋白具体名称见表1。
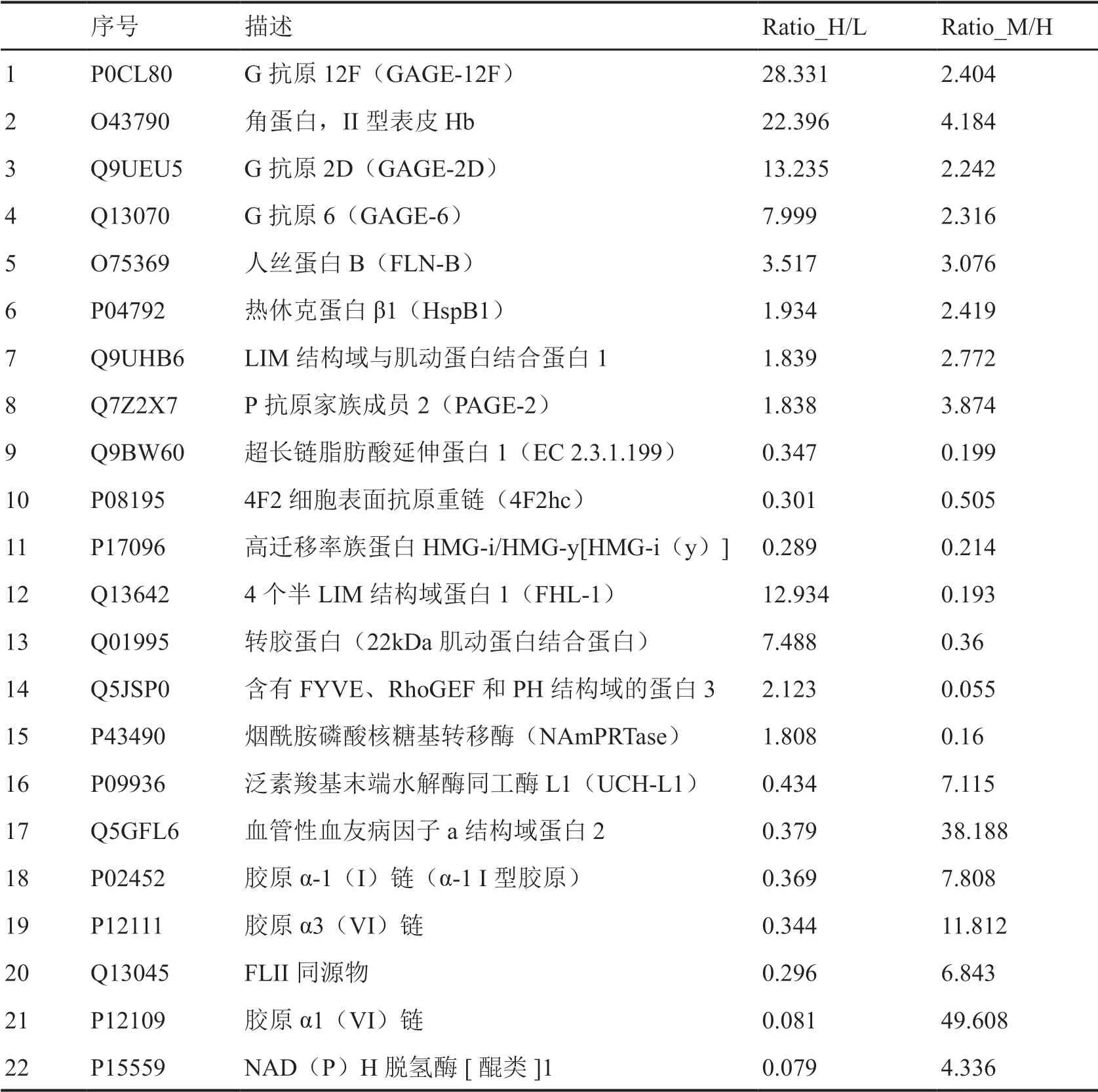
表1 部分差异表达蛋白质信息Tab. 1 Partial information of differentially expressed proteins
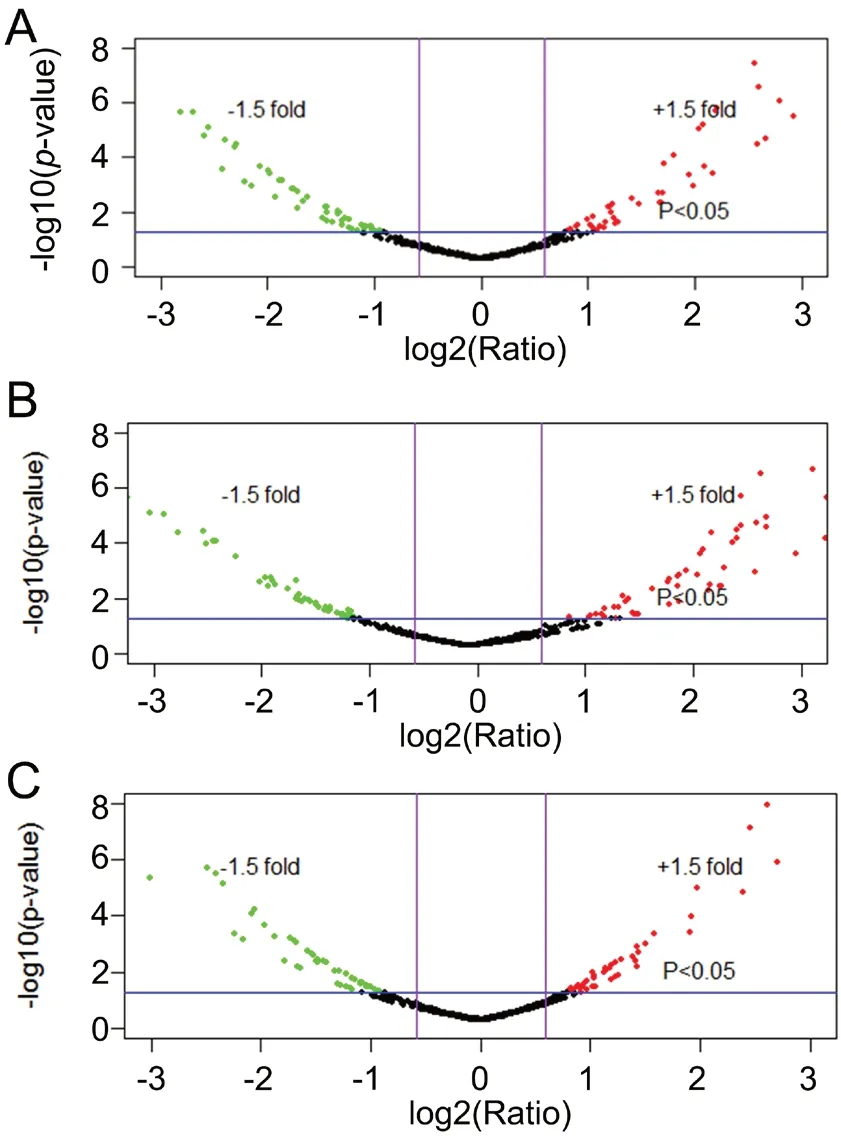
图l 正常甲状腺细胞系与中、低分化甲状腺癌细胞系差异表达蛋白质火山图法分析。A,低分化甲状腺癌细胞系与正常甲状腺细胞系;B,中分化甲状腺癌细胞系与正常甲状腺细胞系;C,低分化甲状腺癌细胞系与中分化甲状腺癌细胞系。Fig. 1 Analysis of differentially expressed proteins between normal and moderately and/or poorly differentiated thyroid cancer cell lines by volcanic map. A, poorly differentiated thyroid cancer cell lines and normal thyroid cell lines; B, moderately differentiated thyroid cancer cell lines and normal thyroid cell lines; C, poorly and moderately differentiated thyroid cell lines.
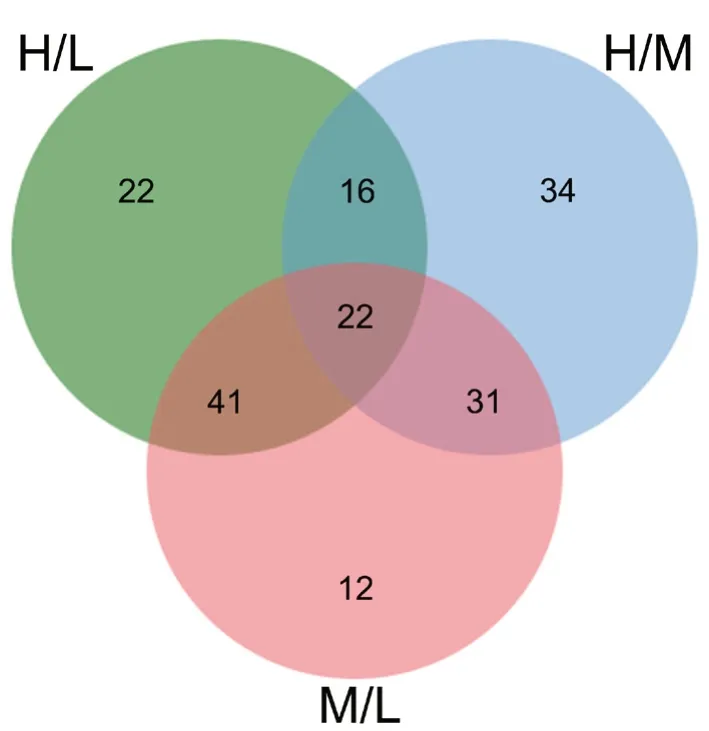
图2 人甲状腺高(H)、中(M)和低(L)分化细胞系差异表达蛋白质的关系Fig. 2 Relationship between differentially expressed proteins in well (H)-, moderately (M)- and poorly (L)-differentiated human thyroid cell lines
3 不同分化程度甲状腺细胞间差异蛋白的主要信息通路
使用 Ingenuity Pathway Analysis (IPA)软件对差异表达蛋白的通路信息分析显示,正常甲状腺细胞系与低分化甲状腺癌细胞系间差异蛋白质主要参与空泡介导的内吞信号(caveolar-mediated endocytosis signaling)、病毒的内吞途径(virus entry via endocytic pathways)、细胞毒性T淋巴细胞介导的靶细胞凋亡(cytotoxic T lymphocyte-mediated apoptosis of target cells)、维生素 C 运输(vitamin C transport)、TR/RXR 激活(TR/RXR activation)、颗粒酶 B 信号(granzyme B signaling)、树突细胞成熟(dendritic cell maturation)、蛋白质泛素化通路(protein ubiquitination pathway)等(图3A)。低分化甲状腺癌细胞系与中分化甲状腺癌细胞系间差异蛋白质主要参与RAN 信号 (RAN signaling)、超氧化物自由基降解(superoxide radicals degradation)、NRF2 介导的氧化应激反应(NRF2-mediated oxidative stress response)、EIF2 信号通路(EIF2 signaling)、肝纤维化/肝星状细胞活化(hepatic fibrosis / hepatic stellate cell activation)、芳香烃受体信号(aryl hydrocarbon receptor signaling)、上皮细胞醛固酮信号(aldosterone signaling in epithelial cells)、TR/RXR 激活(TR/RXR activation)等(图3B)。
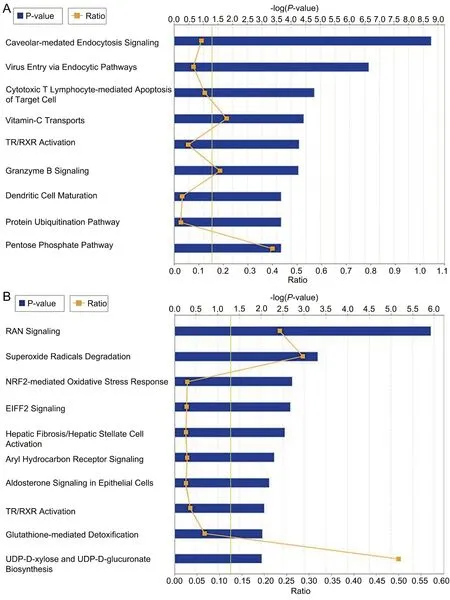
图3 不同分化程度甲状腺细胞间差异蛋白的信号通路分布。A,正常甲状腺细胞系与低分化甲状腺癌细胞系差异表达蛋白质的通路分布;B,甲状腺低分化与中分化细胞系差异表达蛋白质的通路分布Fig. 3 The pathway distribution of the differential proteins between thyroid cells at different levels of differentiation. A, the pathway distribution of differentially expressed proteins between the normal thyroid cell lines and poorly-differentiated thyroid cancer cell lines; B, the pathway distribution of differentially expressed proteins between poorly- and moderately-differentiated thyroid cell lines
4 不同分化程度甲状腺细胞间差异蛋白的相互关系
根据差异蛋白已有的文献报道,利用功能性蛋白质关联网络String网站(https://cn.string-db.org/cgi/input.pl)对甲状腺癌低分化与中分化细胞系、低分化与正常甲状腺细胞系之间差异表达蛋白的相互作用网络进行了分析。低分化与中分化甲状腺癌细胞系间差异表达的蛋白的相互关系如图4A所示,COL1A1与HMGA1之间以及Cav-1与KRT7、HMGA1之间存在相互作用关系;甲状腺癌低分化细胞系与正常甲状腺细胞系差异表达蛋白的相互关系如图4B所示, COL1A1与HMGA1之间以及Cav-1与KRT7、HMGA1蛋白之间存在相互作用关系。

图4 不同分化程度甲状腺细胞间差异蛋白间的相互关系。A,低分化与中分化甲状腺癌细胞系间差异表达的蛋白的相互关系;B,甲状腺癌低分化细胞系与正常甲状腺细胞系差异表达蛋白的相互关系;红色代表上调的蛋白质,绿色代表下调的蛋白质Fig. 4 Interaction between differential proteins of thyroid cells at different levels of differentiation. A, relationship of differentially expressed proteins between poorly and moderately-differentiated thyroid cancer cell lines; B, relationship of differentially expressed proteins between poorly-differentiated thyroid cancer cell lines and normal thyroid cell lines; red representing up-regulated proteins and green representing down-regulated proteins
5 COL1A1、Cav-1、TRX、Rock-1 表达水平随细胞的分化能力而一致性上调
用免疫印迹分析方法检测甲状腺细胞系Nthyori3-1和不同分化程度的甲状腺癌细胞系THJ-16T、FTC133中COL1A1、COL1A2、Cav-1、FSCN1、TRX、 HMGA1、SOD2、Rock-1、KRT7、KRT8水平 表 明:COL1A1[10]、Cav-1[11]、TRX[12]、Rock1[13]随细胞的分化能力的增加有一致的上调(图5)。

图5 Nthy-ori3-1、THJ-16T、FTC133细胞系中COL1A1、CAV-1、TRX 和ROCK-1表达的免疫印迹检测Fig. 5 Western blot detection for the expression of COL1A1, CAV-1, TRX and ROCK-1 in cell lines Nthy-ori3-1, THJ-16T and FTC133
对甲状腺细胞系Nthy-ori3-1和不同分化程度的甲状腺癌细胞系THJ-16T、FTC133中COL1A、TRX和Rock-1表达水平进行免疫细胞化学检测显示,COL1A、TRX、Rock-1 免疫反应性随细胞的分化能力而一致性增强(图6)。
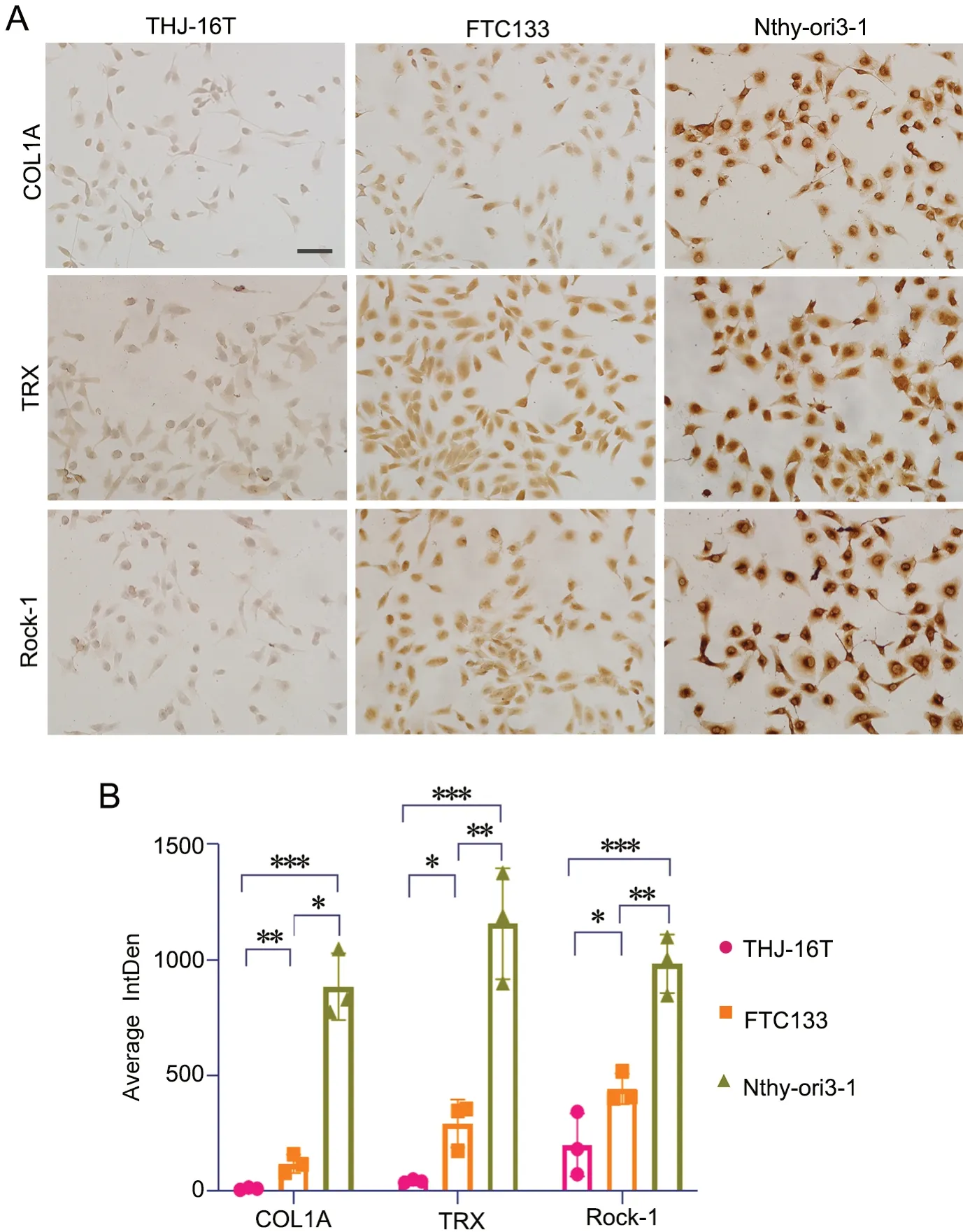
图6 Nthy-ori3-1、THJ-16T和FTC133细胞系中COL1A、TRX、Rock-1 表达的免疫细胞化学检测。A,COL1A、TRX和Rock-1 表达水平的代表性免疫细胞化学检测结果(比例尺,50μm);B,COL1A、TRX和Rock-1 表达水平的统计学分析;*0.01 通过蛋白组学[14]方法对正常甲状腺细胞系和中、低分化的甲状腺癌细胞系进行了全谱系分析,在中分化的甲状腺癌细胞系与低分化的甲状腺癌细胞系种检测到差异表达蛋白质101个,获得正常甲状腺细胞与中分化甲状腺细胞系差异表达蛋白质103个,正常甲状腺细胞系与低分化甲状腺癌细胞系差 异表达蛋白质106个。结果证明,基于液质联用[15]蛋白质组学分析显著提高寻找差异蛋白的效率,能高速快捷地检测到数百个差异蛋白;纳升级的定量蛋白质组学研究,所需的检测样品更加恒量,检测结果更加准确。 对288个差异表达蛋白质所在的信息通路进行生物信息学分析,了解到288个差异表达蛋白质可能影响的信息通路,便于推测其生物学功能。分析表明:差异蛋白质主要参与T淋巴细胞介导的细胞凋亡、维生素C运输、蛋白质泛素化、RAN信号 、超氧化物自由基降解等。根据目前人类探索蛋白质之间相互关系的文献,利用String网站勾勒出这些蛋白的相互作用网络图,揭示了这些蛋白质之间的相互关系,发现COL1A1与HMGA1之间以及Cav-1与KRT7、HMGA1之间存在相互作用关系,为后续蛋白质的功能研究提供基础数据和线索。 为了在质谱研究和生物信息学分析的基础上,不断地缩小生物标记物的范围,选取COL1A1、COL1A2、Cav-1、FSCN1、TRX、 HMGA1、SOD2、Rock-1 KRT7、KRT8等差异蛋白进行Western blot检测分析,结果表明COL1A1、Cav1、TRX、Rock1的表达随细胞的分化能力的增加而上调。应用免疫细胞化学染色技术进一步验证了COL1A、TRX、Rock-1的表达水平随细胞分化能力的增加而上调。 新的甲状腺癌生物标志物的发现,极大地提高了对甲状腺癌分子发病机制的认识,从而为甲状腺癌患者提供更加个性化的治疗[16]。细胞系的质谱分析为我们的临床研究提供了基本线索,进一步根据这些基础研究的线索,进行大样本的临床验证,筛选出可用于临床检测的生物标记物,将提高临床检测的准确性,进而更好地指导临床治疗。讨论

