敲除趋化性细胞因子受体5降低小鼠脑出血后细胞铁死亡
曲洪玮,卢凯,黄珊珊,朱遂强
(华中科技大学同济医学院附属同济医院神经内科,武汉 430030)
脑出血(intracerebral hemorrhage, ICH)占全世界所有中风的10%~15%,是一种极具破坏性的脑卒中亚型,具有高死亡率和发病率[1]。在初始损伤后,ICH继发性脑损伤导致预后较差,目前尚无有效的治疗方法[2],给社会和家庭带来沉重的负担。铁死亡(ferroptosis)是一种由铁依赖脂质过氧化物堆积引起的新的程序性细胞死亡形式[3]。铁死亡广泛参与各种神经病理进程,与神经退行性疾病、癫痫、脑卒中、脑外伤等密切相关[4]。已有研究表明在老年小鼠ICH后出现细胞铁死亡[5],然而其具体的发病机制至今未明。
趋化性细胞因子受体5(C-C chemokine receptor 5, CCR5)是一种7次跨膜的G蛋白偶联受体,在炎症反应初期参与募集白细胞进入组织损伤区域,是进行炎症信号转导的关键分子,并已被证明是抗炎治疗的一个可行靶点[6]。FDA批准的用于HIV患者的选择性CCR5拮抗剂——马拉维若(maraviroc, MVC)可改善免疫介导的急性和慢性组织炎症动物模型的结局[7]。最近的研究表明,抑制CCR5可促进小鼠创伤性脑损伤及脑缺血后小鼠运动功能的早期恢复[8]。另一方面,应用CCR5及拮抗剂的多项研究表明炎症缓解并不是CCR5抑制的唯一结果。尤其在对CCR5免疫反应与HIV感染、卒中和阿尔茨海默病(AD)相关神经认知障碍关系的研究中发现,CCR5还参与调节学习相关细胞信号传导和神经元可塑性介导多种形式的学习和记忆改变[8]。因此,CCR5极可能通过延伸的分子间相互作用同时促进炎症及非炎症信号级联反应而加剧疾病进程。CCR5是否参与ICH后细胞铁死亡病理进程,目前未见报道。
铁死亡是用来描述小分子清除素抑制胱氨酸的输入,导致谷胱甘肽消耗和磷脂过氧化物酶谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)失活引起的细胞死亡形式[3,9];在出血性脑卒中中,减轻铁死亡可以通过抑制脂质过氧化作用从而减少神经功能损伤[10]。谷胱甘肽过氧化物酶4将潜在有毒的脂质氢过氧化物(L-OOH)转化为无毒的脂质醇(L-OH)[11],因此谷胱甘肽过氧化物酶4可以作为衡量铁死亡程度的指标。本研究利用CCR5基因敲除(CCR5-/-小鼠, 分析CCR5对小鼠ICH后细胞铁死亡的影响。
材料与方法
1 材料
CCR5-/-雄性C57BL/6小鼠从江苏集萃公司购入,经华中科技大学同济医院动物实验中心(SPF级)净化后,与野生型(WT)C57BL/6小鼠繁育子代得到CCR5+/-F1子代。F1代CCR5+/-基因型雌雄合笼繁育得F2代,经基因鉴定筛选出CCR5+/+和CCR5-/-小鼠分别作为对照组和实验组。实验选用7~9周龄、24~26 g雄性小鼠,分为4组:野生型生理盐水组(WT-Saline)、野生型脑出血组(WTICH)、基因敲除生理盐水组(CCR5-/-- Saline)、基因敲除脑出血组(CCR5-/--ICH),每组3只。所有实验操作均遵守华中科技大学同济医院动物实验中心动物伦理要求并按照实验动物使用原则进行。
2 ICH模型建立
用2%戊巴比妥钠麻醉小鼠,用小鼠立体定位器固定小鼠使小鼠头颅呈水平。将0.1 U的VII型胶原酶溶液(Sigma-Aldrich)融在在0.5 μL无菌生理盐水中配成工作液。0.5 mm直径孔钻头骨,用微量注射器将0.5 μL工作液以0.1 μL/min的速度慢慢注入到纹状体中(立体定向坐标为:前囟+0.20 mm,右旁开2.30 mm,深-3.50 mm[12])。注射完毕后留针5 min。对照组与ICH组手术操作方式一致,微量注入不含胶原酶的无菌生理盐水。
3 取材及切片
于造模后72 h,麻醉IHC模型鼠后经心灌注 0.9%生理盐水(25~50 mL)至右心耳流出液体清亮。断头取脑后轻轻剥除颅骨,于4%多聚甲醛固定液中4°C固定12 h。将鼠脑依次转至25~50 mL含10%和30%蔗糖的0.1 mol/L PBS中,分别脱水直至组织沉底,0.01 mol/L PBS清洗后用OCT胶包裹固定在冰冻切片机冻头上,冠状切片,切片厚度20 μm,每个脑共切150张切片。切片裱于防脱落载玻片上,空气干燥后冰箱内保存。
4 HE染色
将小鼠脑冰冻切片室温复温后,加入4%多聚甲醛溶液再固定10 min,PBS漂洗3次,每次5 min,蒸馏水略洗后置于苏木素溶液中染色3 min,流水冲洗余色; 0.7%盐酸乙醇中分化10 s,流水缓慢冲洗,95%乙醇中浸泡10 s后在伊红染液中染色1 min,流水缓慢冲洗余色;先后于75%、95%、100%(I)、100%(II)乙醇中各脱水10 s,二甲苯I和二甲苯II 中各透明10 s后中性树胶封片。
5 免疫荧光染色
小鼠脑冰冻切片在染色缸充分复温,加预冷4%多聚甲醛后固定20 min;0.01 mol/L PBS 漂洗3次,每次6 min。轻柔吸去多余液体, 免疫组织化学笔沿切片边缘勾画轮廓,滴加破膜液10 μL,覆盖整个切片,室温孵育15 min;0.01 mol/L PBS 漂洗3次,每次6 min,轻柔吸去周围多余液体,滴加封闭液10 μL,室温孵育1 h;封闭结束后0.01 mol/L PBS 漂洗2次,每次5 min。吸去周围多余液体,滴加兔抗小鼠GPX4 抗体(1∶200)覆盖整个切片,4 ℃湿盒孵育16 h;0.01 mol/L PBS漂洗3次,每次7 min。吸去周围多余液体,滴加Alexa 488标记的驴抗兔IgG(1∶200),室温避光孵育1 h;0.01 mol/L PBS 漂洗3次,每次6 min。DAPI染色液室温避光孵育15 min后0.01 mol/L PBS漂洗3次,每次7 min。避光条件下滴加50%甘油封片后,通过共聚焦显微镜观察和拍摄图像,每张脑片采集出血区域(基底节)部位脑片做后续统计分析。
6 Western blotting
取造模后72 h的出血区周边 3 mm 范围的脑组织,对照组取基底节部位组织,称重后放入预冷的容器中,每0.05 g组织加入500 μL RIPA裂解液及10 μL Cocktail蛋白酶抑制剂,于冰上充分研磨10 min后冰上裂解30 min;匀浆移入 1.5 mL离心管中,超声破碎2次,每次3~5 s(2次之间间隔10 min),后在4 ℃环境下以12000 r/min离心15 min;离心后取上清,BCA法测量蛋白浓度,按每孔50 μg蛋白加样,12% SDS PAGE电泳,4 ℃恒流转膜90 min;转膜结束后将NC膜小心置于脱脂奶粉封闭液中室温下于摇床上孵育1 h;封闭结束后,用TBST将膜漂洗2次,每次5 min;兔抗GPX4 (1∶1000)、兔抗GAPDH(1∶10000)一抗4 ℃摇床上孵育16 h;一抗孵育结束后,用TBST将膜漂洗3次,每次5min, HPR标记的羊抗兔IgG(1:10000)室温孵育1 h;二抗孵育结束后,用TBST将膜漂洗3次,每次5 min;超敏ECL孵育显影,博鹭腾GelView 6000 Pro化学发光式分析仪成像, Image Lab软件分析结果,以GPX4 与GAPDH条带光密度比值代表GPX4相对水平。
7 统计学分析
结果以均数±标准差(±s)表示,实验数据采用 SPSS 19.0 进行统计学分析。两组之间均数比较采用t检验;多于俩组数据的均数的两两比较用单因素方差分析事后LSD检验。P<0.05 则认为差异具有统计学意义。
结果
1 ICH后脑组织出现细胞铁死亡
在WT小鼠脑内注射胶原酶后,肉眼观察即可见脑内典型的血肿(图1A);脑片HE染色可见右侧基底节区出现较大片染色丢失区域(图1B)。免疫荧光染色显示,在注射胶原酶的WT小鼠(WTICH组)脑出血区周围脑区,GPX4免疫反应性明显减弱,与注射生理盐水(WT-Saline组)相比,ICH模型小鼠GPX4阳性细胞明显减少,反应强度明显减弱(图2)。Western blot分析显示,与注射生理盐水(WT-Saline组)相比,在注射胶原酶的WT小鼠(WT-ICH组)脑出血区周围脑区,GPX4蛋白表达量明显减少(图3)。以上结果表明ICH后可出现细胞铁死亡。
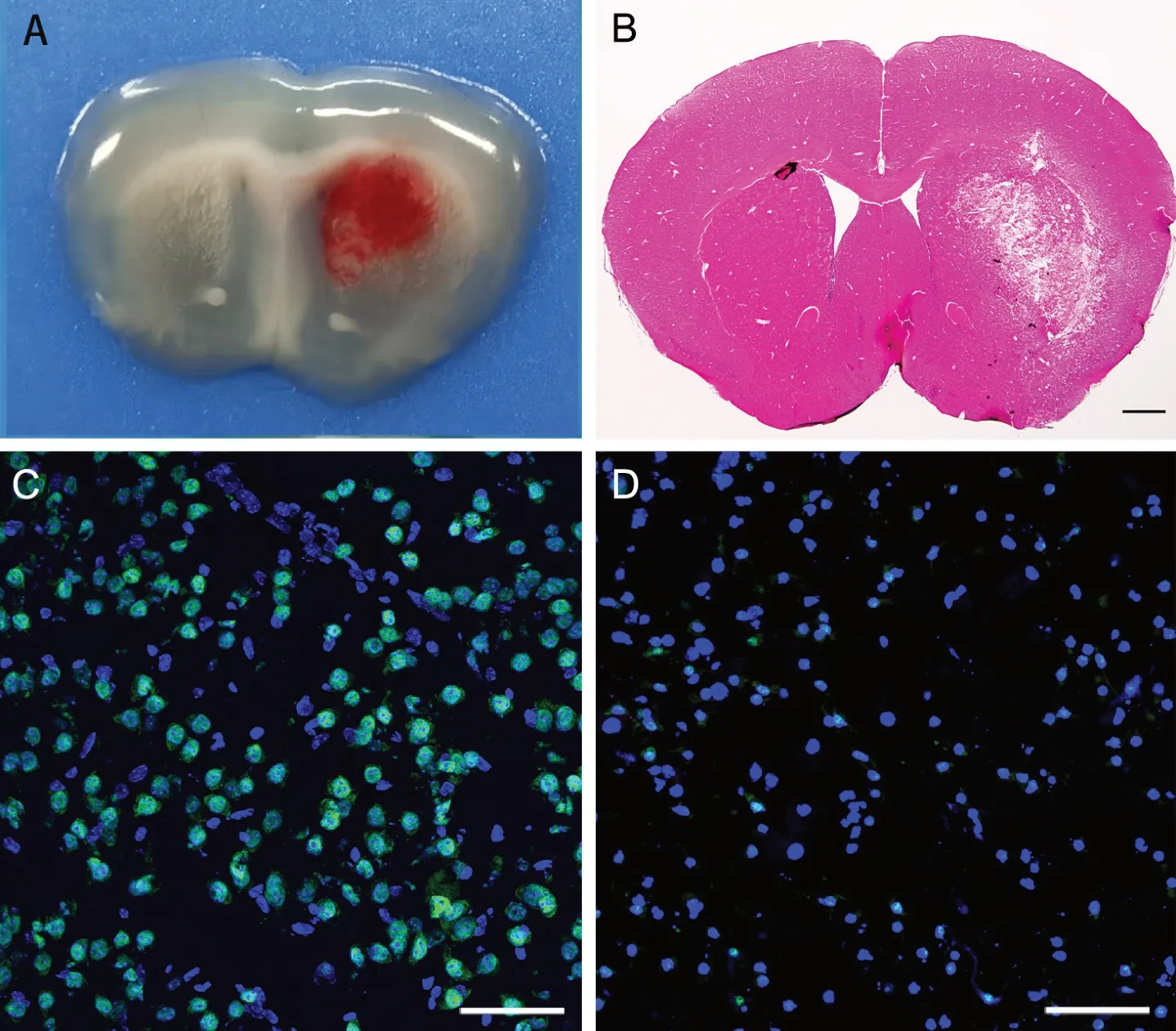
图1 小鼠ICH对脑组织内GPX4免疫反应性的影响。A,WT-ICH组小鼠脑内血肿肉眼观; B,WT-ICH组小鼠脑切片HE染色结果;C,WT-Saline组小鼠脑切片GPX4免疫荧光染色(DAPI复染);D,WT-ICH组小鼠脑切片GPX4免疫荧光染色(DAPI复染);绿色,GPX4免疫荧光染色;蓝色,DAPI染色;比例尺,50 μm Fig. 1 Effect of ICH on GPX4 immunoreactivity in mouse brain. A, macroscopic observation of intracerebral hematoma in WT-ICH group; B, HE staining results of brain sections of mice in WT-ICH group; C. GPX4 immunofluorescence staining of the brain section in WT-Saline group (DAPI counterstaining); D, GPX4 immunofluorescence staining of the brain section in WT-ICH group (DAPI counterstaining); green, GPX4-immunofluorescence staining; blue, DAPI staining; scale bar, 50 μm
2 CCR5敲除减轻ICH后细胞铁死亡
为了明确CCR5在ICH后脑内神经细胞铁死亡中的作用,继而检测了敲除CCR5对ICH后细胞铁死亡的影响。免疫荧光染色显示,相对于WT-ICH组, CCR5-/--ICH组GPX4阳性细胞数和GPX4免疫荧光强度的降低被抑制(图2);Western blot分析显示,相对于WT-ICH组, CCR5-/--ICH组GPX4水平明显增高(图3)。由此表明,敲除CCR5可减少ICH损伤时脑内神经细胞铁死亡。

图2 CCR5敲除对ICH小鼠脑内GPX4表达影响的免疫荧光检测。 A,WT-Saline组(A1)、WT- ICH组(A2)、CCR5-/--Saline 组(A3)和CCR5-/--ICH组(A4)脑组织GPX4表达的代表性免疫荧光染色结果(绿色,GPX4 ;蓝色,细胞核DAPI复染);比例尺,50 μm。B,GPX4阳性细胞数(B1)和GPX4免疫荧光强度(B2)统计学分析;***P<0.001;**0.001<P<0.01;*0.01<P<0.05;n=3Fig. 2 Immunofluorescence detection of the effect of CCR5 knockout on the expression of GPX4 in the brain of ICH mice. A, representative immunofluorescence staining results of GPX4 expression in the brain tissues of WT-Saline group (A1), WT-ICH group (A2), CCR5-/--Saline group (A3) and CCR5-/--ICH group (A4) (green, GPX4; blue, nuclear DAPI counterstaining); scale bar, 50 µm。 B, statistical analysis of the number of GPX4 positive cells (B1) and the intensity of GPx4 immunofluorescence (B2); ***P<0.001; **0.001 图3 CCR5敲除对ICH小鼠脑内GPX4表达影响的Western blot检测。 A,WT-Saline组、WT- ICH组、CCR5-/--Saline组和CCR5-/--ICH组脑组织GPX4水平的代表性Western blot检测结果。B,GPX4阳性细胞数(左)和GPX4免疫荧光强度(右)统计学分析;***P<0.001;**0.001<P<0.01;*0.01<P<0.05;n=3Fig. 2 Immunofluorescence detection of the effect of CCR5 knockout on the expression of GPX4 in the brain of ICH mice. A, representative GPX4 immunofluorescence staining results of brain tissues in WT-Saline group (a), WT-ICH group (b), CCR5-/--Saline group (c) and CCR5-/--ICH group (d) (green, GPX4; blue, nuclear DAPI counterstaining); scale bar, 50 µm。 B, statistical analysis of the number of GPX4 positive cells (left) and the intensity of GPx4 immunofluorescence (right); ***P<0.001; **0.001 铁死亡是一种铁依赖形式的非凋亡性细胞死亡。形态学上,铁死亡主要表现为细胞膜断裂和出泡,线粒体萎缩、膜密度增加、线粒体嵴减少甚至消失,但细胞核形态正常,无核浓缩或染色质凝集现象。生物化学上,铁死亡最重要特征为细胞内大量铁离子聚集、活性氧(reactive oxygen species, ROS)过度产生、谷胱甘肽(glutathione, GSH)耗竭等[3]。细胞内核酸、蛋白质和脂质膜被破坏,最终导致细胞死亡。在体和体外实验均证明,ICH模型中抑制铁死亡可获益[13]。GPX4 是一种内源性抗氧化酶,它能完成脂质过氧化物向无毒脂质的转化,并能抵抗脂质过氧化[14],且GPX4表达减少可引起细胞铁死亡和脂质活性氧积累[15]从而发生细胞铁死亡。在本实验中我们运用VII型胶原酶构建ICH模型后GPX4表达明显减少,再次证实ICH后可出现细胞铁死亡病理过程。 CCR5作为关键的炎症受体,与趋化因子配体 CCL5等相互作用后调节细胞和体液免疫,在各种炎症疾病中发挥作用[16]。CCR5还在癌症发展和类风湿性关节炎等自身免疫性疾病中发挥作用[17]。在中枢神经系统,CCR5被证实参与脑梗死、ICH,多发性硬化,帕金森病和拉斯穆森脑炎等的病理进程[7,18]。最近的研究更确立AD相关的CCR5与神经元可塑性之间的关联[7]。尤其值得关注的是,美国食品和药物管理局 (FDA) 批准的唯一第一代CCR5拮抗剂MVC耐受性良好,对抗HIV病毒显示确定疗效且具有治疗其他疾病的潜能[7]。长期以来,大量神经疾病研究因未能产生有效的临床转化而停滞不前。因此,如能确立某疾病与CCR5相关,则进行预期有效的临床治疗将有巨大前景。NADPH氧化酶(Nox)是脉管炎ROS的主要来源, CCR5的配体CCL5可以浓度和时间依赖性方式诱导Nox1表达,致使ROS产生,诱导血管细胞迁移、增殖和炎症标志物增加;MVC预处理可减弱CCL5/CCR5诱导的Nox1表达[19]。鉴于ROS是细胞铁死亡的关键生物化学表征,CCR5很可能是同时关联炎症反应与铁死亡的细胞因子之一。这一猜想在本研究利用CCR5基因敲除小鼠进行的脑出血研究中得到初步验证:CCR5基因敲除可减少脑出血周边细胞铁死亡的发生, CCR5可能参与脑出血后细胞铁死亡的病理进程。但是CCR5通过何种分子机制调节细胞铁死亡仍需要进一步研究。
讨论

