miR-345-5p靶向下调KIF15抑制非小细胞肺癌细胞增殖、迁移及侵袭
王志刚,鲁静,王明华,崔秀卿
(1保定莲池区人民医院肿瘤科,保定 071000;2湖北省肿瘤医院肿瘤内科,武汉 430000;3保定市第二医院老年病科,保定 071000)
肺癌是最常见的癌症之一,也是全球人口因癌症死亡的主要原因[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌病例的80%以上,由于临床症状不明显发作较晚,筛查方法不完善,许多NSCLC患者被确诊时已为晚期。尽管在医学治疗方面有了进步和改善,但肺癌患者的5年存活率仍然很低[2]。因此,确定新的预测标志物和治疗靶点对于肺癌的治疗具有重要意义。miRNA是小的内源性非编码RNA,它们通过结合靶基因3’非翻译区中的互补序列负调控mRNA的稳定性或抑制mRNA翻译[3]。大多数miRNA以组织特异性方式充当肿瘤抑制因子或癌基因,miRNA表达失调与人类癌症的发生和发展密切相关[4]。已有研究报道,miR-345-5p在甲状腺乳头状癌中表达失调,可抑制肿瘤增殖,发挥抑癌效果[5],而运动蛋白超家族蛋白15(kinesin superfamily proteins 15,KIF15)作为一种基于微管的、正端导向的运动蛋白,能够参与纺锤体装配、质膜运输和细胞分裂等多种细胞过程[6]。相关研究表明,KIF15参与胰腺癌、肺癌等多种肿瘤生长[7,8]。然而miR-345-5p调控K I F15参与NSCLC增殖、迁移、侵袭的研究,尚未见报道。因此,本研究通过检测NSCLC组织与细胞中miR-345-5p表达水平,探讨miR-345-5p/KIF15轴对NSCLC细胞增殖、迁移及侵袭的影响,以期为NSCLC的临床治疗提供参考依据。
材料与方法
1 NSCLC组织标本及细胞系
2018年5 月至2019年5月期间在本院进行手术切除的肺癌患者中收集40对NSCLC组织及其癌旁组织样本,并将所有组织样本速冻保存在液氮中。所有患者术前未接受过任何放疗或化疗。本研究得到湖北省肿瘤医院伦理委员会批准,所有患者均签署了知情同意书。
人NSCLC细胞系A549、NCI-H358、SPC-A-1及人正常肺上皮细胞系BEAS-2B均购自美国典型培养物保藏中心。
2 主要试剂与仪器
miR-345-5p模拟物(miR-345-5p mimics)及其阴性对照(miR-NC)、miR-345-5p抑制物(antimiR-345-5p)及其阴性对照(anti-miR-NC)、KIF15过表达物(KIF15 OE)及其阴性对照(OE-NC)均购自美国ThermoFisher公司;DMEM培养基、胎牛血清(FBS)均购自TaKaRa公司;CCK-8试剂盒、Transwell小室均购自金图生物科技有限公司;蛋白提取试剂盒、BCA试剂盒、Lipofectamine 2000转染试剂盒均购自美国Bio-Rad公司;EdU试剂盒购自上海觅拓生物科技有限公司;TaqMan MicroRNA逆转录试剂盒、TransStart®Green qPCR SuperMix、双荧光素酶报告基因检测试剂盒均购自北京全式金生物科技有限公司;Trizol试剂、ECL化学发光试剂盒均购自Sigma公司;兔源一抗KIF15、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、基质金属蛋白酶2(matrix metal proteinase 2,MMP-2)、GAPDH、辣根过氧化物酶标记的羊抗兔IgG二抗均购自美国Abcam公司;荧光定量PCR仪购自Roche公司。
3 细胞培养与转染
将人NSCLC细胞系A549、NCI-H358、SPC-A-1及人正常肺上皮细胞系BEAS-2B置于含10% FBS的DMEM培养基中,并在37 ℃,含有5%CO2的培养箱中进行常规培养。将A549细胞以1×106个/孔的密度接种到6孔培养板中,观察到细胞融合率达到80% ~ 90%时,利用Lipofectamine 2000转染试剂盒对细胞进行分组转染。各组转染如下:miRNC组转染miR-NC,miR-345-5p mimics组转染miR-345-5p mimics,anti-miR-NC组转染anti-miR-NC,anti-miR-345-5p组转染anti-miR-345-5p,miR-345-5p mimics+OE-NC组 为miR-345-5p mimics与OENC共转染,miR-345-5p mimics+KIF15 OE组为miR-345-5p mimics与KIF15 OE共转染,最后取未转染的A549细胞作为空白对照,记为空白组。
4 免疫组织化学法检测NSCLC组织中PCNA、Bcl-2、MMP-2蛋白表达
将固定于4%多聚甲醛中的组织经梯度酒精脱水、石蜡包埋后,切成5 mm的切片,再将切片通过脱蜡和水化后,置于3%过氧化氢中孵育20 min,利用柠檬酸盐缓冲液进行抗原修复,加入一抗PCNA、Bcl-2、MMP-2,均为1:1000稀释,在4℃下孵育过夜,再将切片与羊抗兔二抗(1:2000)在室温下孵育1 h,加入辣根过氧化物酶标记的链霉素亲和素复合物孵育1 h,DAB显色后用苏木精复染,普通光学显微镜下观察PCNA、Bcl-2、MMP-2蛋白在NSCLC组织中的表达。
5 qRT-PCR检测NSCLC组织和细胞系中miR-345-5p表达水平
使用Trizol试剂提取各组织和细胞系总RNA。利用Nanodrop ND-1000确定RNA浓度和质量。利用TaqMan microRNA逆转录试剂盒将RNA(5 μg)反转录为cDNA。使用TransStart®Green qPCR SuperMix试剂盒对miR-345-5p表达水平进行定量。miR-345-5p扩增体系:2×TransStart®Green qPCR SuperMix 10 μL,Forward primer(10 μmol/L)0.5 μL,Reverse primer(10μmol/L)0.5 μL,cDNA模 板(1 μg)2 μL,RNase-Free H2O补足至20 μL。扩增条件为:95 ℃,30 s;95 ℃,5 s,60 ℃,20 s,72℃,10 s,共40个循环。使用U6作为内参基因,采用2-∆∆CT计算miR-345-5p mRNA相对表达水平。所用引物序列如下:U6正向引物:CTCGCTTCGGCAGCACA,U6反向引物:AACGCTTCACGAATTTGCGT;miR-345-5p正向引物:TCGGCGGCTGACTCCTAGTCCA,miR-345-5p反向引物:GTCGTATCCAGTGCAGGGTCCGAGGT。
6 CCK-8法检测A549细胞增殖情况
分别收集各组A549细胞接种至96孔板(1.0×105个/孔)中,在细胞转染0 h、24 h、48 h、72 h时分别加入10 μL CCK-8溶液于每个孔中,并在37 °C下孵育2 h。随后,采用全自动酶标仪测定A549细胞在450 nm波长处的吸光度(OD值)。
7 EdU染色检测细胞增殖
收集A549细胞接种至24孔板(5.0×104个/孔)培养48 h后,加入含50 μmol/L EdU的培养基孵育12 h,PBS洗涤3次,冰甲醇固定15 min,根据EdU试剂盒说明书进行染色,在荧光显微镜下观察细胞EdU染色情况,EdU染色阳性率(%)=EdU染色阳性细胞数/总细胞数×100%。
8 Transwell实验检测A549细胞迁移情况
收集各组细胞,将细胞浓度调整为1×104个/mL,并将各组细胞重悬于100 μL无血清的DMEM培养基中,且全部置于Transwell上腔室中。同时,将600 μL含10% FBS的DMEM培养基添加至下腔室。室温孵育24 h后,将迁移细胞用4%多聚甲醛固定30 min,并用0.1%结晶紫染色。在倒置显微镜下,随机选择5个区域观察细胞迁移数目。
9 Transwell实验检测A549细胞侵袭情况
在上腔室中预先涂上Matrigel胶,收集各组细胞,将细胞浓度调整为1×104个/mL,其余步骤同上述1.6,在倒置显微镜下,随机选择5个区域对穿膜细胞进行计数,以穿膜细胞数表示为细胞侵袭能力。
10 双荧光素酶报告基因实验验证miRNA-345-5p与KIF15的靶向关系
使用Targetscan7.2软件预测miRNA-345-5p与KIF15结合位点。分别构建KIF15野生型(WT)和突变型(MUT)3’-UTR区质粒,标记为WTKIF15、MUT-KIF15。将A549细胞置于含10% FBS的DMEM培养基中,于37 ℃,5% CO2恒温孵箱里培养,待细胞密度达到80%左右时,按照以下分组转染:miR-NC+WT-KIF15共转染组、miRNA-345-5p mimics+WT-KIF15共转染组、miR-NC+MUT-KIF15共转染组、miRNA-345-5p mimics+MUT-KIF15共转染组,每组各设6个复孔。转染48 h后,通过双荧光素酶检测试剂盒进行酶活测定。
11 Western blot检测A549细胞中KIF15蛋白表达水平
将细胞在含有1 mmol/L苯甲基磺酰氟的RIPA缓冲液中裂解。使用BCA蛋白测定试剂盒确定蛋白浓度。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离等量蛋白质(50 µg),并转移到PVDF膜上。用5%脱脂奶粉封闭2 h后,将膜与兔抗KIF15(1︰1000)和兔抗GADPH(1︰1500)4 ℃孵育过夜。经洗涤后,加入辣根过氧化物酶标记的羊抗兔IgG二抗(1︰2000),37 ℃孵育2 h,然后使用ECL化学发光试剂可视化蛋白质。使用Image J软件对蛋白条带进行定量分析。
12 统计学分析
采用SPSS 25.0软件对实验数据统计分析,数据用均值±标准差(±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
结果
1 miR-345-5p在NSCLC组织和细胞系中降低
NSCLC组织中miR-345-5p表达水平显著低于癌旁组织(表1)。与BEAS-2B细胞相比,A549、NCI-H358、SPC-A-1细胞中miR-345-5p表达水平显著降低,以A549细胞系中降低最为明显(表2)。因此,后续选择A549细胞进行转染实验。
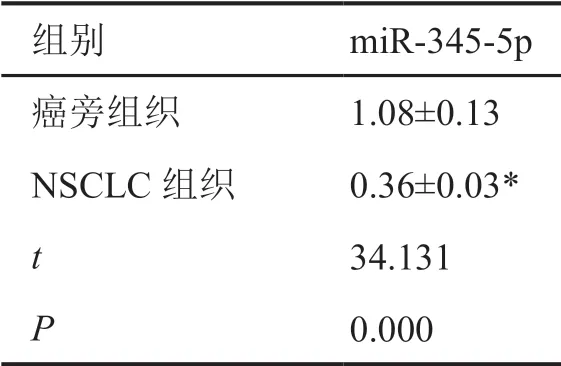
表1 miR-345-5p在NSCLC组织中的表达水平Tab. 1 Expression level of miR-345-5p in NSCLC tissue
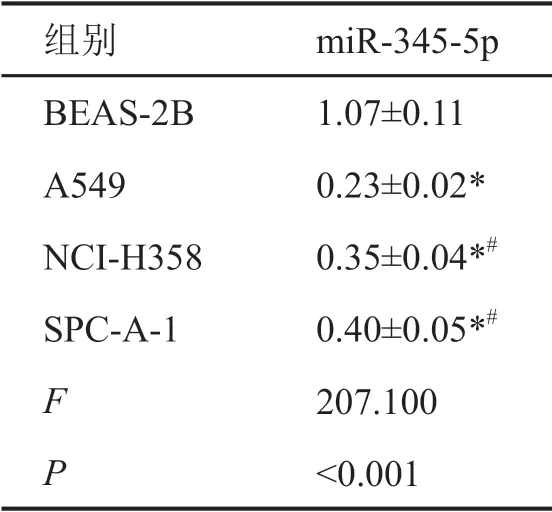
表2 miR-345-5p在NSCLC细胞系中的表达水平Tab. 2 Expression level of miR-345-5p in NSCLC cell line
2 NSCLC组织中PCNA、Bcl-2和MMP-2增高
免疫组织化学检测显示,NSCLC组织中PCNA、Bcl-2和MMP-2免疫反应性均显著强于癌旁组织(图1)。
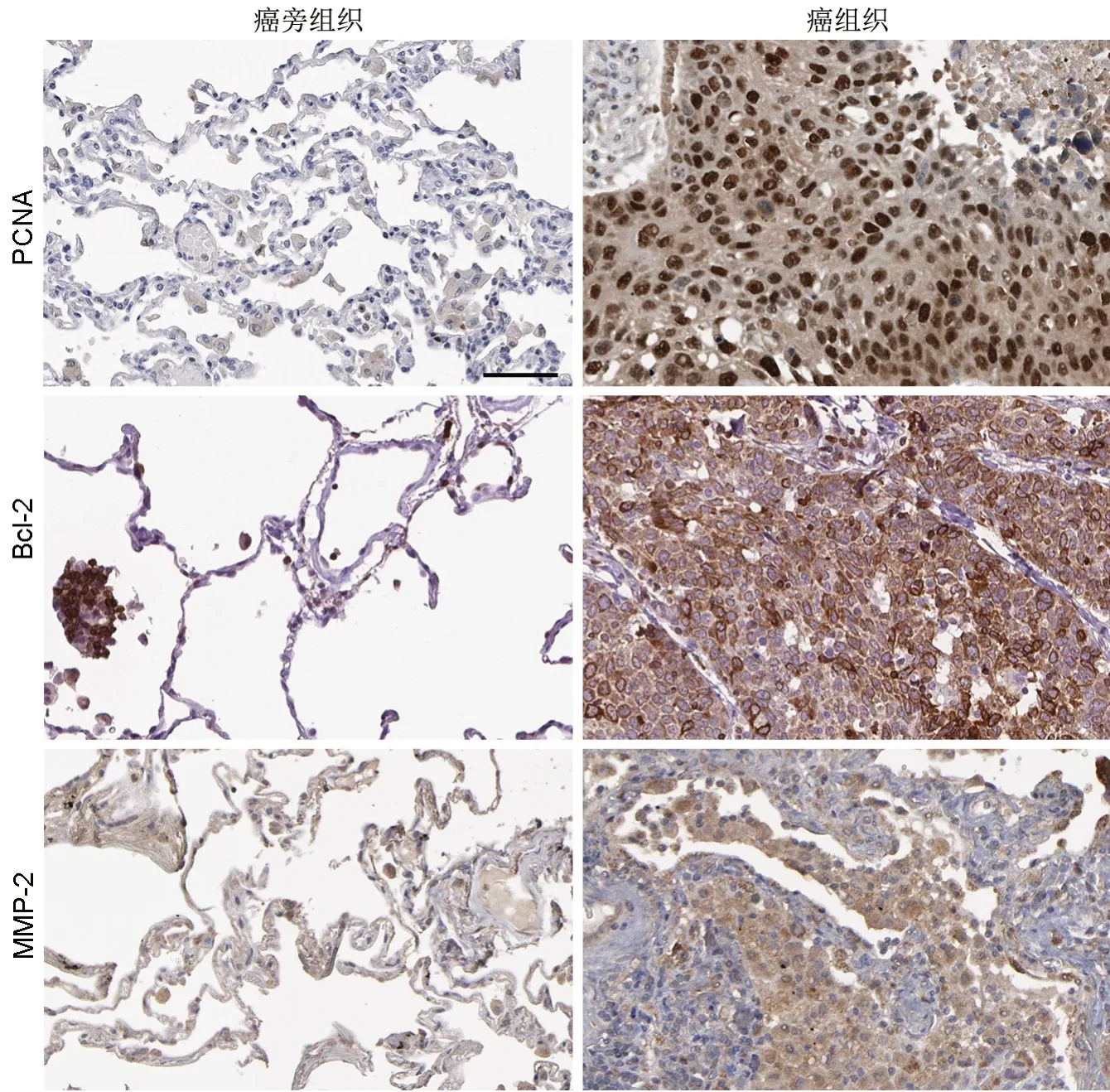
图1 免疫组织化学检测PCNA、Bcl-2、MMP-2在NSCLC组织中的表达。比例尺,50 µmFig 1 Immunohistochemical examination for the expression of PCNA, Bcl-2 and MMP-2 in NSCLC tissues. Scale bar, 50 µm
3 miR-345-5p抑制A549细胞增殖、迁移及侵袭
qRT-PCR检测显示:与空白组和miR-NC组相比,miR-345-5p mimics组A549细胞中miR-345-5p表达水平显著升高(表4)。CCK-8分析和Edu染色显示,miR-345-5p mimics组A549细胞在转染miR-345-5p mimics后24、48、72 h的增殖能力和EdU阳性细胞率明显低于空白组和miR-NC组(表3,图2);Transwell实验表明,与空白组和miR-NC组相比,miR-345-5p mimics组A549细胞的迁移及侵袭能力显著降低(表4,图3)。
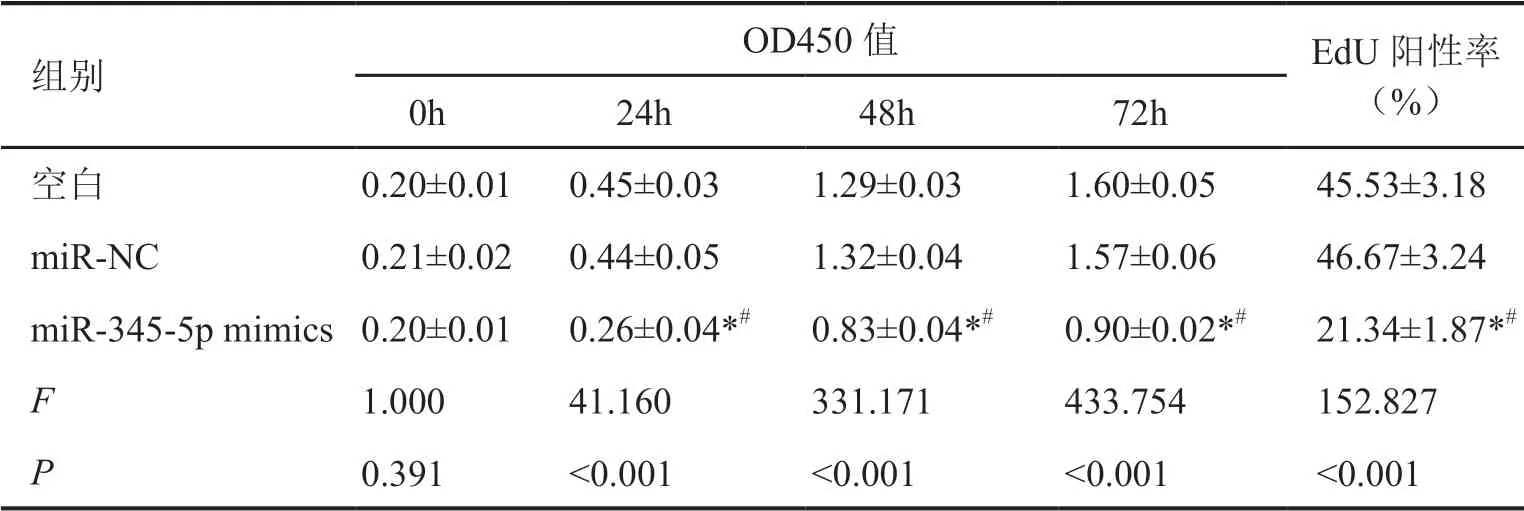
表3 上调miR-345-5p对A549细胞增殖的影响Tab. 3 Effect of up-regulation of miR-345-5p on proliferation of A549 cells
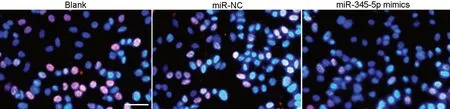
图2 EdU染色检测上调miR-345-5p对A549细胞增殖的影响。比例尺,50 µmFig 2 EdU staining for the effect of miR-345-5p up-regulation on the proliferation of A549 cell. Scale bar, 50 µm
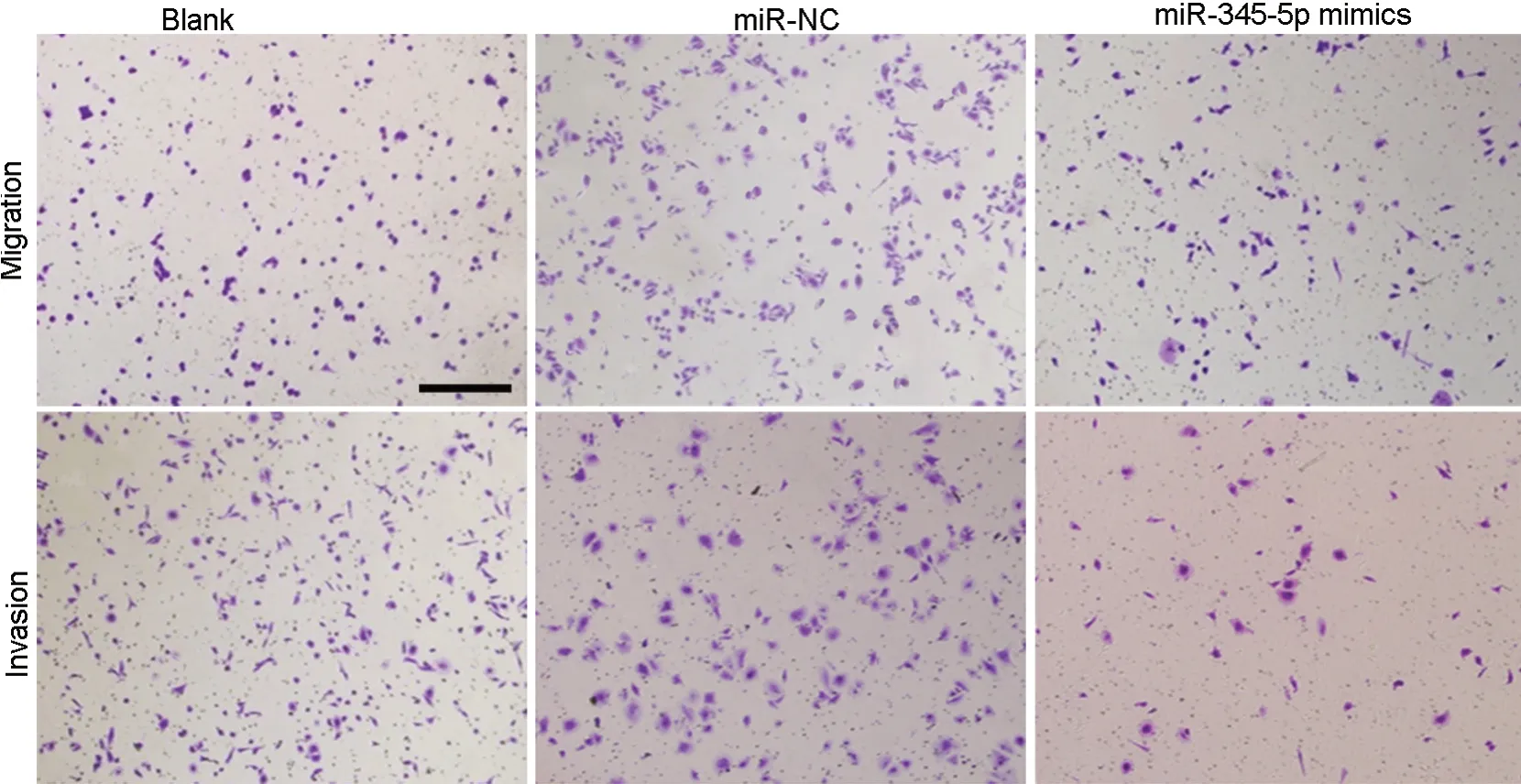
图3 上调miR-345-5p对A549细胞迁移和侵袭影响的Transwell实验检测。比例尺,100 µmFig. 3 Transwell assay for effect of up-regulation of miR-345-5p on migration and invasion of A549 cells. Scale bar, 100 µm
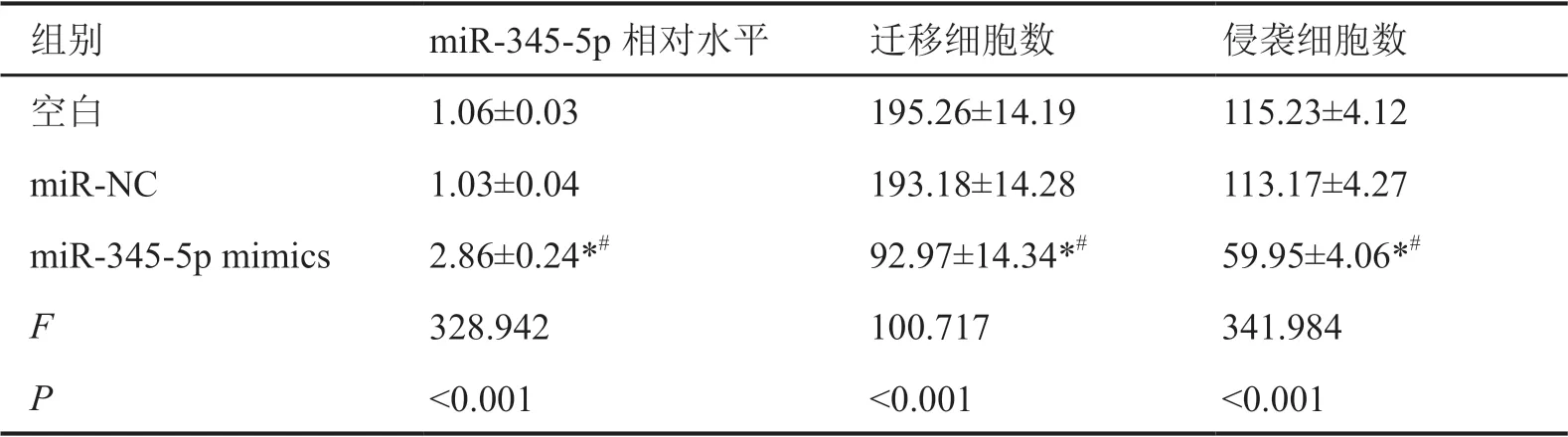
表4 上调miR-345-5p对A549细胞中miR-345-5p表达水平及细胞迁移、侵袭的影响Tab. 4 Effects of miR-345-5p up-regulation on the expression level of miR-345-5p, cell migration and invasion in A549 cells
4 miR-345-5p靶向调控KIF15表达
利用TargetScan软件预测发现KIF15 3’-UTR与miR-345-5p存在结合位点(图4)。双荧光素酶报告基因实验验证表明,与miR-NC+WT-KIF15组比较,miR-345-5p mimics+WT-KIF15组A549细胞荧光素酶相对活性显著降低,而miR-345-5p mimics+MUT-KIF15组A549细胞荧光素酶相对活性与miR-NC+MUT-KIF15组比较差异无统计学意义(表5)。qRT-PCR检测显示,anti-miR-345-5p组A549细胞中miR-345-5p表达水平显著低于空白组和antimiR-NC组(表6)。Western Blot结果显示,miR-345-5p mimics组A549细胞中KIF15蛋白的表达水平显著低于空白组和miR-NC组,而anti-miR-345-5p组A549细胞中KIF15蛋白的表达水平显著高于空白组和anti-miR-NC组(表6,图5)。实验结果表明,miR-345-5p与KIF15存在靶向关系。
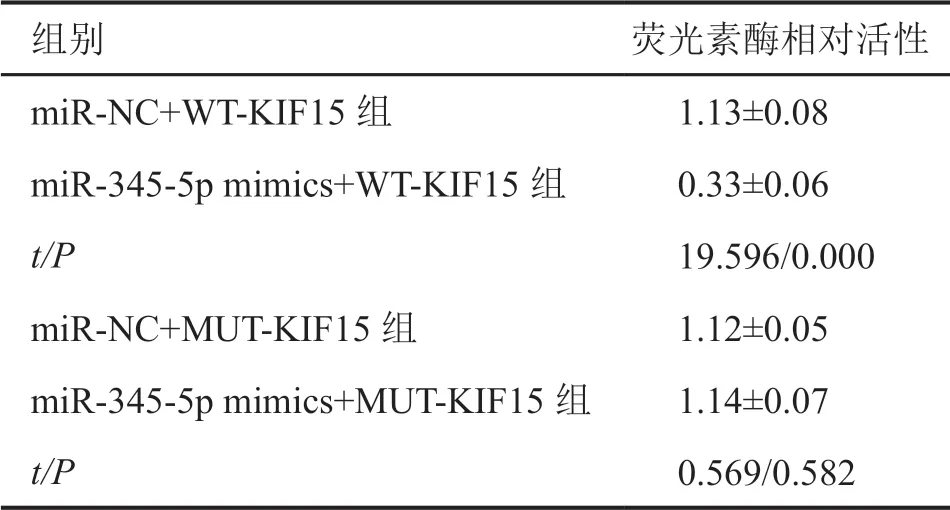
表5 双荧光素酶报告基因验证miR-345-5p与KIF15 3’-UTR的靶向关系Tab. 5 Target relationship between miR-345-5p and KIF15 3’-UTR verified by double luciferase reporter gene
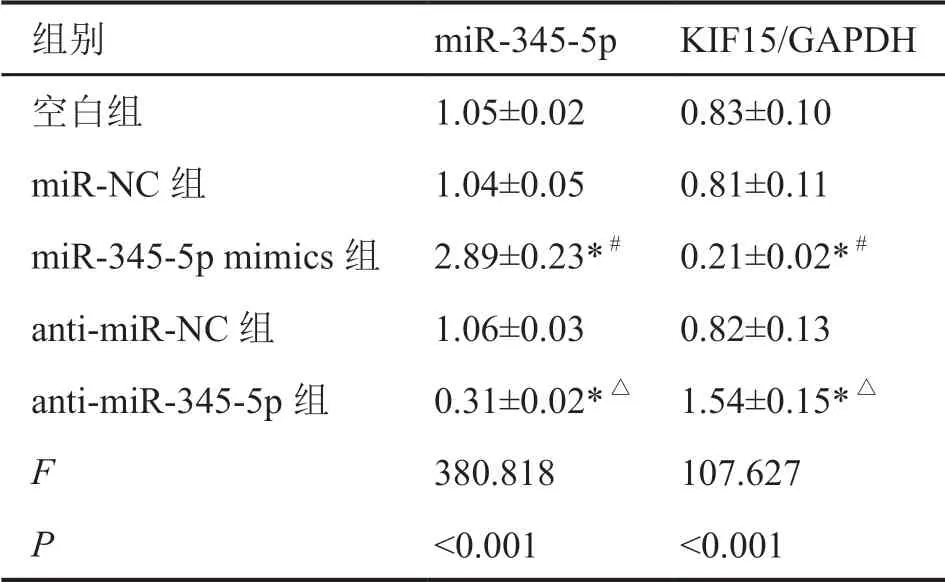
表6 miR-345-5p对A549细胞中KIF15蛋白表达水平的影响Tab. 6 Effect of miR-345-5p on KIF15 protein expression in A549 cells

图4 TargetScan预测miR-345-5p与KIF15 3’-UTR结合位点Fig 4 TargetScan prediction of the binding sites for miR-345-5p and KIF15 3’-UTR
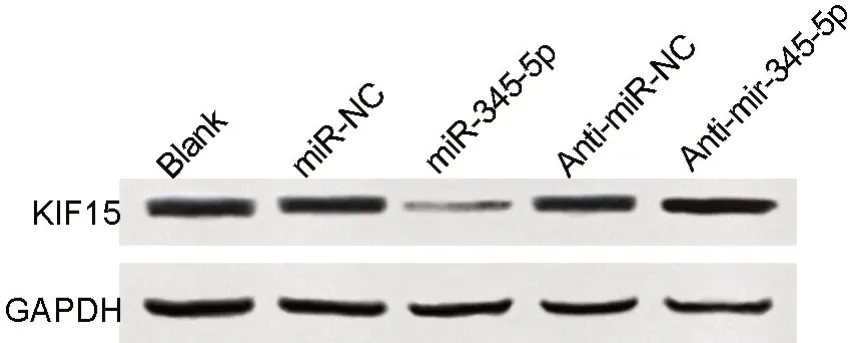
图5 miR-345-5p对A549细胞中KIF15蛋白表达水平的影响Fig. 5 Effect of miR-345-5p on KIF15 protein expression in A549 cells
5 KIF15过表达逆转上调miR-345-5p对A549细胞增殖、迁移及侵袭的抑制
与miR-345-5p mimics和miR-345-5p mimics + OE-NC组比较,miR-345-5p mimics + KIF15 OE组A549细胞中KIF15蛋白表达水平显著升高(表8,图6)。miR-345-5p mimics+KIF15 OE组A549细胞的增殖、迁移及侵袭能力显著高于miR-345-5p mimics组和miR-345-5p mimics + OE-NC组(表7,表8,图7,图8)。
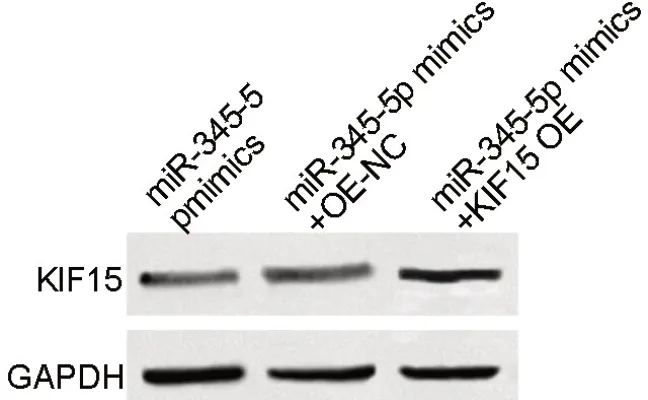
图6 KIF15过表达及上调miR-345-5p对A549细胞中KIF15蛋白影响的Western blot检测。Fig. 6 Western blot detection for the effects of KIF15 overexpression and up-regulation of miR-345-5p on KIF15 protein in A549 cells
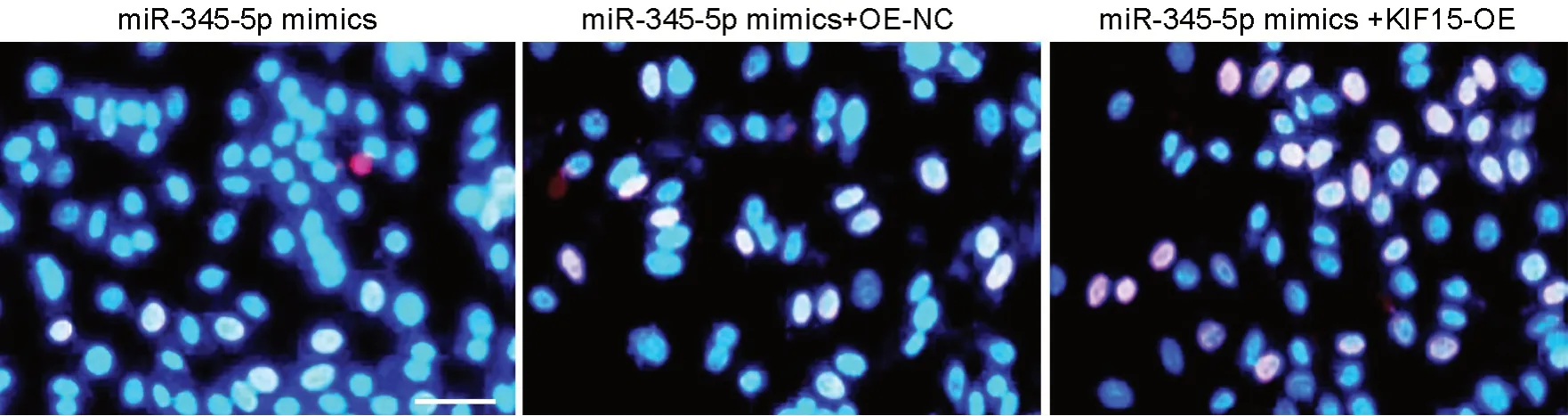
图7 EdU染色检测 KIF15过表达及上调miR-345-5p对A549细胞增殖的影响。比例尺,50 µmFig. 7 Edu staining detection for the effect of KIF15 overexpression and up-regulation of miR-345-5p on the proliferation of A549 cells. Scale bar, 50 µm
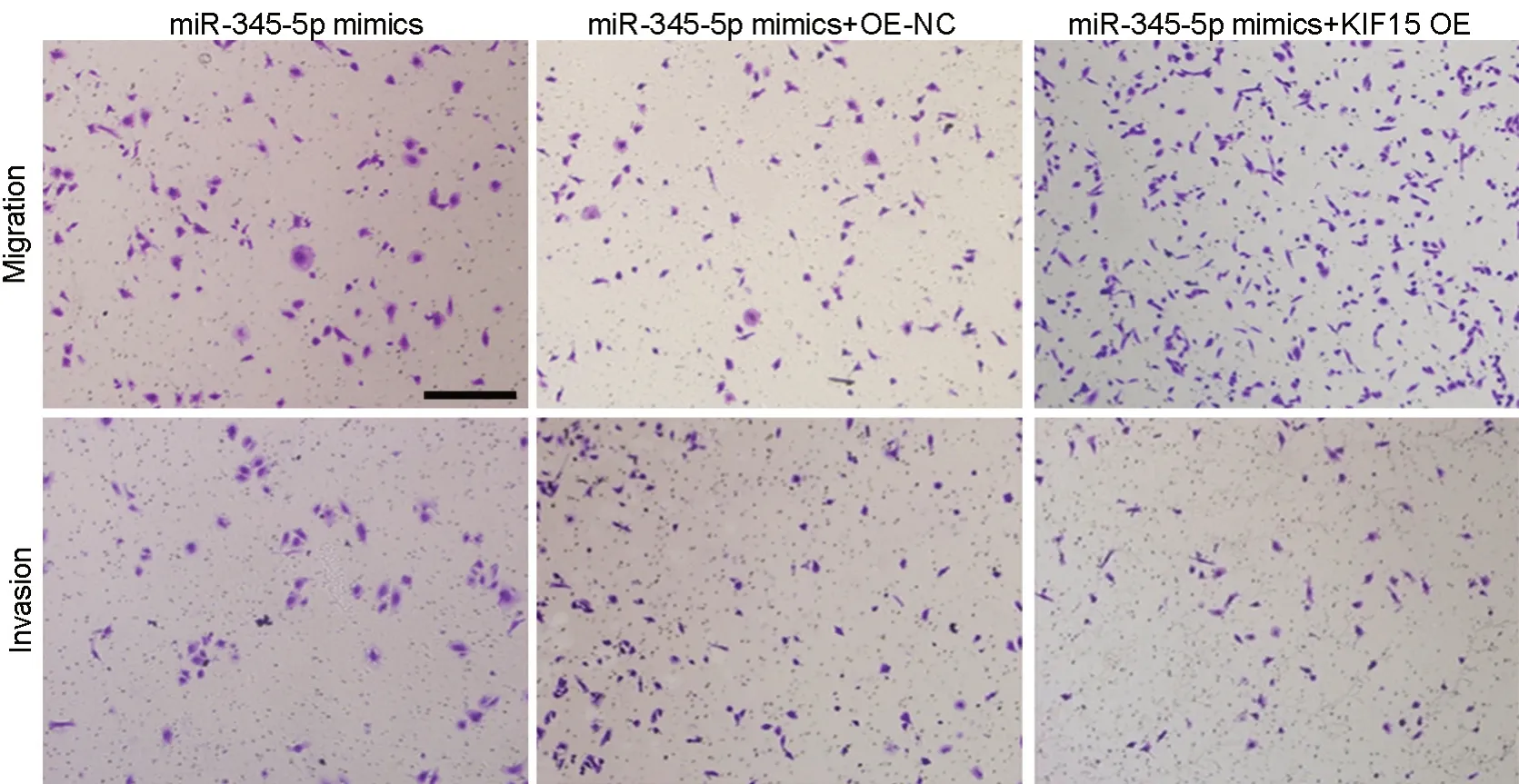
图8 KIF15过表达及上调miR-345-5p对A549细胞迁移及侵袭影响的Transwell实验分析,比例尺,100 µmFig. 8 Transwell assay for effects of KIF15 overexpression and up-regulation of miR-345-5p on migration and invasion of A549 cells. Scale bar, 100 µm
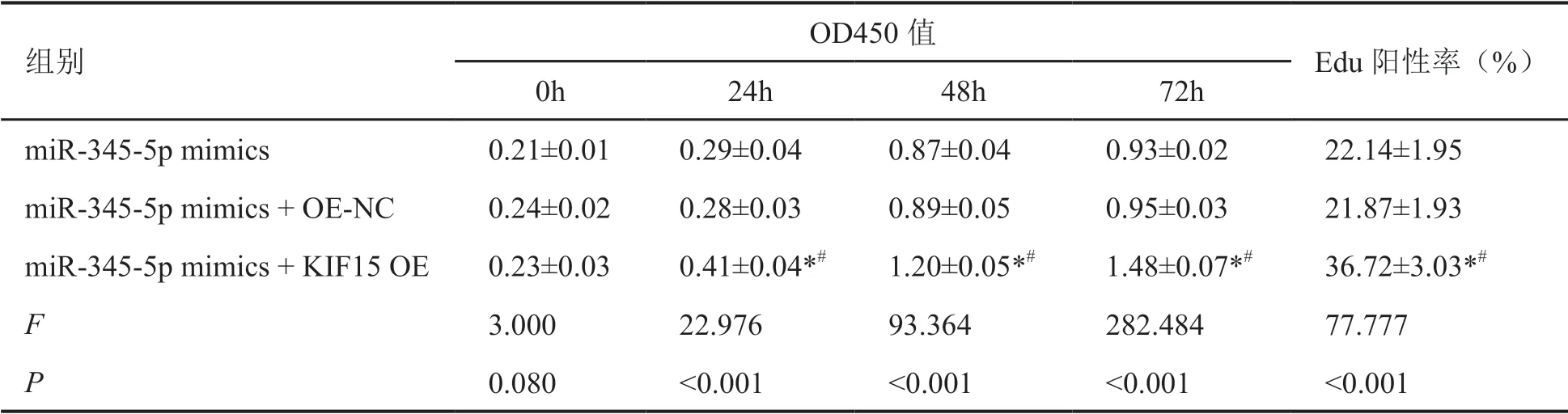
表7 KIF15过表达及上调miR-345-5p对A549细胞增殖的影响Tab. 7 Effects of KIF15 overexpression and up-regulation of miR-345-5p on A549 cell proliferation
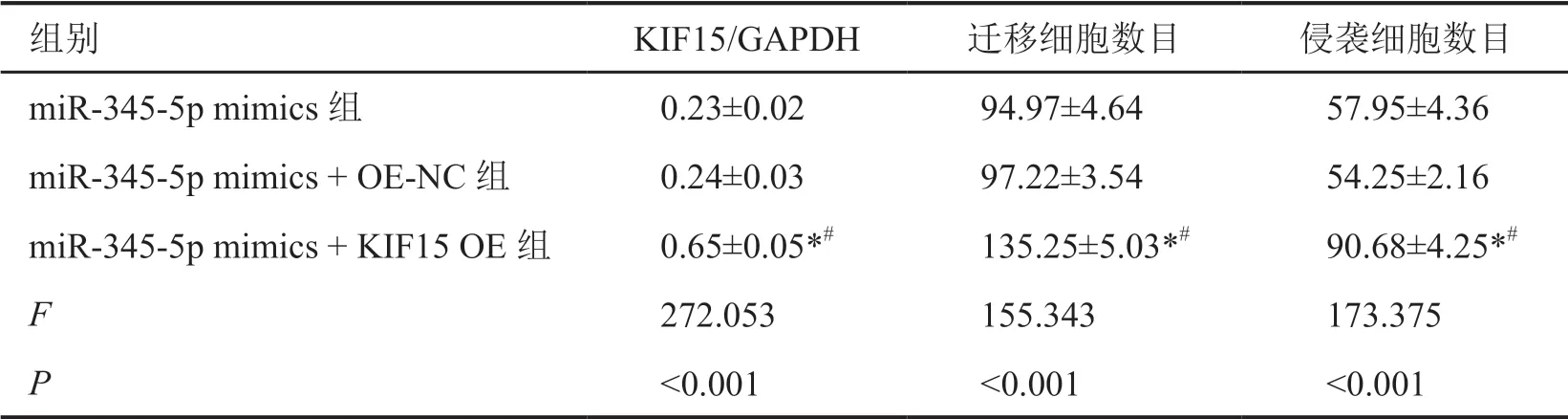
表8 KIF15过表达及上调miR-345-5p对A549细胞中KIF15蛋白、细胞迁移及侵袭的影响Tab. 8 Effects of KIF15 overexpression and up-regulation of miR-345-5p on KIF15 protein, cell migration and invasion in A549 cells
讨论
NSCLC是最常见的恶性肿瘤之一,其在世界范围内的发病率和死亡率均较高。尽管NSCLC的治疗方法在不断改进,但结果仍然较差。肿瘤细胞的增殖、侵袭和转移是阻碍NSCLC治疗的最关键挑战之一[9]。
许多研究表明,miRNA参与了肿瘤增殖、凋亡、迁移、侵袭、血管生成等过程[10]。例如miR-345-5p在胰腺癌组织中呈低表达状态[11],且和胰腺癌患者预后不良相关,这与本研究中miR-345-5p在NSCLC组织中低表达是一致的。另外,相关文献还报道,上调miR-345-5p表达可明显抑制胰腺癌细胞的增殖与转移[11];苦参碱可通过提高miR-345-5p表达水平来抑制肝癌细胞的生长、迁移和侵袭[12];LncRNA DANCR通过调节miR-345-5p/Twist1轴来抑制胆管癌细胞的增殖、迁移、侵袭、血管生成和上皮-间充质转化[13]。由此表明miR-345-5p在肿瘤中具有抑癌基因的作用。PCNA作为评价细胞增殖状态的一个指标,研究表明PCNA在肺癌组织中高表达,并可促进肺癌细胞的增殖[14];Bcl-2可抑制细胞凋亡,促进肿瘤进展[15];MMP-2可降解细胞外基质和基底膜进而促进肿瘤的迁移与侵袭[16];相关研究显示,miR449a过表达可通过抑制PCNA、Bcl-2、MMP-2蛋白表达从而抑制甲状腺乳头状癌细胞的增殖、迁移侵袭,促进细胞凋亡[17]。本研究发现,miR-345-5p在NSCLC组织中低表达,而PCNA、Bcl-2及MMP-2蛋白在NSCLC组织中高表达,提示在NSCLC组织中miR-345-5p的低表达状态可能参与了NSCLC的增殖、迁移与侵袭。本研究在体外细胞水平上检测发现,miR-345-5p在NSCLC细胞A549、NCI-H358、SPC-A-1细胞系中表达水平显著低于正常肺上皮细胞系BEAS-2B,且miR-345-5p在A549细胞系中的表达显著低于其他非小细胞肺癌细胞系,因此,选择A549细胞进行后续实验。本研究结果还表明,上调miR-345-5p可抑制A549细胞增殖、迁移和侵袭。
为了进一步探究miR-345-5p抑制A549细胞增殖、迁移和侵袭的分子机制,本研究通过双荧光素酶报告基因实验证实KIF15是miR-345-5p的靶基因。KIF15是KIF家族的成员,属于驱动蛋白12亚科,对细胞增殖、凋亡有着重要影响[18,19]。据报道,KIF15在乳腺癌组织中高表达,其高表达可能与肿瘤增殖、转移及预后有关[20];KIF15表达与肝癌进展密切相关,其作用机制可能与促进肝癌细胞增殖和侵袭有关[21];KIF15在黑色素瘤的致瘤性中发挥促进作用,其可以作为黑色素瘤的新型诊断分子和治疗靶标[22];KIF15可促进膀胱癌细胞增殖,同时KIF15高表达也是膀胱癌患者预后的独立危险因素[23];沉默KIF15能显着抑制骨肉瘤细胞增殖,集落形成,侵袭和迁移能力[24]。本研究结果表明,KIF15过表达能逆转上调miR-345-5p对A549细胞增殖、迁移及侵袭的抑制作用。
综上所述,miR-345-5p通过靶向KIF15表达,抑制A549细胞增殖,迁移和侵袭能力。这为miR-345-5p在NSCLC转移中的重要作用提供了有说服力的证据,且暗示miR-345-5p可能成为NSCLC治疗中潜在的分子靶标。

