小鼠卵冠丘复合体固定和染色方法比较
王辉,吴光浩,杨云龙,刘俊
(武汉大学1基础医学实验教学中心,2口腔医学院,3第一临床学院,武汉 430071)
哺乳动物优质卵子、受精卵和胚胎是胚胎学、发育生物学及胚胎工程的重要研究对象。超数排卵是获得大量的优质卵子、受精卵的有效方法之一。超数排卵简称超排,是通过外源性促性腺激素刺激哺乳动物雌性个体,使募集的囊状卵泡能同步发育成熟排卵[1],最终获得超过正常水平数倍卵母细胞。目前使用比较广泛的是小鼠超排模型,使用孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)刺激小鼠卵巢超数排卵[2,3]。卵泡发育成熟后排卵,释放出卵冠丘复合体,卵母细胞被透明带和颗粒细胞包裹[4]。卵母细胞是最大的单个细胞,处在单倍体时期。透明带是颗粒细胞与卵母细胞之间一层折光性强的嗜酸性结构,富含糖蛋白,由卵母细胞和颗粒细胞共同分泌[5]。结构疏松的颗粒细胞呈放射状排列在透明带表面形成放射冠。一致认为最佳的卵母细胞形态是由均匀透明带包围的球形结构,具有均匀的半透明细胞质,不含内含物和大小合适的极体[6]。
卵母细胞畸形非常普遍,在去除卵丘细胞后,大约 60%~70%的卵母细胞表现出异常的形态特征[7],形态评估可以很大程度上预测卵细胞的发育能力,当卵冠丘复合体的形态呈现异常时,卵细胞发育能力较差,透明带状态是另外一种对卵细胞发育能力影响很大的胞质外因素[8]。未经任何处理的卵冠丘复合体直接在显微镜下观察,卵母细胞连同周围的透明带和放射冠结构观察不够清晰。本实验以小鼠超排模型为基础,从输卵管壶腹部取卵冠丘复合体,通过不同固定方法和染色方法,寻找最佳的卵母细胞及其周围透明带和放射冠染色方法,便于更加清晰直观观察卵冠丘复合体形态。
材料与方法
1 实验动物
SPF级昆明(KM)小鼠,雌性,30 g,购自武汉大学动物实验中心,动物使用许可证编号SCXK(京)2019-0010。
2 主要试剂
孕马血清促性腺激素PMSG(宁波第二激素厂,110254564),人绒毛膜促性腺激素hCG(宁波第二激素厂,110251282),苏木精染色液(BASO公司,BA-4041),伊红染色液(BASO公司,BA-4024),PAS染色液(BASO公司,BA-4044),Masson染色液(BA-4079),95%乙醇(国药集团化学试剂有限公司,10009164),无水乙醚(国药集团化学试剂有限公司,80059618),丙酮(国药集团化学试剂有限公司,10000418),4%多聚甲醛固定液(Biosharp公司,BL539A)。
3 实验仪器
体视显微镜(尼康SMZ800N),正置显微镜(奥林帕斯BX53F),普通手术剪刀、镊子、眼科剪等手术器械。
4 实验方法
4.1 超排卵
第1 d晚18点对超排组雌性KM小鼠腹腔注射0.2 mL的 50 IU/ml PMSG,空白组雌性KM小鼠腹腔注射0.2 mL生理盐水。48 h后,超排组雌鼠腹腔注射0.2 mL的50 IU/ml hCG,空白组雌鼠腹腔注射同剂量生理盐水。62 h后,颈椎脱臼处死小鼠,体视显微镜下解剖输卵管壶腹部,取卵冠丘复合体。
4.2 卵冠丘复合体固定方法
丙酮固定:丙酮固定5 s,自然挥发。
乙醚-95%乙醇固定:乙醚与95%乙醇液等比例混合(现配现用),固定10 s,自然挥发;
AF液固定:95%乙醇与40%甲醛 按照9:1比例混合,固定10 s,自然挥发;
多聚甲醛固定:4%多聚甲醛固定30 min,PBS冲洗。
4.3 卵冠丘复合体染色方法
HE染色:苏木精染色液染色5 min,水洗,盐酸乙醇脱色5 s,水洗,伊红染色液染色30 s,水洗;95%乙醇Ⅰ脱水2 min,95%乙醇Ⅱ脱水2 min,无水乙醇Ⅰ脱水2 min,无水乙醇Ⅱ脱水2 min;自然晾干后中性树脂封片。
Masson染色:Weigert铁苏木素(A、B液等比例混合)滴染10 min,水洗,1%盐酸乙醇脱色5 s,水洗,丽春红酸性品红溶液染10 min后水洗,磷钼酸溶液处理5 min,苯胺蓝复染5 min,1%冰乙酸溶液冲洗;95%乙醇Ⅰ脱水2 min,95%乙醇Ⅱ脱水2 min,无水乙醇Ⅰ脱水2 min,无水乙醇Ⅱ脱水2 min;自然晾干后中性树脂封片。
PAS染色:高碘酸溶液滴染氧化10 min,蒸馏水冲洗,习夫(schiff)试剂滴染10 min,流水冲洗,苏木素染液滴染2 min,流水冲洗;95%乙醇Ⅰ脱水2 min,95%乙醇Ⅱ脱水2 min,无水乙醇Ⅰ脱水2 min,无水乙醇Ⅱ脱水2 min;自然晾干后中性树脂封片。
结果
1 乙醚-95% 乙醇和4% 多聚甲醛固定卵冠丘复合体效果较好
采用丙酮作为固定剂时,HE染色后观察到卵母细胞四周被大量颗粒细胞包裹着,颗粒细胞数量由近及远递减,呈放射状,卵母细胞体积是颗粒细胞数倍,颗粒细胞多呈紫红色,卵母细胞和颗粒细胞中间现无色透明带,放射冠周边少量浅红色背景(图1A);Masson染色可观察到一个紫红色的细胞团有着蓝色背景,颗粒细胞呈暗红色,无法清楚分辨卵母细胞和透明带(图1B);PAS染色后可以观察到紫红色卵母细胞被蓝色颗粒细胞包裹,卵母细胞与颗粒细胞之间红色透明带,细胞团周围有着浅红色背景(图1C)。
采用乙醚-95%乙醇作为固定剂时,HE染色可观察到紫色细胞团,无法区分卵母细胞、透明带和颗粒细胞(图1D);Masson染色, 中间红色卵母细胞被浅蓝色圆环状透明带包围,大量的红色颗粒细胞分布在外层(图1E);PAS染色显示红色卵母细胞周围一个浅红色圆环,颗粒细胞在淡红色背景下呈放射状排列在外层(图1F)。
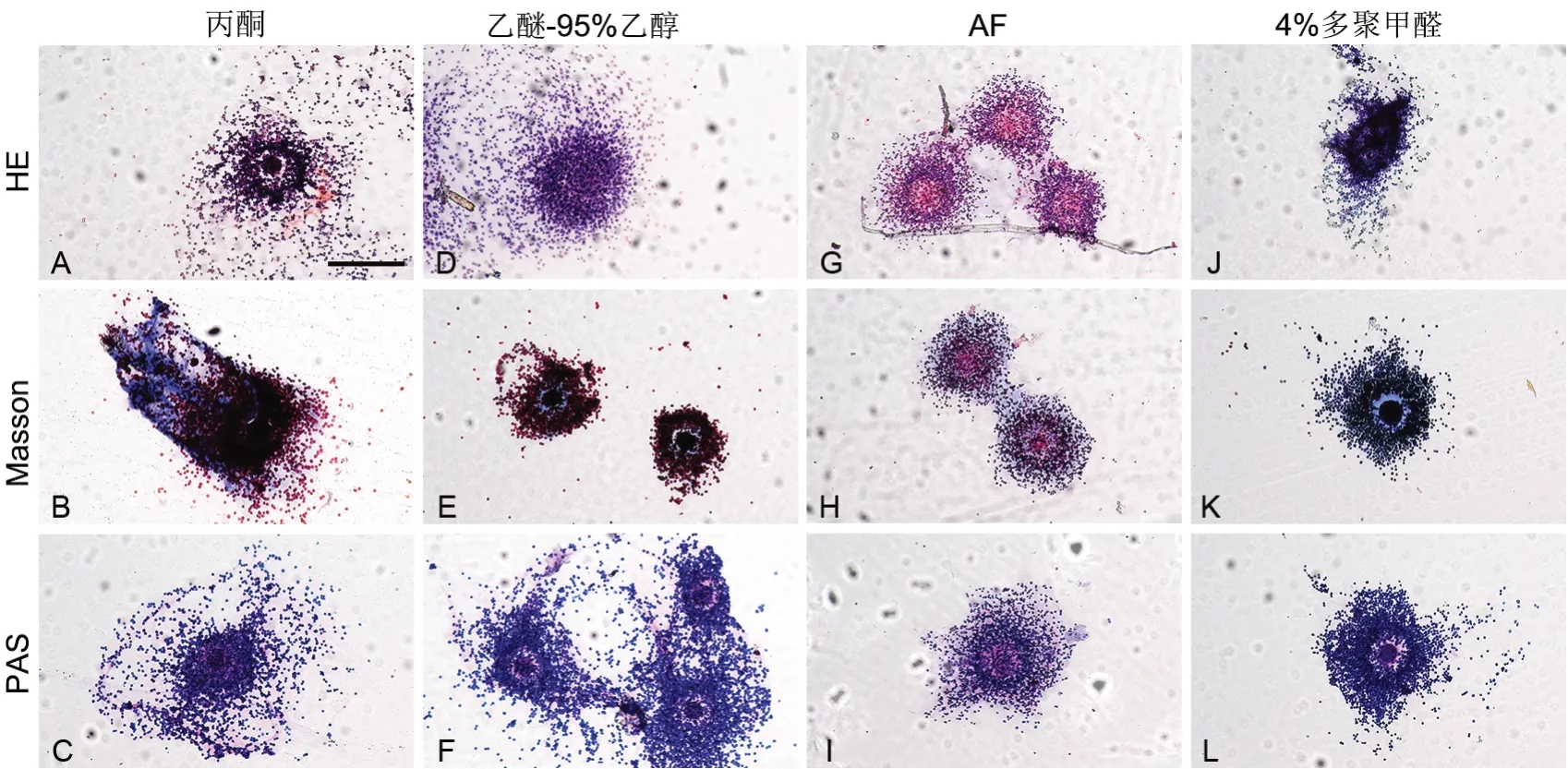
图1 不同方法固定染色卵冠丘复合体效果比较。A,丙酮固定HE染色;B,丙酮固定Masson染色;C,丙酮固定PAS染色;D,乙醚-95%乙醇液固定HE染色;E,乙醚-95%乙醇液固定Masson染色;F,乙醚-95%乙醇液固定PAS染色;G,AF液固定HE染色;H,AF液固定Masson染色;I,AF液固定PAS染色;J,4%多聚甲醛液固定HE染色;K,4%多聚甲醛液固定Masson染色;L,4%多聚甲醛液固定PAS染色。比例尺,100 µmFig. 1 Comparison of the effects for different methods staining of the oocyte-corona-cumulus complex fixed by different fixation methods. A, HE staining after acetone fixation; B, Masson staining after acetone fixation; C, PAS staining after acetone fixation; D, HE staining after ether-95% ethanol fixation; E, Masson staining after ether-95% ethanol fixation; F, PAS staining after ether-95% ethanol fixation; G, HE staining after AF fixation; H, Masson staining after AF fixation; I, PAS staining after AF fixation; J, HE staining after 4% paraformaldehyde fixation; K, Masson staining after 4% paraformaldehyde fixation; L, PAS staining after 4% paraformaldehyde fixation. Scale bar, 100 µm
AF固定液固定时,HE染色显示浅红色卵母细胞形态不清晰,细胞核为蓝色、胞质为红色的颗粒细胞围绕在卵细胞周围呈放射状,无透明带(图1G);Masson染色显示浅蓝色背景下,红色卵母细胞被紫红色颗粒细胞包裹,二者之间存在无色透明圆环空隙,颗粒细胞呈放射状排列(图1H);PAS染色显示红色卵母细胞周围一个浅红色圆环,颗粒细胞在淡红色背景下呈放射状排列在外层(图1I)。
以4%多聚甲醛作为固定剂时,HE染色显示深蓝色细胞团无法区分卵母细胞、颗粒细胞和透明带(图1J);Masson染色显示蓝色卵母细胞周围包裹着淡蓝色圆环,紫红色颗粒细胞呈放射状排列,包裹着卵母细胞和透明带,结构舒展,大量颗粒细胞散在(图1K);PAS染色显示紫红色卵细胞周围一圈红色条带,蓝色颗粒细胞包裹在其周围呈放射状(图1L)。
2 Masson染色和PAS染色对透明带染色效果最佳
乙醚-95%乙醇固定后Masson染色显示,蓝色透明带与卵母细胞融合,但与颗粒细胞边界清晰(图2A)。4%多聚甲醛固定后Masson染色显示,蓝色透明带从卵母细胞到颗粒细胞,颜色由深到浅,且边界清晰,其上出现蓝色放射状细丝(图2B)。乙醚-95%乙醇固定后PAS染色显示,浅红色厚层在卵母细胞和颗粒细胞之间,无清晰界限(图2C)。4%多聚甲醛固定后PAS染色显示,红色条带紧贴在母卵细胞周围,靠近卵泡细胞,颜色变浅,边界模糊,放射状红色细丝(图2D)。
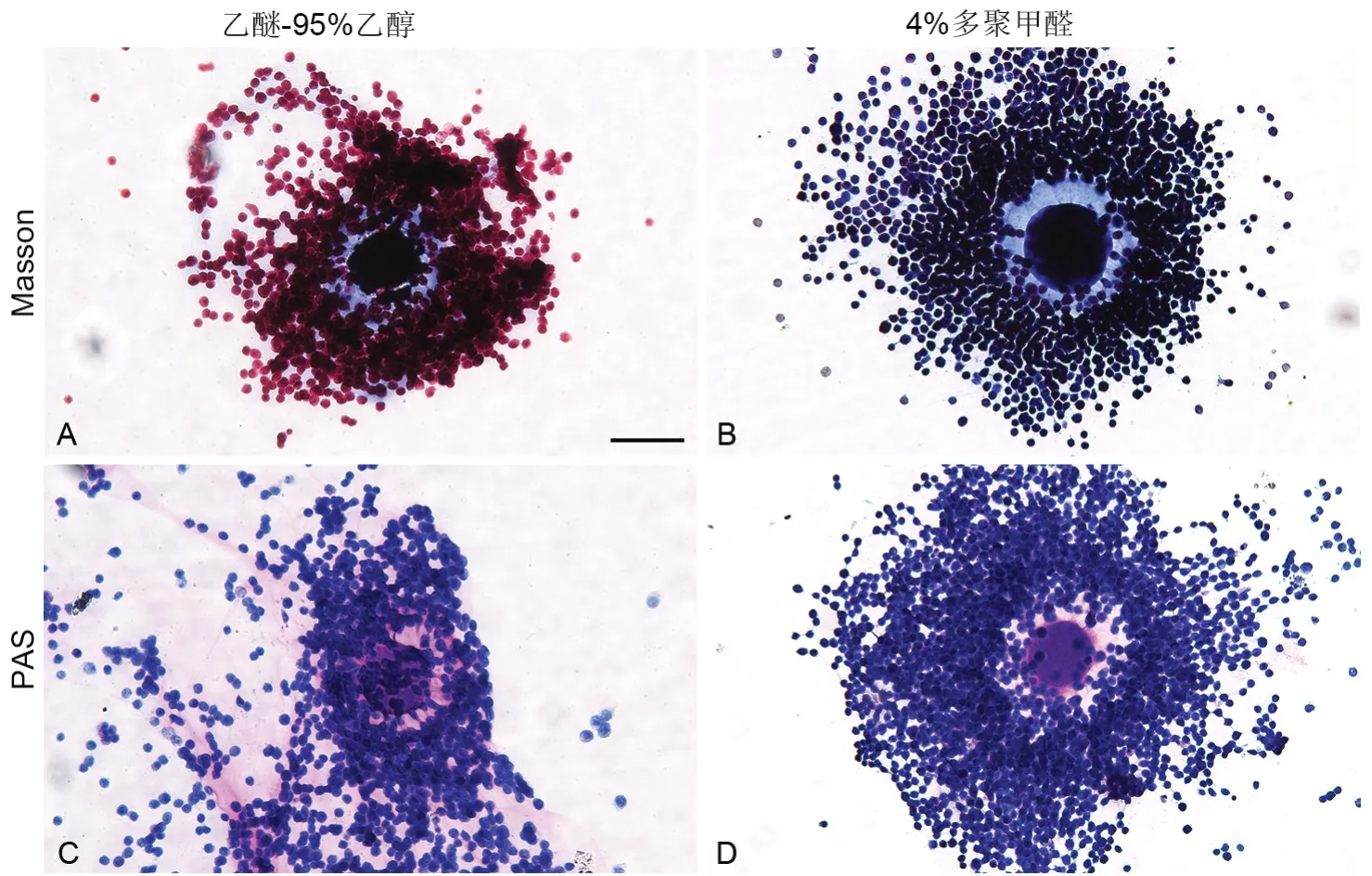
图2 不同方法固定后Masson和PAS染色透明带效果比较。A,乙醚-95%乙醇固定Masson染色;B,4%多聚甲醛液固定Masson染色;C,乙醚-95%乙醇液固定PAS染色;D,4%多聚甲醛液固定PAS染色。比例尺,50 μm Fig. 2 Comparison of the effects of Masson and PAS stained zona pellucida after fixation with different methods. A, Masson staining after ether-95% ethanol fixation; B, Masson staining after 4% paraformaldehyde fixation; C, PAS staining after ether-95% ethanol fixation; D, PAS staining after 4% paraformaldehyde fixation. Scale bar, 50 μm
讨论
1 固定方法比较
甲醛、丙酮、乙醇是目前常用的固定剂。甲醛通过醛基与氨基形成羧基结构,使蛋白质沉淀而进行固定。甲醛穿透能力强,不会使细胞产生收缩反应,固定效果良好,是目前组织学中最常用的固定剂之一。丙酮为无色有机溶剂,渗透能力强,使蛋白质沉淀[9]。乙醇通过对蛋白质脱水变性和沉淀达到固定目的,但是乙醇使组织细胞脱水,且使细胞核出现皱缩现象[10]。乙醇与乙醚按照一定比例混合能弥补单一使用乙醇的缺陷[11]。甲醛与乙醇按照一定比例混合可以减少乙醇对组织脆性的影响[12]。最终选择用丙酮、4%多聚甲醛、乙醚-95%乙醇液混合液和AF液进行固定。
4种固定剂对细胞结构固定效果相差不大,但随着固定剂极性越来越小,对随卵冠丘复合体附带的可溶性的输卵管液体固定效果越来越好,所以丙酮固定后染色后,细胞团均出现不同程度的不同颜色的背景。水溶性4%多聚甲醛固定剂稀释输卵管液,随后在清洗4%多聚甲醛时而被清除,所以无法固定,所以细胞团背景最干净。
2 染色方法比较
苏木素是碱性染料,主要染细胞核,伊红是酸性染料,主要染胞质。由于颗粒细胞胞体小,细胞核与苏木素结合后,胞质染色不明显。透明带未被染色,由于透明带的存在导致染料进入效果较差,影响卵母细胞显色。PAS染液通过染粘液物质中的氨基已糖和游离的己糖基,使粘液物质呈红色,可以使透明带上糖蛋白染色呈红色。4%多聚甲醛固定PAS染色,红色透明带清晰可见,但厚度较窄。乙醚-95%乙醇液混合液固定PAS染色,透明带厚度较宽,但是颜色较浅,不利于观察,所以4%多聚甲醛固定固定效果更好。Masson利用3种阴离子染料分子的大小和组织的渗透性能差异,把不同组织成分显示出来,其中粘液呈蓝色,细胞呈红色,细胞核呈蓝黑色,故而Masson染色能将具有疏松结构的透明带染蓝色而与卵细胞和颗粒细胞区分开来,而且Masson染色透明带厚度较大呈现出来而便于观察[13]。但是乙醚-95%乙醇固定Masson染色,颗粒细胞胞核未染色,而4%多聚甲醛固定Masson染色,颗粒细胞呈蓝紫色,且透明带透光性更好,所以4%多聚甲醛固定固定效果更好。4%多聚甲醛固定固定,与PAS染色相比,Masson染色透明带与卵母细胞和颗粒细胞色差明显,且透明带界限清晰,折光性更强,厚度较大,便于与观察,所以Masson染色比PAS染色效果更好。
综上所述,4%多聚甲醛固定和乙醚-95%乙醇混合固定液固定效果较好,Masson和 PAS染色透明带效果更佳。4%多聚甲醛固定Masson染色效果最佳。

