乳腺癌化疗耐药的分子机制
林慧,吉丽银,符策岗
(1中南大学湘雅医学院附属海口医院乳腺甲状腺血管外科,海口 570208;2上海市第六人民医院海口骨科与糖尿病医院,海口 570000)
乳腺癌是女性最常见的癌症之一,且发病率逐年升高。早期的乳腺癌(肿瘤局限在乳房中或扩散到腋窝淋巴结时)被认为是可以治愈的,在发达国家5年存活率超过85%[1]。遗憾的是,即使近年来新的治疗方法层出不穷,如乳腺癌生物学相关治疗、个性化治疗以及降低和减少化学疗法的不利影响等都对乳腺癌的治疗有一定的帮助,但由于化疗耐药的存在、复发或者发现时乳腺癌已经转移到各种器官,部分患者的5年生存率依然很低(28%)[1]。
1 乳腺癌的分类
乳腺癌的治疗可分为两部分:局部治疗和全身治疗。治疗方式的选择取决于癌症的阶段及其类型,包括分子和组织学分类等。早期乳腺癌(Ⅰ期和Ⅱ期),肿瘤局限于乳腺组织或受感染的局部淋巴结,可以通过乳房切除术和或联合放疗来治愈。乳腺癌细胞表面可存在(也可缺失)以下3种激素受体,包括雌激素受体(estrogen receptor, ER)、孕酮受体(progesterone receptor, PR)和人表皮生长因子-2受体(human epidermal growth factor-2 receptor, HER2)。转移性乳腺癌(metastatic breast cancer, MBC)的治疗方式主要有化疗、激素治疗和靶向治疗。根据癌症的分子性质及其在乳腺癌组织中的起源,Perou和Sorlie[2]在2000年提出根据肿瘤表面受体情况将乳腺癌主要分为4个亚型:①管腔A型(luminal A型),②管腔B型(luminal B型),③基底细胞样型和④HER2型[2]。在临床实践中,通常也根据乳腺癌不同分子和组织学来源进行分类。另一种方法是根据细胞表面是否存在受体进行分类,肿瘤细胞表面存在ER和/或PR受体的乳腺癌称为激素阳性乳腺癌,而另一种情况是肿瘤细胞表面只有HER2受体而缺乏ER和PR受体(即不能通过激素疗法来治疗)被称为HER2阳性乳腺癌;三阴性乳腺癌(triple negative breast cancer, TNBC)既是指肿瘤细胞表面缺乏ER、PR和HER2的表达,这种类型的乳腺癌不能通过激素治疗或HER2靶向治疗,化疗是目前TNBC全身治疗仅有的选择[1]。
2 乳腺癌的病理生理和转移
虽然目前尚未完全阐明乳腺癌发病的确切机制,但是人们对乳腺癌的发生和发展已有一定了解。肿瘤干细胞模型是指通过刺激前体肿瘤干细胞而触发乳腺癌的发生和发展。该理论假设,乳腺癌和肿瘤层次中的细胞多样性由肿瘤干细胞产生[3]。克隆进化模型假设,指的是随机突变以及在基因水平上的克隆选择导致细胞向乳腺癌细胞异质性方向发展[4]。这两种模型之间存在联系,例如乳腺癌肿瘤干细胞可能在克隆进化过程中参生。乳腺癌的发展沿着低级和高级两种途径发展。低级途径的特征是,ER表型和二倍体(或接近二倍体)核型的大多数基因的在表达时发生变化。luminal A型和部分luminal B型就属于这一途径。另一方面,高级通路的特征是基因的改变,包括13q基因的缺失、染色体区-11q13的增加和17q12基因的扩增。17q12基因编码乳腺癌细胞中的HER2,在转移性乳腺癌的细胞增殖和细胞周期维持中均可检测到17q12高水平表达[5]。HER2阳性和TNBC就属于这一途径。在乳腺癌中检测到许多基因要么发生突变或者过表达,要么两者都具备。这些基因有:PIK3CA(30%)、PTEN(16%)、TP53(41%)、CCND1(16%)、ERBB2(13%)和GATA3(10%)[6],它们的共同特点是都参与细胞周期的调节。乳腺癌与许多其他癌症相似,其p53基因被抑制,增加细胞周期蛋白D1表达的基因被激活。此外,在乳腺癌中,HER2、MYC和FGFR1等可抑制癌细胞的凋亡并刺激持续增殖的基因被激活[7]。
晚期乳腺癌可转移到各种器官,包括周围淋巴结、肺、骨、大脑、肝脏和腹腔等。乳腺癌最常见的转移性部位是骨。大约67%的晚期乳腺癌肿瘤转移在骨骼,其中比例较高的是luminal B型(79%)和luminal A型(70%),而HER2和TNBC型(60%)或基底细胞型(40%)比例相对低[1]。此外常见的乳腺癌转移部位是肝、周围淋巴结和肺。近37%的晚期乳腺癌可以分别转移到肝脏和肺,而乳腺癌转移到周围淋巴结的几率为30%~50%。TNBC和HER2的肝转移率比luminal型乳腺癌高,HER2为45%,TNBC为35%。除了TNBC,其他乳腺癌亚型的血管生成和周围淋巴结转移的几率都很高。关于肺转移,luminal A和luminal B转移的几率则较低(25%~30%),而TNBC和HER2向肺转移的几率较高(35%~45%)。当乳腺癌转移到肺、肝和大脑等重要器官时,患者的生存期将明显缩短。研究表明,大约12.6%的癌症会转移到脑组织中,其他不太常见的转移部位有乳腺内侧淋巴结(10%~40%)、对侧乳房(6%)和锁骨上淋巴结(1%~4%)[1](图1)。
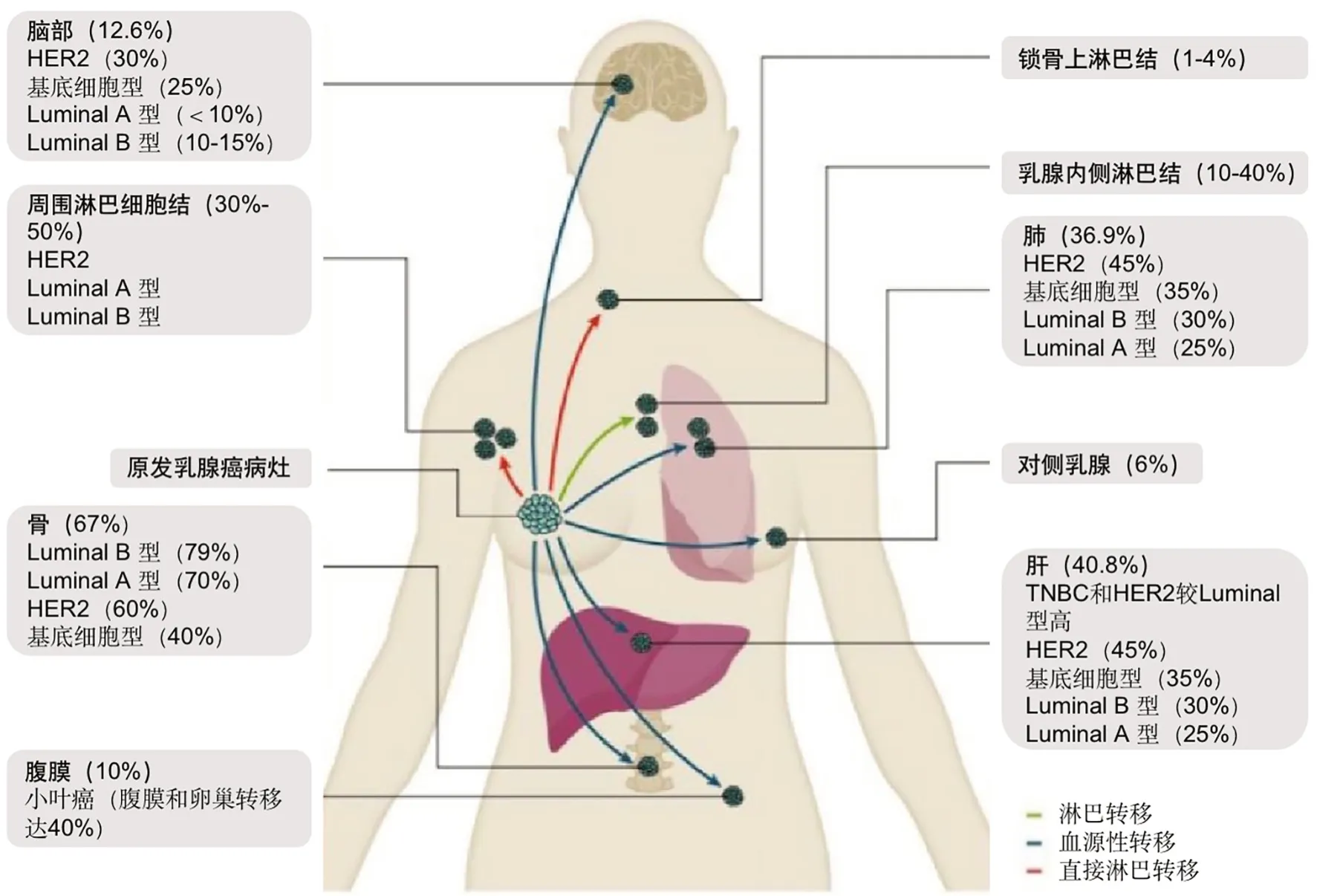
图1 .乳腺癌常见转移部位示意图。 TNBC,三阴性乳腺癌Fig. 1. Common metastatic sites of breast cancer. TNBC, triple negative breast cancer
3 乳腺癌耐药、转移和复发的分子机制
乳腺癌耐药、转移和复发的分子机制主要包括:增加化疗药物的排出,这其中涉及多种蛋白的参与;乳腺癌干细胞的参与;上皮间质转化的存在等。
3.1 增加药物的排出
化疗药物从癌细胞排出会导致药物积累的减少,这是肿瘤细胞化疗耐药的主要原因。药物外排蛋白,也称为外排泵,主要引起癌细胞中的多重耐药性(multidrug resistance, MDR)[8]。药物外排蛋白属于ATP结合盒式(ATP-binding cassette, ABC)转运蛋白超家族,负责通过ATP水解产生的能量运输细胞膜内外的溶质。人类基因组包含48个ABC基因,分为7个亚科(ABCA—G)。其中ABCB1、ABCC1和ABCG2转运蛋白在肿瘤化疗药物治疗过程中MDR的出现发挥重要的作用[9]。药物外排蛋白主要包括:①P-糖蛋白(P-glycoprotein, P-gp),由ABCB1基因编码的ABC亚家族B家族成员1;②乳腺癌耐药蛋白(Breast cancer resistance protein, BCRP),由ABCG2基因和白色亚家族成员编码的ABCG成员2;③多重耐药相关蛋白-1(multidrug resistance associated protein-1, MRP-1),由ABCC2基因编码的ATP结合盒式C家族成员2[10]。图2描述了各种耐药机制,包括MDR的外排泵和其他耐药机制[11]。
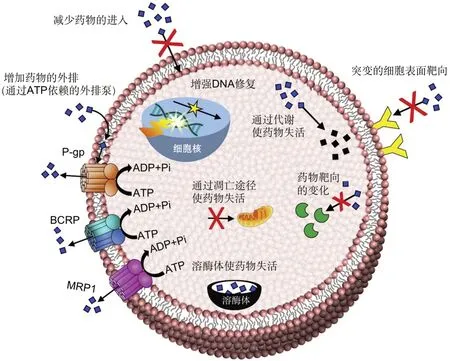
图2 耐药性的产生机制。细胞中的外排转运蛋白(包括P-gp,BCRP和MRP-1)外排药物和其他外源性物质。癌细胞可以通过增加药物代谢酶的表达、改变药物靶点、药物进入溶酶体等方式至使药物失活[11]。Fig. 2 The mechanism of resistance. The efflux transporters (P-gp, BCRP and MRP-1) in cells efflux drugs and other exogenous substances. Cancer cells can inactivate drugs by increasing the expression of drug-metabolizing enzymes, changing drug targets, and drugs entering lysosomes [11].
3.1.1 P-糖蛋白
糖蛋白(P-glycoprotein, P-gp),也称多重耐药蛋白-1(multidrug resistance protein-1, MDR-1)或分化簇243(CD243),是ABC超家族的第一个成员,负责外源物的排出[8]。P-gp由两个半氨基酸和1280个同源氨基酸组成,每一半都由6个疏水跨膜域(transmembrane domains, TMD)组成,具有一个可以水解ATP 的ATP结合位点或核苷酸结合结构域(nucleotide-binding domain, NBD)。ATP结合致转运体构象变化对转运体的功能至关重要[12]。在癌细胞中,P-gp的过度表达导致MDR。P-gp结构上有多个药物结合位点,可结合多种化疗药物,包括阿霉素、依托泊苷、紫杉醇等[13]。在不同类型的癌症中,P-gp的过表达存在差异,结肠、胰腺、肝脏、肾上腺和肾癌的P-gp表达呈最高水平,在软组织癌、神经母细胞瘤和血液恶性肿瘤中呈中等表达,而低水平的表达呈现在乳腺癌、卵巢、肺癌和食道癌中。在肿瘤表现出对化疗耐药性后,P-gp的表达水平增加[14]。
P-gp抑制剂主要阻断P-gp并辅助MDR的逆转,分为第一、第二和第三代药物。第一代药物的效力较低,无选择性且与P-gp结合亲和力较低,需要高剂量才能达到逆转MDR的效果,这同时意味着可能会增加药物毒性。三氟拉嗪、环孢菌素A、维拉帕米、奎尼丁、利血平、他莫昔芬、长春新碱和育亨宾是第一代P-gp抑制剂的代表药[15]。第一代P-gp抑制剂药代动力学和药效学的不足为第二代Pgp抑制剂药物的研发指明了方向。与第一代药物类似,二代药物也是通过阻断P-gp的作用来抑制化疗药物的代谢和排泄。通过修饰第一代P-gp抑制剂的结构,从而更好地实现药理反应、更好的耐受力和低毒性。戊司泊达(PSC833)、维拉帕米、柠檬酸比里科达(VX-710)和右尼古地平是第二代P-gp抑制剂的典型[15]。第二代P-gp抑制剂的一些缺陷,如与细胞色素P4503A4的相互作用影响药物代谢,在第三代药物中被克服。佐舒喹达LY335979、依克立达-GF120918、安那霉素和米托坦(NSC-38721)是第三代P-gp抑制剂的代表药[13]。他立喹达可被视为一种理想的P-gp抑制剂,因其在癌症化疗临床试验中已经证明了P-gp抑制有效性[16]。在II期临床试验(NCT00048633)中,该药物还能有效逆转晚期乳腺癌中的化疗耐药[16]。需要注意的是,尽管第三代P-gp抑制剂取得一些临床效果,但还是会引起药物毒性。Zhong[17]等证明了叶酸靶向纳米红细胞输送可以用来克服乳腺癌体内中的MDR。
3.1.2 乳腺癌耐药蛋白
乳腺癌耐药蛋白(breast cancer resistance protein, BCRP)在一种耐药的人乳腺癌细胞系中首次被发现,当时该细胞系正接受米托蒽醌和P-gp抑制剂(他立喹达)的治疗[14]。BCRP由ABCG2基因编码,是ABC转运体的ABCG亚型,是一个由N端NBD和一个含六个跨膜螺旋的羧基末端TMD组成的半转运蛋白[13]。BCRP在细胞间药物的吸收、代谢、排泄以及毒性中起着重要作用,其还作为一个外排泵,将抗癌药物从乳腺癌细胞输送到细胞外环境中,从而赋予肿瘤细胞MDR。虽然BCRP最初在乳腺癌中被发现,但后续发现其也存在于大多数癌细胞中并引起MDR[13]。蒽环类药物可因在乳腺癌细胞上表达的BCRP而产生耐药性[18]。BCRP除了存在于细胞膜外,也在细胞内的小泡中表达,这些小泡通常是保留药物的,但BCRP很快将药物泵出来,这是导致耐药性增加的另一个原因[19]。BCRP在乳腺癌细胞中高度表达,这些细胞具有干细胞样的特性,大多对化疗耐药。Wiese[20]等报道了BCRP/ABCG2抑制剂的专利,以及这些抑制剂在对抗MDR之外还有其他的作用。在这些抑制剂中,最有前途的是二价类黄酮,与其他类化合物相比,二价类黄酮已经表现出广泛抑制性,二价类黄酮也是BCRP/ABCG2的选择性抑制剂[20]。
3.1.3 多重耐药相关蛋白
多重耐药相关蛋白(multidrug resistance associated protein, MRP)是人类细胞膜转运体的ABC家族的一个成员,已知会引起MDR。该转运蛋白最初在一种小细胞肺癌耐药系H69AR细胞中发现[13]。MRP1转运体由横跨细胞膜的17个TMD组成,负责内源性物质和异源性药物的运输。MRP1在过去20多年里因在各种癌症耐药过程中扮演重要的角色而广受关注。MRP1是一种190 kDa的蛋白,具有一个P-gp转运蛋白,就像一个核心和一个N端TMD[21]。MRP1是一个基底外转运体,能转运化合物进入基膜下面的细胞,并防止药物从基底侧吸收,并清除细胞中的药物[22]。MRP1可以转运谷胱甘肽(glutathione, GSH)、化疗药物和GSH联合化合物[23],提示其转运机制与P-gp存在差异[23]。MRP1在大多数人类组织中广泛表达,也存在于大多数肿瘤中,包括乳腺癌,并在MDR中发挥重要作用。MRP1帮助肿瘤细胞对多种药物产生耐药性,如长春生物碱、蒽环类、喜树碱、依托泊苷、铂化合物、核苷和核苷酸类似物、叶酸抗代谢物和甲氨蝶呤药物等。MRP1不会对大部分紫杉类产生作用,但除了甲氨蝶呤。因此,乳腺癌的复发与肿瘤细胞中MRP1活性的增加密切相关,MRP转运体的药物靶向治疗可帮助克服耐药性的问题[13]。
3.1.4 肺耐药蛋白
肺耐药蛋白(lung resistance protein, LRP)是一种由LRP基因编码的跨膜蛋白,首次在非小细胞肺癌细胞系SW-1573中被发现。该蛋白存在于肿瘤细胞的细胞质和核膜中,并不是转运蛋白ABC超家族的成员[13]。对LRP cDNA的初级序列分析发现,LRP的氨基酸序列与棕色大鼠穹隆蛋白同源87.7%,也被称为主要穹隆蛋白。在不同的真核细胞中,穹隆蛋白广泛分布在核孔复合物中,并形成核复合物的中心塞。在此基础上,穹隆蛋白帮助物质进出核膜的运输。穹隆蛋白可能通过调节药物的核-细胞质运动而在MDR中发挥作用[13]。LRP蛋白在大多数癌症中过表达,导致细胞核中抗癌药物的积累减少。Wood等观察到乳腺癌患者唾液中的LRP浓度明显高于健康女性[24]。与P-gp、BCRP和MDRP类似,LRP也会对生物碱、蒽环类和依托泊苷等化合物产生耐药性。除此之外,LRP还能引起对顺铂和几种非典型的MDR药物的耐药性[25]。
3.2 乳腺癌干细胞
乳腺癌干细胞(breast cancer stem cells, BCSCs)是乳腺癌细胞的一个小亚群,在癌症进展、转移和复发中发挥重要作用。BCSCs与其他乳腺癌细胞不同,它们具有抗化疗和放疗的能力[26]。BCSCs的数量与转移性乳腺癌治疗率和生存率呈负相关[27]。越来越多的研究发现,不同表面标记和信号分子的表达可以作为潜在的治疗靶点。BCSCs促进肿瘤形成的特点是,表面标记CD44的高表达和表面标记CD24低或不表达(CD44+/CD24-)[28];与此同时,上皮细胞粘附分子的表达增强BCSCs转移的潜力[29]。此外,具有醛脱氢酶1(aldehyde dehydrogenase 1, ALDH1)活性的BCSCs已被证明表现出潜在致瘤性,当其被注入裸鼠时,细胞数量低至20就足以满足肿瘤的形成[30]。在乳腺癌组织内,BCSCs(CD44+/CD24-)主要存在于侵袭性边缘,而ALDH1活性升高的BCSCs主要存在于以缺氧为主的内部区域[31]。目前的化疗药物已被证明可以通过两种机制增加BCSCs的数量:①只影响非BCSCs,从而增加BCSCs的比例;②将非BCSCs转化为BCSCs。例如,紫杉醇、卡铂和5-氟尿嘧啶已被证明对非BCSC有效,并增加不同细胞系中的BCSCs(CD44+/CD24-)[32]。(CD44+/CD24-)和ALDH1表型的BCSCs从乳腺癌受体表达(ER、PR和HER2)中分离出的具有相似的基因表达谱。这表明,同种治疗策略可以用来治疗不同乳腺癌亚型中的BCSCs[33]。
各种信号分子和转录因子的表达在BCSCs的转移中起重要作用。Tribbles同源蛋白3是一种由TRIB3基因编码的蛋白质,通过影响FOXO1-AKTSOX2通路,其表达与乳腺癌预后差和BCSCs干性直接相关[34]。在体外模型中,暴露于转化生长因子-β1(transforming growth factor-β1, TGF-β1)可增加乳腺球的数量[35]。其他一些信号通路被证明对BCSCs也很重要,包括激活hedgehog、notch、核因子kappa B(NF-kB)、受体酪氨酸激酶等[36]。因此,BCSCs是治疗乳腺癌的重要决定因素。研究表明,通过影响关键的信号通路和转录因子可以减少BCSCs的数量。例如,VS-4718和VS-6063可通过抑制局部粘附激酶(focal adhesion kinase, FAK)而影响Wnt/β-catenin信号通路。与紫杉醇单独使用相比,与VS-4718或VS-6063联用会减缓由异种移植形成的小鼠肿瘤再生长和转移[37]。Quisinostat是一种组蛋白去乙酰化酶抑制剂,其与阿霉素联合,可协同减少非CSC和BCSC的数量[38]。天然萘醌衍生物白花丹醌可通过调节Wnt/β-catenin信号通路而有效对抗内分泌耐药性乳腺癌中的BCSCs[39]。基酪醇通过靶向Wnt/β-catenin和TGF通路,影响(CD44+/CD24-)和ALDH1的活性从而调节BCSCs。
3.3 上皮间质转化
具有不同表型的BCSCs,包括(CD44+/CD24-)者,已被证实有上皮间质转化(epithelial-mesenchymal transition, EMT)的特征[13]。EMT是一种将极化上皮细胞转化为间充质细胞的过程,其迁移、产生细胞外基质成分和转移的能力有所增强,该过程包括激活多种信号通路和转录因子的[13]。从人乳腺癌细胞中分离出来的(CD44+/CD24-)型BCSCs显示,波形蛋白、E盒结合锌指蛋白1(zinc finger Ebox binding homeobox 1, ZEB1)、ZEB2和基质金属蛋白酶-1的表达较高,这都预示 EMT的出现[33]。
Notch信号通路作为乳腺癌MET的调节剂得到了广泛的研究。Notch信号通路的激活可诱导磷脂酰肌醇3-激酶/蛋白激酶B信号通路的表达,并通过诱导活化NF-κB,在细胞生长和增殖中发挥重要作用[40]。NF-κB通过影响下游效应器,包括MMP-9、VEGF、细胞周期蛋白D1和生存素来促进EMT[40]。
细胞因子在调节EMT中也发挥重要作用。上皮细胞的照射诱导白细胞介素-6的产生,激活JAK/STAT通路,诱导各种下游效应子的表达促进EMT[41]。肿瘤坏死因子α(tumor necrosis factor α, TNF-α)通过诱导Twist1的表达,促进乳腺癌细胞的转移并诱导EMT[42]。转化生长因子β(transforming growth factor β, TGF-β)途径在乳腺癌的EMT中普遍激活。缺氧通常与乳腺癌EMT的启动有关,缺氧通过激活Notch2诱导HES1和HEY1效应子的表达,这些效应子的上调降低电子钙粘蛋白的表达,这是EMT的一个重要特征[43]。缺氧还通过促进环粘蛋白酶-2的表达,影响钙粘蛋白的表达来促进EMT[44]。
4 小结
癌症的耐药机制非常复杂,主要涉及分子修饰、肿瘤微环境(导致血管重建的缺氧条件)和细胞主要修复方式的基因突变(DNA修复的激活、p53突变、凋亡受损)等等。从药物的角度来看,靶向癌细胞中化疗药物的浓度和利用率的降低是化疗的主要障碍。尽管最近出现了许多治疗预措施,但目前癌症化疗是该疾病最常见的治疗方式。但是目前成功的化学治疗往往需要同时服用三到四种药物。化疗对癌症早期的患者有一定的疗效,但由于MDR,癌细胞适应治疗并“阻碍”治疗,往往导致治疗无效和复发[13]。使用多种药物和高浓度的给药,导致人体内化疗药物的毒性大大增加,增强了副作用的程度,以至于患者无法耐受,从而导致许多治疗的失败。目前乳腺癌药物治疗方面有进一步发展希望的是靶向纳米治疗,它克服上述不足,有望成为乳腺癌治疗的突破口。其中值得一提的是,纳米载体技术可以发挥保护化疗药物免受系统降解、增加在肿瘤部位的药物浓度、防止肿瘤细胞外排等作用,应用在乳腺癌的治疗取得一定的成果[44-47]。

