血管周围间隙扩散张量成像指数在评估帕金森病患者脑类淋巴系统功能中的价值
陈阿梅,温金玉,黄俊祥,成小芳,阮秀杭,方美娥,魏新华
帕金森病(Parkinson′s disease,PD)是一种常见的神经退行性疾病[1],其主要病理特征为中脑黑质多巴胺能神经元变性及黑质残存神经元胞质内出现路易小体,其中路易小体的形成是由于α突触核蛋白(α-α-synuclein,α-syn)的产生和清除不平衡导致异常蛋白沉积所致[2-3]。
一直以来,学术界认为中枢神经系统缺乏淋巴系统。2012年Iliff等[4]在小鼠中首次证实了中枢神经系统中也有类似淋巴管的结构存在,并将其命名为类淋巴系统或胶质淋巴系统(glymphatic system)。其后的研究进一步证实了胶质细胞终足上的一些水通道蛋白(aquaporin,AQP)介导了脑实质与血管周围间隙之间的液体交换和物质清除[5-6]。然而,包括钆对比剂在内的示踪剂鞘内注射为有创性检查方法,因此,建立一种非侵入性的方法来评估人类的类淋巴系统具有重要意义。
近年来,MRI已逐渐被应用于无创性评估脑类淋巴系统[7]。Taoka等[8]提出了一种新的非侵入性方法——血管周围间隙扩散张量成像分析(diffusion tensor image analysis along the perivascular space, DTI-ALPS)来评估人脑的类淋巴系统的功能。随后,此方法被应用于痴呆、特发性快动眼睡眠障碍和2型糖尿病等多种疾病[9-11]。但至今仅有少数几项研究中使用DTI-ALPS方法来评估PD患者类淋巴系统的活性[12-13],且均为小样本研究,研究结果尚待进一步证实。本研究利用PD相关数据库中的DTI图像,通过计算血管周围间隙扩散指数(ALPS-index)来评估类淋巴系统的功能,并分析此指数与PD患者疾病严重程度、临床指标及脑脊液生物标志物的相关性,旨在进一步探讨类淋巴系统在PD发病机制中的作用。
材料与方法
1.病例资料
将153例PD患者和59例健康志愿者(health control,HC)纳入本研究。所有受试者的MRI和临床数据来自于帕金森病进展标记物研究项目(Parkinson′s Progression Markers Initiative,PPMI)数据库(www.ppmi-info.org/data),其中PD组纳入的是新诊断和未接受治疗的PD患者的基线数据。PPMI数据库为多中心纵向数据库,每个PPMI中心的此项研究获得其相应的伦理委员会的审核批准,所有受试者在参与本计划前签署了书面知情同书。
所有受试者有完整的MRI资料(包括3D T1WI和DTI)及脑脊液生物标志物[包括β淀粉样蛋白(amyloid-β,Aβ)42、α-突触核蛋白(α-synuclein,α-syn)、总tau蛋白(total tau protein,t-tau)、磷酸化tau蛋白(phosphorylated tau protein,p-tau)]检测结果。每例被试接受多种认知和运动测试量表的评估以全面分析神经心理状况,主要包括霍普金斯语言学习测试(Hopkins Verbal Learning Test,HVLT)(包含即刻/总回忆测试、辨别记忆测试、维持记忆测试)、蒙特利尔认知功能评估(Montreal Cognitive Assessment,MoCA)、状态-特质焦虑问卷(State-Trait Anxiety Inventory,STAI)、 老年抑郁量表(The Geriatric Depression Scale,GDS)、宾夕法尼亚大学嗅觉识别测试(University of Pennsylvania Smell Identification Test,UPSIT)、统一帕金森病分级量表(Unified Parkinson′s Disease Rating Scale,UPDRS)第1~3部分和全部(total)、以及H-Y分级量表(Hoehn and Yahr stages)。
2.检查方法
使用Siemens MAGNETOM Skyra 3.0T MRI扫描仪。扫描序列及参数如下。①DTI: TE 88 ms,TR 500~9000 ms,体素大小2.0 mm×2.0 mm×2.0 mm,采集矩阵1044×1044,层数72,采集了b=0 s/mm2和64个扩散敏感梯度方向的b=1000 s/mm2图像;②3D-T1WI:TE 2.98 ms,TR 2300.00 ms,体素大小1.0 mm×1.0 mm×1.0 mm,采集矩阵240×256。采集参数和详细协议可在PPMI网站上获得。参与PPMI项目的每个研究中心的工作人员均接受了培训,以确保MRI数据的标准化采集。在随后的数据分析中,剔除了数据缺失的受试者。
3.图像后处理和评价
所有MRI图像由两位有多年神经影像学诊断经验的放射科医师分别进行评估,他们不了解每例患者的临床信息,如两者的意见不同则请第3位副主任及以上放射科医师共同协商确定。
基于DTI数据,使用FSL软件生成扩散张量图像,包括彩色编码的各向异性分数(fractional anisotropy,FA)图和扩散率(diffusivity,D)图。基于每帧扩散率图像(FSL软件自动生成),可分别获得X、Y和Z轴方向上的扩散率。由于在侧脑室体部层面上,血管周围间隙(perivascular space,PVS)的方向垂直于侧脑室壁(多为左右方向/X轴方向),该方向也垂直于投射(projection)纤维(主要为Z轴方向)及联合(asso-ciation)纤维的方向(主要为Y轴方向),因此,投射和联合纤维沿X轴方向的扩散率至少部分代表沿PVS方向的扩散率。在FA伪彩图侧脑室体部层面,于左半球(所有受试者为右利手)的投射纤维、联合纤维 和皮层下纤维区域分别勾画一个直径为5 mm的ROI(图1a),可分别获得每种纤维在X轴、Y轴和Z轴方向上的扩散率(图1b)。
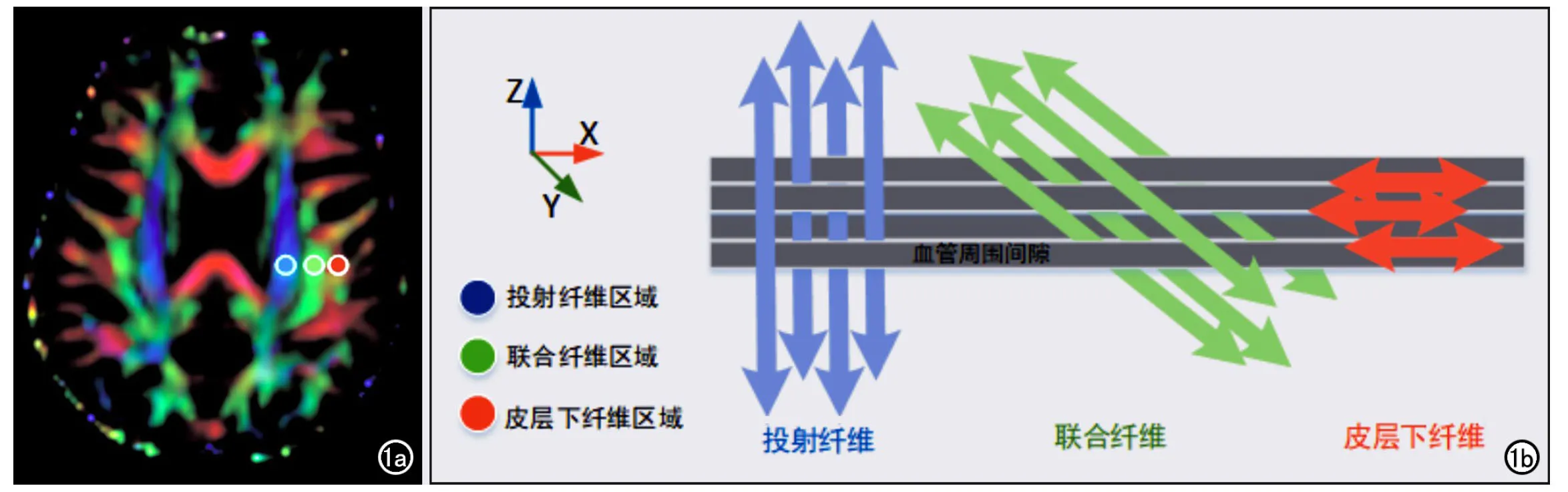
图1 侧脑室体部层面3种神经纤维走行示意图[8]。a)各向异性分数(FA)伪彩图显示了3种纤维的走行方向,投射纤维为Z轴方向(蓝色),联合纤维(绿色)为Y轴方向,皮层下纤维(红色)为X轴方向,在3种纤维内分别放置1个直径为5mm的ROI来测量其扩散系数; b)图中为血管周围间隙的方向(灰柱)与3种神经纤维走向的关系,血管周围间隙的方向垂直于投射纤维和联合纤维。
使用Image J图像处理工具,通过计算ALPS指数来评估类淋巴系统的功能。根据Taoka等[8]的研究,该指标由4个扩散系数值的比值所得,计算公式如下:
(1)
其中Dxxproj和Dxxassoc分别为投射纤维和联合纤维的Dxx值(Dxx表示在X轴方向上的扩散率),Dyyproj为投射纤维在Y轴方向上的扩散率,Dzzassoc为联合纤维在Z轴方向上的扩散率。
4.统计学分析
使用SPSS 23.0软件对2组受试者的人口统计学及临床量表评分进行统计分析。计量资料先进行正态性检验,符合正态分布的资料以均数±标准差表示,计数资料采用构成比(百分率)表示。连续变量的组间比较采用独立样本t检验或非参数秩和检验(Mann-WhitneyU),分类变量的组间比较采用卡方检验。采用Pearson或Spearman相关分析对PD患者的DTI-ALPS指数与年龄、性别及受教育年限的相关性进行分析,控制年龄和性别因素后,采用Pearson偏相关分析对PD患者的DTI-ALPS指数与临床量表评分及脑脊液生物标记物之间的相关性进行检验。采用双侧检验,以P<0.05为差异有统计学意义。
结 果
PD组和HC组的临床特征及组间比较结果见表1。两组间年龄、性别构成比及受教育年限的差异均无统计学意义(P>0.05)。PD组的STAI评分高于HC组(P=0.04),而两组的HVLT、MoCA、GDS和UPSIT评分的差异均无统计学意义(P>0.05)。两组的Aβ42、a-syn、t-tau和p-tau浓度及t-tau/Aβ42、p-tau/Aβ42的差异均无统计学意义(P>0.05)。
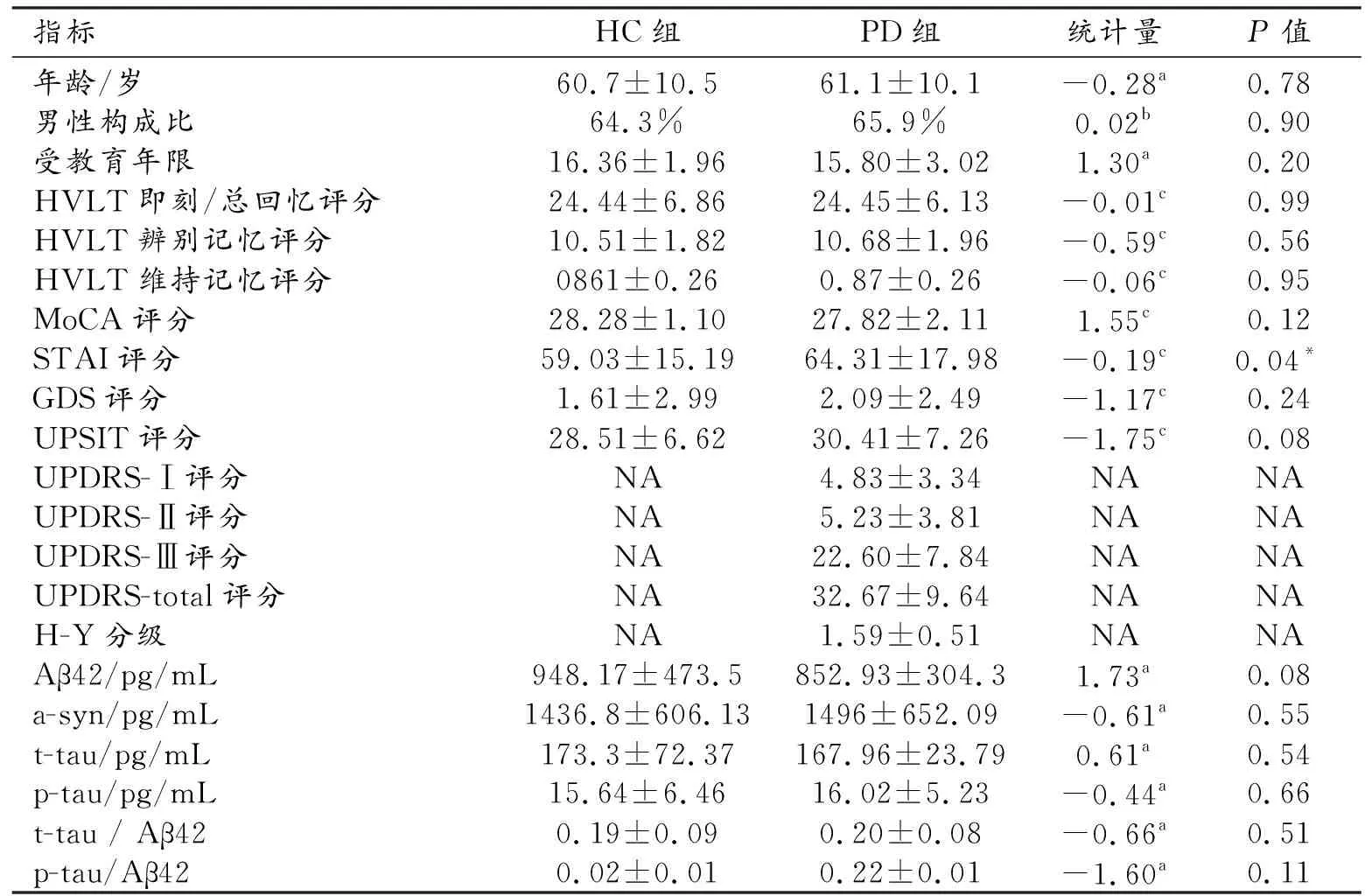
表1 PD组和HC组的临床特征及组间比较结果
HC组和PD组的ALPS指数平均值分别为1.508±0.316和1.389±0.218。与HC组比较,PD组的ALPS指数值明显减低,组间差异有统计学意义(Z=3.769,P<0.001)。
相关性分析结果:PD组中,ALPS指数值与UPDRS-Ⅲ评分呈显著负相关(r=-0.245,P=0.002;图2a),与年龄呈显著负相关(r=-0.256,P=0.001;图2b),与脑脊液p-tau浓度呈显著负相关(r=-0.357,P<0.001;图2c),与性别、受教育年限、HVLT评分(即刻/总回忆评分、辨别记忆评分、维持记忆评分)、MoCA评分、UPDRS-Ⅰ评分、UPDRS-Ⅱ评分、UPDRS-Ⅲ评分、UPDRS总分及H-Y分级均无显著者相关性(P>0.05),与Aβ42、a-syn和t-tau浓度及Aβ42/t-tau、Aβ42/p-tau均无显著相关性(P>0.05)。
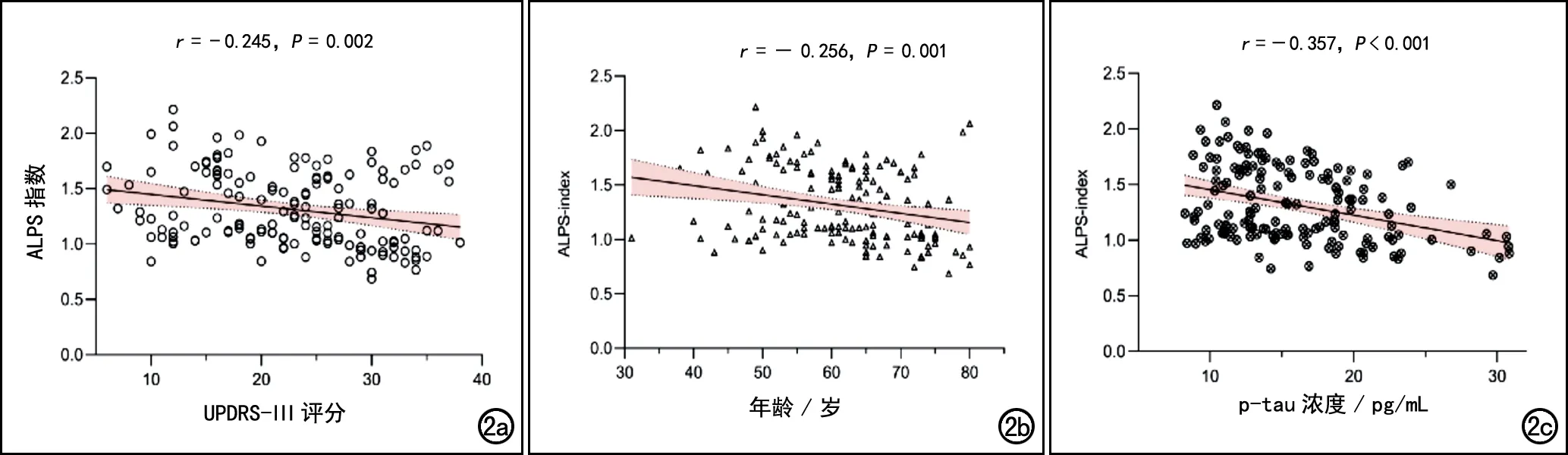
图2 相关性分析散点图。a)PD组ALPS指数值与UPDRS-Ⅲ评分呈显著负相关;b)PD组ALPS指数值与年龄呈负相关;c)PD组ALPS指数值与脑脊液p-tau浓度呈负相关。
讨 论
脑类淋巴系统是最近发现的大脑废物排泄系统[4,14]。脑脊液(cerebrospinal fluid,CSF)沿大脑表面动脉及穿支小动脉走行的血管周围间隙(paravascular space)流入脑实质,并在此与间质液(interstitial fluid,ISF)进行交换,然后CSF/ISF混合液流出至静脉的血管周围间隙并最终流出大脑。其中,血管周围间隙是由内侧的动脉血管平滑肌细胞和外侧的血管周围星形胶质细胞终足构成。而终足上的一些水通道蛋白(aquaporin,AQP),如AQP4,介导脑实质与血管周围间隙的液体交换。
有研究显示脑类淋巴系统促进β淀粉样蛋白等可溶性蛋白的排出,促进葡萄糖、脂质、氨基酸和神经调质的分布[14]。Iliff等[4]首次使用双光子显微镜对在小鼠体内对类淋巴系统的动力学进行了示踪研究,将荧光示踪剂注入枕大池后,发现脑脊液沿着皮层动脉迅速进入大脑实质。除了荧光材料外,在后续的动物研究中钆对比剂被用作示踪剂,经鞘内注射后,也可显示类淋巴系统的动力学[15]。但上述方法均为侵入性手段。
2017年Taoka等[8]提出了一种非侵入性方法——沿血管周围间隙扩散张量成像分析(DTI-ALPS)来评估人脑类淋巴系统的活动。这种方法基于扩散张量成像,通过测量扩散率来评估水分子在血管周围间隙不同方向上的运动。在侧脑室体部水平,髓静脉垂直于侧脑室壁,血管周围间隙与髓静脉方向一致,为左右方向(X轴);投射纤维在侧脑室旁沿头-足方向走行,联合纤维中的上纵向束(uperior longitudinal fascles,SLFs)在投射纤维外侧沿前-后方向走行,皮层下纤维主要在皮层下区域沿左-右方向走行。因此,在这个区域,血管周围间隙垂直于投射纤维和联合纤维,当观察到投射纤维或联合纤维的扩散率发生变化时,可以推断这种变化有一部分原因来自于血管周围间隙(即类淋巴系统)的病理变化。
既往的研究中已观察在一些神经退行性疾病的患者中,脑组织中的蛋白质废物的清除减少[16]。Taoka等[8]报道伴有轻度认知障碍的阿尔茨海默病患者的ALPS指数值下降,有可能是由于脑脊液中的Aβ异常沉积抑制了类淋巴系统的运输功能。然而,支持帕金森病患者存在类淋巴系统功能障碍的研究相对较少。Zou等[17]发现A53T小鼠PD模型的类淋巴系统功能出现减退,免疫荧光检查显示AQP4主要分布在α-syn阳性的神经元周围,提示类淋巴系统AQP4的异常分布与α-syn沉积有关。为进一步探讨AQP4对α-syn的清除作用,该团队研究人员比较了AQP4基因敲除小鼠和野生型小鼠类淋巴系统的清除效率,结果表明AQP4的缺失会降低α-syn在脑内的清除速率,说明a-syn的清除速率降低与类淋巴系统的功能障碍密切相关,这可能是PD发生的一个促进因素。Ma等[18]根据HY分期,将PD患者分为早期和晚期2组,结果显示PD患者的ALPS指数值低于HC组,尤其是因晚期PD组的ALPS指数值显著低于HC组(P=0.006)。在本研究中,PD组ALPS指数值明显低于HC组,与上述研究结果一致,进一步证实了DTI-ALPS指数值降低所反映的类淋巴系统功能障碍可能参与了PD的发病机制。
本研究结果显示PD组的DTI-ALPS指数值与年龄呈负相关,提示在类淋巴系统功能的下降中患者年龄可能也是影响因素。既往有研究结果表明,在大脑衰老过程中,高血压和AQP-4水通道蛋白的丢失可能会影响局部间质内液体的引流,并影响α-syn的清除,其中血管周围间隙是一个重要的通路[19]。另外,有证据表明,类淋巴通路循环是由动脉搏动、血管慢速运动、呼吸运动和脑脊液压力等多种因素驱动的[16]。随着年龄增大,动脉粥样硬化导致的动脉搏动减弱有可能降低类淋巴系统活性、影响代谢产物及异常蛋白的清除[20]。 Ma等[18]的研究结果显示,PD晚期组的ALPS指数值与年龄呈负相关,与我们的结果一致。但年龄是否为类淋巴系统功能降低的独立危险因子,尚需排除其他混杂因素进一步证实。
目前尚无DTI-ALPS指数值与UPDRS评分相关的直接证据,但另一项来自PPMI数据库的研究结果显示左侧基底节的血管周围间隙负担与MDS-UPDRS III评分存在显著相关性[21]。本研究中,校正年龄及性别因素后,DTI-ALPS指数值与MDS-UPDRS-Ⅲ评分呈显著负相关,提示DTI-ALPS指数可以反映PD患者运动症状的严重程度和进展情况。前期多项研究结果显示ALPS指数值与认知水平相关,如Chen等[12]对25例认知功能正常的PD患者、25例伴有轻度认知功能障碍的PD患者和38例伴有痴呆的PD患者以及47例健康对照者进行对照研究,结果显示轻度认知功能障碍的PD患者PD-MCI组和伴有痴呆的PD患者的ALPS指数值明显低于正常对照组。另一项研究在校正了年龄、性别后建立单变量一般线性模型,亦显示认知功能正常组与AD组(P<0.026)和轻度认知障碍组(P<0.025)的DTI-ALPS指数值有显著差异。然而,本研究中DTI-ALPS指数值与MoCA基线评分无显著相关性(P>0.05),分析原因有可能是本研究中纳入的均为初始诊断为PD的患者,因此大部分患者的认知功能尚无明显下降,不能代表全部PD患者群体。
tau是一种微管相关蛋白,在一些神经退行性疾病中其可能被释放到细胞外空间。α-synuclein可以加速tau的磷酸化,tau可破坏轴突运输,并导致细胞内α-syn的进一步聚集[22]。p-tau被认为比总tau更有害,在阿尔茨海默病患者中发现了其浓度明显升高[23]。尽管存在这些机制联系,但几项关于脑脊液tau蛋白在PD病理进程中作用的研究得出了相互矛盾的结果[24-25]。本研究在校正年龄、性别及受教育年限后,观察到PD患者的DTI-ALPS指数与脑脊液p-tau浓度呈显著负相关,在近期的一项研究中通过路径分析证实脑脊液内的tau部分介导了血管周围间隙对PD患者认知结局的影响[21],但其在PD发病机制中的作用仍需进一步研究。
本研究有以下几点局限性。首先,我们的方法只能计算X、Y、Z轴三个方向上的扩散率,因此,在血管周围间隙不沿X、Y或Z轴方向走行的区域,或血管周围间隙与主导纤维束方向平行的区域,不能进行独立评估;第二,ROI是人工放置的,可能有存在主观因素导致的偏倚;第三,我们没有考虑任何其它生理因素的影响,包括脑血流灌注或脑脊液搏动等,但本研究中使用高b值(b=1000 s/mm2)DTI,可以部分抵消生理状态的影响;最后,本研究为横断面研究,尚需在今后进行纵向研究,进一步探讨类淋巴系统功能在帕金森病进展过程中的时间变化轨迹。
总之,本研究结果显示,PD患者的DTI-ALPS指数值明显低于正常对照组,并且与疾病严重程度、年龄增长和脑脊液p-tau浓度呈显著正相关,提示DTI-ALPS指数可以反映脑类淋巴系统活性,并有可能成为诊断和监测PD进展的潜在神经影像学标志物。

