cTTE+隐源性卒中患者临床特征及影像学分析
李 达, 李 利, 刘晓霞, 周 敏, 范振毅
隐源性卒中(cryptogenetic stroke,CS)是指经过标准评估或标准评估+高级评估后仍不能确定卒中病因,即可诊断为CS,在所有缺血性卒中中占20%-40%[1]。研究显示近2/3最初诊断为CS的患者被发现有潜在的心源性栓塞的证据[2],栓塞可源自近端动脉源、心脏或静脉源(具有从右到左的分流)。近年来发现一些疾病导致的反常栓塞(paradoxical embolism,PE)可能是隐源性卒中的重要病因之一[3],PE指患者的静脉血栓通过右向左分流(fight to left shunt,RLS)的通道从右心进入左心,造成大循环的动脉栓塞,卵圆孔未闭(patent foramen ovale,PFO)引起的RLS与CS风险增加相关。cTTE是一项特殊的心脏超声检查方法,是传统心脏影像学的补充,对于诊断或排除心内或肺内RLS性疾病具有重要价值[4,5],但cTTE对CS病因分类的作用有多大,目前尚不清楚,因此我们通过比较cTTE+的CS患者临床资料、神经影像学资料和实验室检查结果,分析cTTE+与cTTE-患者之间性别、发病年龄、发病症状等临床特征的关系,探索RLS数量与CS发病之间的关系,为cTTE在CS病因分类诊断与病情评估提供依据。
1 资料和方法
1.1 研究对象 回顾性收集2020年8月至2022年5月在我院门诊及住院的完成cTTE检查的CS患者108例。纳入标准:(1)所有患者均接受了标准的病原学诊断实验室检查,包括血常规、血糖、糖化血红蛋白、同型半胱氨酸、叶酸、维生素B12、心电图/动态心电图、胸部CT、下肢动静脉B超、经胸超声心动图(TTE)、右心声学造影、脑核磁共振成像包括T1序列、T2序列、弥散加权成像(DWI)序列、液体衰减反转恢复(FLAIR)序列、颅内血管造影(数字减影血管造影/计算机断层血管造影/磁共振血管造影)。(2)根据急性卒中Org 10172治疗试验(Trial of Org 10172 in Acute Stroke Treament,TOAST)卒中分型归类为CS;(3)临床资料、影像学资料记录完整。排除标准:(1)不能配合完成所有检查者;(2)颅内外动脉狭窄或闭塞性病变者;(3)合并二尖瓣病变、房颤、心脏黏液瘤及附壁血栓者。该研究已得到本院伦理委员会审核批准(PJ-NBEY-KY-2021-020-01)。
1.2 cTTE检查方法 采用手振生理盐水法,方法如下:取两支10 ml注射器,一支抽取9 ml生理盐水和1 ml空气,通过三通开关将两支注射器相连,来回快速推注30次,使生理盐水和空气充分混合成含细小微泡的乳白色混合液,经右肘正中静脉快速推入。经胸右心声学造影选取胸骨旁四腔心切面和心尖四腔心切面,观察造影剂在心脏显影情况。观察两组是否存在cTTE阳性,诊断标准为4个心动周期内左心发现微泡作为心脏水平分流阳性[6],4个以上心动周期发现左心微泡作为心外分流阳性[7]。在静止时即检测到微气泡为永久RLS;静止时未检测到气泡,只有在valsalva动作或咳嗽后才会检测到微气泡为隐性RLS。选取微气泡最多的切面评定RLS分级,结果判定如下:无RLS微气泡信号为阴性;左心房内可见1~10个微气泡/帧图像为少量RLS,记为1级;左心房内可见11-30个微气泡/帧图像为中量RLS,记为2级;左心房内可见>30个微气泡/帧图像或左心房内几乎充满微气泡为大量RLS,记为3级。
1.3 观察指标 a:针对所有入组的患者,收集患者的一般资料,包括年龄、性别、脑血管病危险因素、发病症状、体征、个人史、既往史等基础信息。将年龄<50岁的患者纳入青壮年患者组,年龄≥50岁的患者纳入中老年患者组。b:采用美国国立卫生研究院卒中量表(NIHSS)评分、改良Rankin量表(mRS)评价患者神经功能缺损的严重程度。c:采集患者心率、左心房直径以及脑磁共振弥散加权成像上脑梗死灶的梗死类型(数量、分布、大小)。

2 结 果
2.1 cTTE的分流情况 108例CS患者中,cTTE+组43例,阳性率为39.8%,其中男30例(69.8%),女13例(30.2%),年龄(52.8±17.5)岁;cTTE-组65例。cTTE+组中,永久性RLS 19例(44.2%),隐性RLS 24例(55.8%),RLS 1级分流21例,2级分流12例,3级分流10例。阳性组发现4例心外分流,有2例经手术证实为肺小动静脉瘘。
2.2 两组患者临床资料比较 两组患者的性别、合并原发性高血压病、冠心病、糖尿病及既往脑卒中的比例、24 h NIHSS评分、发病后mRS评分、糖化血红蛋白、叶酸、维生素B12、同型半胱氨酸水平、心率、心脏超声估测的左心房内径参数之间差异均无统计学意义(P>0.05)。两组患者中,cTTE+组青壮年比率更高(P=0.021),发病时非特异性症状发生率更高(P=0.008),阴性组以典型症状为主,吸烟个人史的比率更高(P=0.012),差异均有统计学意义(见表1)。

表1 两组患者的临床和影像学特征的比较
2.3 两组患者影像学资料比较 cTTE+组脑梗死病灶累及多血管区域的比例(44.2%)显著高于cTTE-组(15.4%,P=0.004),且多表现为多血管支配的多发梗死灶,同时cTTE+组脑梗死病灶更多分布于椎基底动脉系统(P=0.021),较少分布于右侧颈内动脉系统(P=0.045)。将cTTE+组进一步细分为永久性RLS和潜在RLS两组,但两组在DWI梗死灶的数量、大小和皮质受累程度均没有显著差异。cTTE-组卒中梗死病灶最大直径更多分布于[1 cm,3 cm](P=0.037),差异均有统计学意义(P<0.05)(见表2)。cTTE+组脑梗死典型影像见图1。
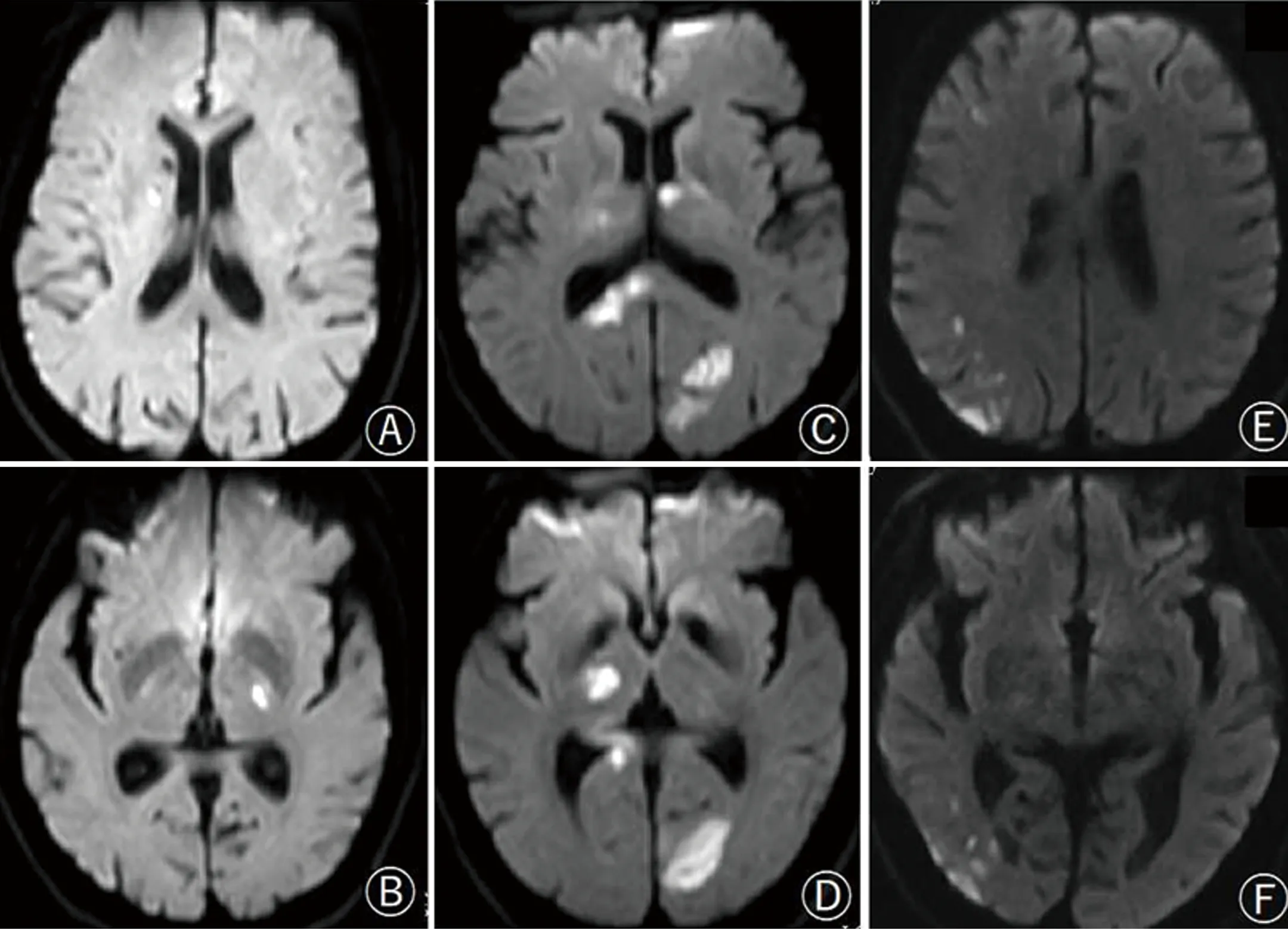
图1 cTTE+卒中患者典型磁共振弥散加权成像影像:图A、B为50岁女性患者,DWI示梗死灶分布于双侧前循环区域(图A新发梗死位于右侧侧脑室旁,图B新发梗死位于左侧基底节区);图C、D为70岁男性患者,DWI示梗死灶分布于双侧前后循环区域。(图C新发梗死位于左侧丘脑前核、右侧胼胝体及左侧枕叶;图D新发梗死位于右侧丘脑、右侧胼胝体和左侧枕叶);图E、F为62岁男性患者,DWI示梗死灶散在分布于右侧大脑中动脉供血区域,DWI示梗死灶散在分布于右侧额叶、顶叶和颞叶
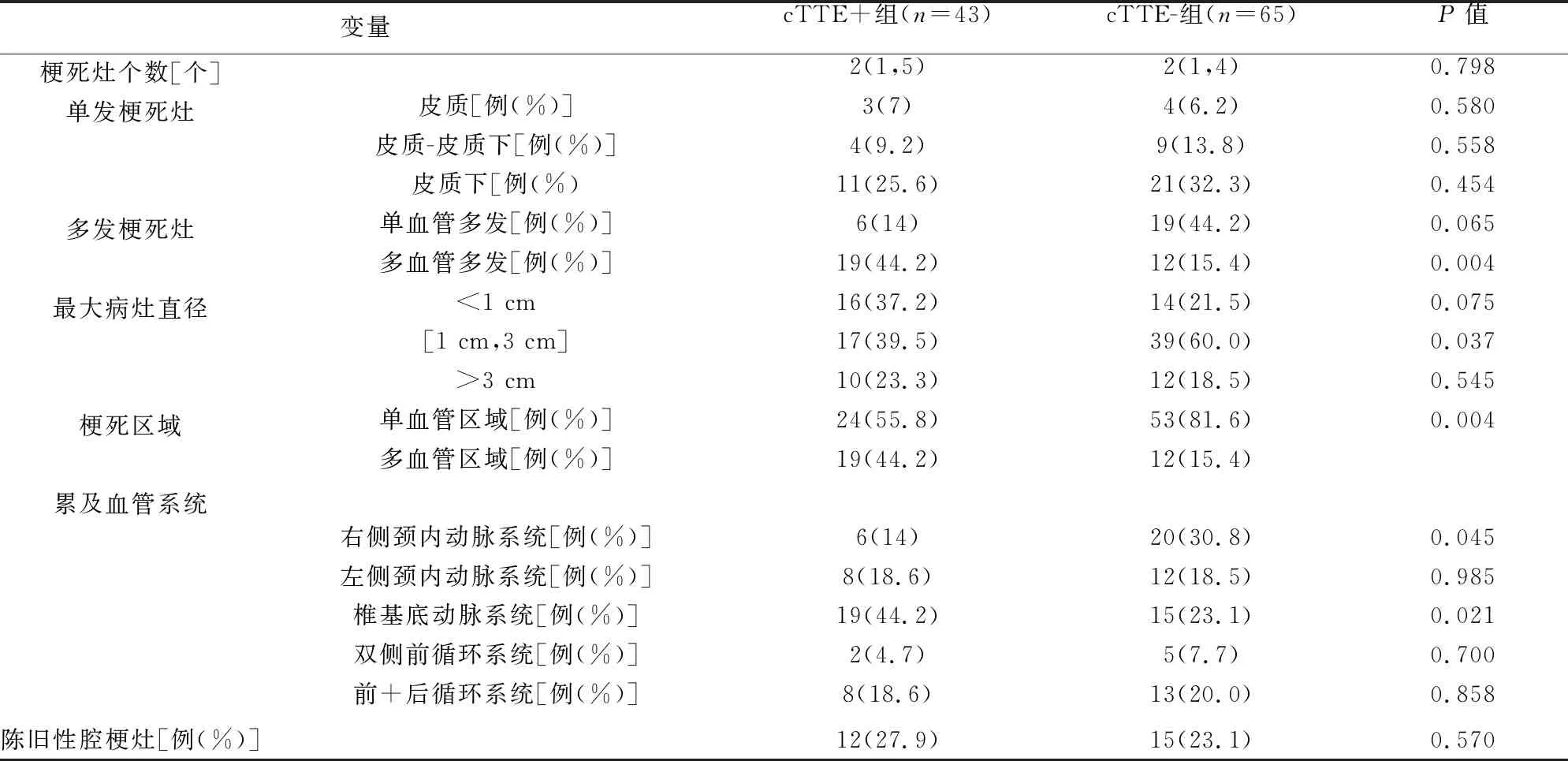
表2 cTTE+组和cTTE-组影像学特征比较
2.4 cTTE不同RLS分级与梗死病灶大小的关系 见图2,1级分流的患者中<1 cm、1~3 cm及大于3 cm的病灶比率分别为38.1%、28.6%、33.3%,2级分流中<1 cm、1~3 cm及大于3 cm的病灶比率分别为25%、58.3%、16.7%,3级分流中<1 cm、1~3 cm及大于3 cm的病灶比率分别为50%、40%、10%,随着分流级别的增加,小病变的比率有增加的趋势,其中<1 cm病灶3级分流vs. cTTE-组P值为0.054。

图2 不同RLS分级与DWI梗死灶大小的关系
3 讨 论
卒中的二级预防主要依据卒中或TIA发病时的病因,随着卒中病因学及发病机制研究的深入、卒中分型的改良及诊断技术的提高,缺血性脑卒中划分为CS的百分比较之前已有所下降,相比既往,目前在高级卒中中心检查出的高度隐匿CS仅占缺血性卒中的20%~25%。而经过标准评估后诊断为CS的患者仍占所有缺血性卒中患者的20%~30%,因此CS的病因诊断对临床医生来说仍是不小的挑战。PFO是隐源性卒中已明确的致病因素,虽然其诱发卒中的发病机制尚不清楚,但反常栓塞是被广泛接受的假说之一。目前研究多集中于各种检查手段确诊的PFO对于隐源性卒中病因的贡献,但由于研究方法、入组标准等差异较大,结果仍不一致,且部分微量及少量右向左分流病变常被排除在阳性以外,故本研究中我们主要探讨右心声学造影右向左分流阳性患者卒中相关性的临床及影像特征,探索cTTE对CS病因分类的临床价值。
本研究cTTE+组中,39例为心内分流,同时发现4例肺内分流,其中2例予外科干预。RLS有心内分流和心外分流两条通道:心内分流以PFO最常见,此外还有房间隔膨出瘤等;心外分流包括肺内分流如肺动静脉畸形或其他更少见的分流通道(如奇静脉一肺静脉瘘),故栓子的来源筛查不仅对卒中的病因去除很关键,同时可以发现许多隐匿的影响心肺功能疾病。常规经胸心脏超声检查因声窗问题容易漏诊某些心内分流性疾病,更无法检测肺内动静脉分流。经食管超声心动图作为目前公认的诊断PFO的“金标准”,能够准确观察房间隔的解剖特征,并能排除肥胖和肺气的干扰,但其属于半侵入性检查,患者较难耐受,加上食管探头的操作更会影响患者valsalva动作的配合,且同时存在严重心律失常、重症心力衰竭、呼吸衰竭、高龄、食管疾病等检查禁忌证和分流量无或偏少,因而影响对RLS的准确观察,使得结果出现偏差,国内临床难以普及。c-TCD以其无创性、操作简便等特点,临床上亦作为探查RLS的新技术,但因其无法监测RLS的来源、了解房间隔结构及判断心腔内其他来源的栓子,在RLS的初筛和诊断上不占优势。cTTE的敏感度和特异性均较高,且临床上简便易行、易推广、价格低廉、重复性高、特异性强,可作为RLS的初筛优选手段。
本研究结果发现cTTE+患者发病时临床症状异于cTTE-组患者,且有统计学差异,这一点目前未见其他研究报道。cTTE-组多为常见典型的如肢体乏力、言语不利、恶心呕吐等可以神经功能缺损定位的症状,而cTTE+患者发病时常同时出现多个如头晕、头痛、胸闷、烦躁、行走稍不稳、一过性言语不能等非特异性神经功能缺损症状,症状多而轻,可迅速缓解或反复发作,NIHSS分值常较低,无法充分评测。本研究显示入组患者NIHSS评分平均值3.28分,且发病时mRS评分低。此外,本研究结果提示青中年组阳性率高于老年组,即发病年龄早的患者更易出现RLS阳性。已有报道显示,相比无脑卒中或原因明确脑卒中患者,PFO在CS患者中的患病率明显升高,尤其在<55岁患者中更加明显。PFO相关脑卒中人群不一定局限于中青年患者,PFO亦会增加老年人卒中的风险,蔡高昂等[8]对隐源性卒中年龄分层后分析发现无论中青年及老年,PFO都是CS的独立危险因素,年龄不是影响PFO与CS关系的主要因素。故从临床特征角度看,针对卒中患者应不分年龄层地去检测患者心脏是否存在RLS,这是目前临床筛查高危因素的方向,对于CS病因分类有很高的临床价值。
孔学军等[9]发现PFO患者中存在RLS的左心房直径常小于左向右分流,这类患者易好发卒中,本研究针对左心房直径并未发现统计学差异。另外,房间隔瘤虽为心源性栓塞中危危险因素,却常被临床忽视,cTTE+组筛查出2例房间隔瘤。已有研究表明PFO相关CS的大病灶更可能与房间隔瘤的存在[10]、房间隔偏移距离[11]相关,当PFO与房间隔瘤共存时,可能是房间隔瘤的重要危险因素[12],而患有PFO和房间隔膨出瘤且有卒中病史的患者是卒中复发风险较大的亚群。
除临床特点外,影像学特征可能为CS的病因研究提供线索。影像学特征方面,RLS阳性CS主要发生于血管危险因素较少和后循环受累的年轻患者。对多发病灶进一步细分,发现卒中病灶类型表现为多血管支配区的多发小梗死灶更容易发现右向左分流,后循环区域更甚。可能是由于卵圆孔作为过滤器只能允许比其更小的栓子通过门栓[13],反常栓塞的栓子在右心压力增高的情况下可能经血流释放至多血管系统,较少有栓子仅进入单支血管,且RLS增加,通过PFO的小栓子数量会相对增加,这为颅内多发小病变提供了解剖学基础。其次,之前的研究[14]已经证实,PFO患者进行Valsalva呼吸时后循环血流量明显超过前循环血流量,这一发现可以解释为什么当RLS量增加时,它更有可能影响后循环。
目前RLS的数量与卒中模式之间的关系尚不清楚。在本研究中,我们分析了不同RLS数量与临床特征和影像学的关系,结果显示随着分流级别的增加,小病变的比率有增加的趋势。Kim等[15]采用c-TCD评估了RLS的数量(微栓子<20 vs. ≥20)和活动(自发vs. 单纯Valsalva动作后)与DWI梗死病变类型的关系,结果发现DWI病变的多样性和分布并不取决于RLS的数量和活动,但DWI病灶的大小取决于RLS的数量,即RLS在小梗死(<1 cm)的患者比大梗死的患者更常见,80%的大量RLS的患者DWI发现有小梗死灶,结果表明,RLS的数量决定了弥散加权成像的病变类型。Dan He等[16]也发现PFO诱发RLS的数量与DWI和T2序列的卒中类型有关,且DWI序列的趋势更为明显。具体来说,RLS的数量越多,小病变的比例就越高,并且更有可能累及后循环。此外,RLS数量增加时,DWI序列中出现多发皮质病变的频率更高。以上结果提示PFO的病因相关的CS与更大数量的RLS密切相关,而在RLS数量较少的CS患者中,可能存在PTE以外的其他机制,有待进一步研究。
4 结 论
RLS所致CS可表现出独特的临床和影像学特征,梗死模式可能是RLS相关CS的线索,对于具有上述临床及影像学特征的CS患者应怀疑存在RLS的可能,cTTE有助于RLS的初步诊断,为临床预防及诊治提供依据,它可能会改变以前的病因分类,这是非常重要的,因为病因分类是制定治疗决策的基础,右心声学造影有望成为CS病因筛查的必需检查手段之一,因其简单操作,高级卒中中心以外的医疗单位同样可以开展,前景广阔。本研究的不足在于我们的研究数据有限,其结果可能存在偏倚,后续仍然需要通过大样本多中心研究来完善结论。

