伴严重瘙痒的周围神经高兴奋综合征临床及电生理研究
陈 琳, 陈 娜, 王 颖, 翦 凡, 张 磊, 杨 硕, 张在强, 潘 华
周围神经过度兴奋综合征(peripheral nerve hyperexcitability syndrome,PNHS)是以自发或持续的肌肉颤搐、痉挛为主要表现的罕见周围神经综合征[1]。其中,原发性的PNHS,主要包含 Isaacs 综合征(Isaacs syndrome)、Morvan 综合征(Morvan syndrome)和痉挛-束颤综合征(cramp-fasciculation syndrome,CFS),患者除运动系统的高兴奋性症状外,多伴有自主神经功能障碍,部分患者出现失眠或轻度精神认知症状,除疼痛外,其他感觉异常并不多见[2~4]。
在此,我们报道我院收治的2例伴严重瘙痒的PNHS患者,总结其临床特点、诊疗经过及随访转归,结合文献予以分析讨论。旨在提高临床医师对该病的认识,以及时有效地诊治。
1 资料和方法
研究对象为2019年于首都医科大学附属北京天坛医院就诊的2例伴严重瘙痒的PNHS患者。收集患者的临床资料,包括临床表现、血清学指标、电生理表现及治疗、随访情况,同时结合文献进行回顾性分析。
2 结 果
例1,男,60岁。因双下肢肌肉不自主抽动、疼痛2 m伴难以忍受的瘙痒1 m,2019年9月就诊我院。患者2019年7月无明显诱因出现双小腿肌肉不自主抽动,伴刀割样疼痛,活动后加重,休息不能缓解,睡眠中可也可出现上述表现;起病1 m后出现双下肢瘙痒,无明显皮疹,搔抓不可缓解,因瘙痒无法入睡。就诊前10 d出现磨牙。患者发病初期多汗,后睡眠质量差、大便干燥、小便次数增多。患者曾于2014年、2018年分别行胸腺瘤切除术,术后化疗4次,具体用药不详。
查体除双下肢皮肤明显抓痕、结痂,部分肌群可见颤搐现象,余未见异常。患者发病初期多汗,就诊时皮肤未见明显潮湿或干燥,皮肤划痕征阴性。
肌电图检查(2019年9月)示:运动神经传导检测于左侧正中神经、尺神经及双侧胫神经可见复合肌肉动作电位(compound muscle action potential,CMAP,M波)后发放电位(见图1 A,C,E,G),感觉神经传导检测正常。针极肌电图检查于左侧三角肌、肱二头肌、腓肠肌和右侧胫前肌可见束颤、三联束颤及肌颤搐电位。四肢交感皮肤反应(sympathetic skin response,SSR)未引出。
患者中年男性,亚急性起病,病情进展加重。表现为双下肢疼痛伴肌肉不自主跳动,病程中存在自主神经症状,既往胸腺瘤病史,肌电图运动神经传导可见M波后发放电位、针极肌电图可见束颤及肌颤搐电位,考虑诊断神经性肌强直,病因考虑获得性可能性大,需排除自身免疫相关、肿瘤相关。患者此次胸部CT未见胸腺瘤复发,肿瘤标志物未见明显异常。血清及脑脊液神经元抗原抗体谱未见异常。电压门控钾通道(voltage-gated potassium channel,VGKC)相关抗体检查提示血清学CASPR2抗体阳性(1∶320)、LGI1抗体阳性(1∶32),脑脊液相关抗体阴性。
患者自免脑相关抗体阳性,且存在失眠、情绪低落,考虑诊断Movan综合征,但脑电图及头颅MRI未见明显异常。认知评估简易智力状态检查量表27分/30分,蒙特利尔认知评估量表17分/30分(大专学历),存在中度认知功能障碍(视空间及执行功能、注意力、延迟回忆受损明显)。汉密尔顿抑郁量表21分,汉密尔顿焦虑量表21分,存在明显的焦虑抑郁。匹兹堡睡眠质量指数14分,睡眠受损;多导睡眠监测提示快动眼睡眠行为障碍。最终诊断为Morvan 综合征,抗CASPR2/LGI-1抗体相关自身免疫性脑炎[4,5]。
予以静脉注射丙种球蛋白(IVIG)0.4 g/(kg·d)治疗5 d后,患者双下肢瘙痒明显缓解,VAS自评分由治疗前7分降为1分。但肌颤搐及磨牙症状同前。继以静脉注射甲泼尼龙1000 mg/d冲击治疗3 d后,患者上肢(肱二头肌及三角肌)肌肉颤搐缓解,但仍有下肢腓肠肌颤搐存在。甲泼尼龙减量至500 mg/d治疗3 d、240 mg/d治疗3 d、120 mg/d治疗3 d后改为口服泼尼松片维持治疗。病程中应用氯硝西泮、加巴喷丁及文拉法辛进行对症治疗。2 m后患者所有症状消失。
复查肌电图(2019年11月):上肢正中神经、尺神经M波后发放电位消失(图1 B,D),双侧胫神经M波后发放电位较前减轻(图1 F,H);针极肌电图检查左侧三角肌及肱二头肌未见束颤及肌颤搐电位发放;四肢交感皮肤反应可引出。
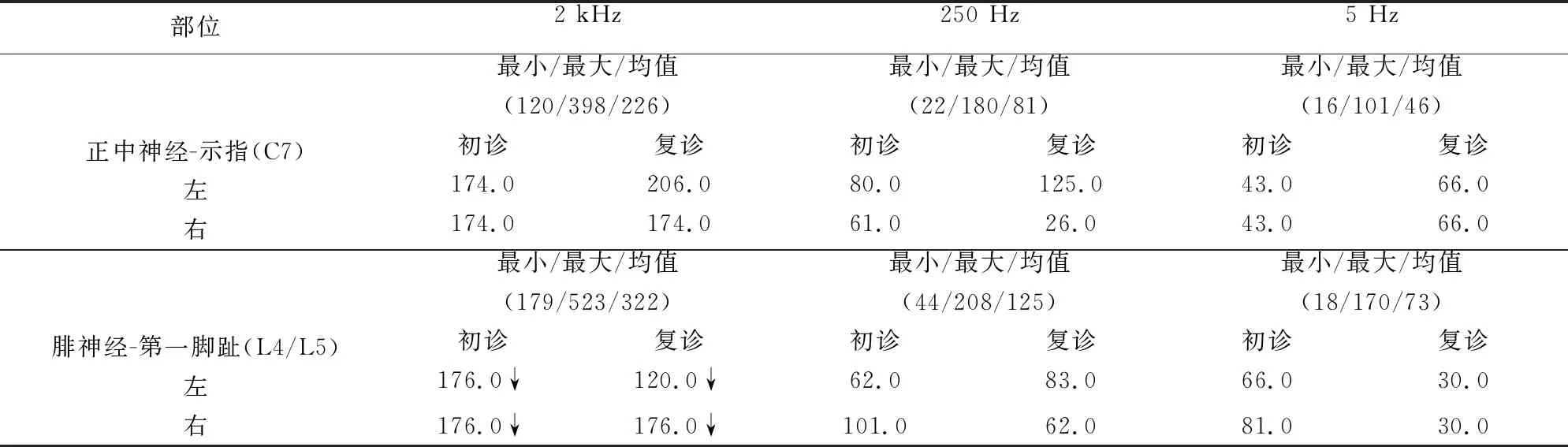
图1 患者1治疗前后的M波后发放电位
例2,女,37岁。于2019年9月无明显诱因出现双下肢胀痛,同时伴有下腹部及会阴部瘙痒,无明显皮疹,搔抓不可缓解,自述难以忍受,无法入睡。次日进展为全身酸痛,行走后双下肢酸痛加重。1 m后出现双小腿肌肉颤搐,运动后加重,并出现便秘及小便费力;就诊前半月出现双下肢烧灼感及蚁行感,持续不缓解,伴有多汗。于2019年11月于我院就诊,自发病以来精神差,睡眠差,体重减轻5 kg。查体可见皮肤潮湿,下腹部明显红色抓痕,双下肢近端、远端肌肉颤搐,其他无异常。
肌电图检查(2019年11月):神经传导检测未见异常,双侧胫神经及右侧尺神经F波检测未见M波及F波后发放电位;针极肌电图检查右侧三角肌,双侧腓肠肌静息时可见束颤、多联束颤和肌颤搐电位;SSR波幅降低。CPT检测提示2000 Hz电流刺激感觉神经纤维阈值降低(见表1)。
患者中年女性,急性起病,进展性病程。表现为感觉异常、肌肉颤搐及出汗增多,肌肉抽搐于清醒和睡眠时均存在,结合肌电图考虑神经性肌强直。获得性神经性肌强直常与肿瘤及自身免疫疾病有关,患者CASPR2抗体阳性,血清神经元抗体谱抗Yo抗体弱阳性。肺部CT发现残存胸腺组织,但肿瘤标志物及PET-CT未见明显异常,头颅MRI及脑脊液检查均正常。妇科检查排除生殖系统感染所致会阴部瘙痒。
最终诊断为Isaacs 综合征[6,7],予以IVIG 0.4 g/(kg·d)治疗5 d后,患者症状改善不明显,会阴部瘙痒严重,难以入睡,继以静脉注射甲泼尼龙1000 mg/d冲击治疗2 d后症状逐渐缓解,VAS自评分由10分改善为3分。甲泼尼龙减量至500 mg/d治疗3 d、240 mg/d治疗3 d、120 mg/d治疗3 d后,口服甲泼尼龙及硫唑嘌呤维持治疗。患者病程中应用氯硝西泮、卡马西平、加巴喷丁及度洛西汀进行对症治疗。患者症状逐渐好转,1 m后疼痛及瘙痒感消失,但偶有双侧小腿肌肉抽动。于2020年8月复诊,复查CASPR2抗体阴性。肌电图检查(2020年8月):神经传导及针极肌电图检测均未见异常,SSR正常。CPT检测仍提示2000 Hz电流刺激感觉神经纤维阈值降低。
3 讨 论
2例患者临床表现相似(见表2),病程中均出现肢体肌肉颤搐、疼痛,出汗、二便异常、睡眠障碍,以及焦虑不安等情绪改变,并伴有显著瘙痒;病例2还出现双下肢皮肤的蚁走感。这种涵盖感觉异常的周围神经高兴奋综合征在临床并不多见。

表2 患者的临床及实验室资料

注:治疗前左侧正中神经(A)、左侧尺神经(C)、左侧胫神经(E)及右侧胫神经(G)均可见M波后发放电位的存在,F波无法辨认。治疗后,正中神经(B)与尺神经(D)M波后发放电位消失,F波可辨认。胫神经(F、H)M波后发放电位仍存在,但较前缓解
瘙痒是一种引起患者强烈搔抓的感觉体验,通常由皮肤疾病或系统疾病造成,神经功能异常及心理疾病亦可引起瘙痒[8]。神经病理性痒为神经系统功能异常造成,中枢神经系统或周围神经系统均可参与其中[9]。痒的传递有其特定的神经通路[10],神经性瘙痒可由其感觉神经通路上任何部位的异常所引起[11]。以往研究认为无髓鞘的C纤维是调节痒感觉的主要纤维[9],而随着研究进展发现,粗髓鞘的A纤维也参与到痒感觉的获取[12]。本研究中两例患者周围神经的远端感觉神经传导检测均正常,不能解释其严重瘙痒表现,但SSR存在不同程度的受累,提示与以往研究C类纤维受累相符;另外病例2 CPT检测双下肢感觉神经纤维2000 Hz电流刺激阈值降低,提示Aβ粗有髓感觉纤维兴奋性升高,可能参与到该患者瘙痒的形成,这是常规感觉神经传导检测所不能体现的。
近年来研究显示,感觉神经元的敏化参与到瘙痒的形成。神经细胞中瞬时受体电位通道(transient receptor potential channel,TRPC)A1(TRPA1)和V1(TRPV1)与瘙痒关系紧密,其开放引起Ca2+内流,调节神经兴奋性[13]。TRPV1主要介导组胺性瘙痒,其治疗主要应用抗组胺药;而TRPA1主要介导非组胺性瘙痒,与其他炎症介质的释放有关[14]。加巴喷丁可通过调节电压门控的钙离子通道减少Ca2+内流,降低神经的兴奋性,但本文两例患者单独使用加巴喷丁并不能很好改善瘙痒症状。
另外,由于K通道在稳定神经元膜电位和调节神经元兴奋性方面的重要作用,研究发现背根神经节(dorsal root ganglia,DRG)神经元的K通道参与神经性瘙痒。敲除实验动物DRG神经元中特定K通道的必须亚基[15]或抑制特定K通道的功能[16]均可通过提高DRG神经元的兴奋性诱发瘙痒。那么,CASPR2作为VGKC功能复合体的重要组成,其抗体是否可能造成传递痒的感觉神经元兴奋性升高呢?
最新研究表明,CASPR2抗体可以直接作用于DRG神经元的CASPR2胞外段,从而阻断VGKC复合体的形成,下调神经元胞膜上电压门控K通道亚基1(Kv1)的表达,从而上调DRG神经元兴奋性[17],并最终造成脊髓背角的中枢敏化。同时,既往研究在探讨咪喹莫特所致严重瘙痒的机制中发现,其可抑制小鼠DRG神经元Kv1的功能[18]。因此,我们推测CASPR2抗体可能同样敏化DRG中传递痒的神经元,从而引发严重瘙痒。病例2中Aβ粗有髓纤维感觉兴奋阈值降低,可能是DRG中相应大直径神经元敏化的结果。
CASPR2抗体所致K通道的异常同样介导了运动神经的高兴奋。由于神经轴突末端缺乏髓鞘保护且血-神经屏障薄弱[19],因而CASPR2更易与其抗体结合,下调VGKC复合体在运动神经轴突末端的表达[20],电生理上表现为M波后发放电位,临床上因放电频率的不同表现为肌肉颤搐、痉挛或僵直。本研究两例患者均出现肌肉颤搐。
LGI1是一种神经元分泌蛋白,主要分布在中枢神经系统海马及颞叶皮质,参与突触前膜VGKC向突触后膜传递抑制信号,LGI1抗体干扰其功能影响神经元抑制信号的突触传递,最终引起神经元兴奋性增高[21,22]。病例1可检出LGI1抗体,临床表现存在中枢神经系统的失眠、记忆力减退和认知障碍等。
以往也有研究发现有疼痛表现的CASPR2抗体阳性的Morvan综合征患者,存在小纤维神经受累的证据[23],另外在小纤维神经病(small fiber neuropathy,SFN)的研究中也发现,有50%的患者存在CASPR2抗体阳性[24]。这与本文两例患者SSR异常相一致。
关于两例患者治疗和随访,病例1既往诊断并治疗胸腺瘤,病例2可见残留胸腺。本病和胸腺瘤及自身免疫障碍有一定的关系。本研究两例患者对免疫治疗反应较好与文献报道一致[25]。该两例患者瘙痒、疼痛、自主神经症状及运动神经高兴奋性的表现在IVIG及类固醇激素治疗后缓解或消失,继续行免疫抑制治疗后达到进一步改善。
综上所述PNHS的表现形式多样,可有周围运动、感觉神经高兴奋性的表现如肌肉颤搐、疼痛等及中枢神经系统受累的表现如认知、情绪、睡眠障碍等。以往对该类疾病中的瘙痒研究不足,推测该类患者的瘙痒为神经病理性瘙痒,与CASPR2抗体导致的神经功能异常有关,免疫治疗后缓解。早期识别该类患者,及时行血清学相关抗体检测及肌电图检查有助于早期诊断和治疗。

