哀牢山紫茎泽兰入侵群落主要物种种间联结及环境解释
姜倪皓,张世浩,张诗函
1.楚雄师范学院资源环境与化学学院,云南 楚雄 675000;2.河池学院化学与生物工程学院,广西 河池 546300;3.楚雄师范学院教育学院,云南 楚雄 675000
种间关系是生态学研究的重要内容。种间联结是不同物种在空间分布上的相互关联性,用以描述由于群落生境差异造成的不同物种分布的相互关系,它是植物群落重要的数量和结构特征之一,是群落结构形成和演化的重要基础(Haukisalmi et al.,1998)。研究群落内主要物种的种间联结特征,有助于正确认识群落的组成和功能及演替趋势,对植物资源的保护和利用、生物多样性保护以及植被恢复与重建等具有重要的意义(刘海等,2017;江焕等,2019)。采用种间联结性等数量生态学方法探讨生物入侵后群落中物种间的联结性是研究入侵生物和本土物种间相互作用的重要切入点,当前国内对外来植物入侵群落的种间联结的报道相对较少(郭连金等,2009;郭佳琦等,2021)。在群落尺度上,微地形因子和土壤养分,水分等微生境因子的差异及它们之间的协同作用会导致生境异质性,进而影响植物的空间分布(谢玉彬等,2012;吴昊,2015),研究物种种间联结性及物种分布与环境的关系有助于了解优势物种对资源利用的生态习性及其相互关系,也有助于揭示群落的水平空间配置情况和物种分布的主导环境因子,对生态系统的科学经营管理等具有重要意义(陈佳卉等,2021)。
紫茎泽兰(Ageratinaadenophora)是菊科(Compositae)紫茎泽兰属(AgeratinaSpach)的多年生丛生型半灌木状草本植物,是中国外来入侵物种中危害最严重的植物之一(Wang et al.,2006;Gui et al.,2008)。紫茎泽兰入侵影响生物群落的结构与功能,打破了群落内物种共存的生态格局(陈旭等,2021),给入侵地区的生态系统和环境造成了严重的危害。哀牢山位于中国西南部云南省的云贵高原、横断山脉和西藏高原之间,是云南重要的气候与生态类型的分界线。该区域拥有典型的亚热带森林生态系统,生物多样性较丰富,植物区系地理成分复杂(王高升等,2008)。笔者在哀牢山东麓的野外调查中发现,紫茎泽兰早已入侵该区域并在该区域有迅速扩散蔓延的趋势,这将造成该区域植物群落物种多样性丧失、自然生态系统服务功能下降等破坏性影响,严重威胁该区域生态系统的稳定性。
目前,关于紫茎泽兰入侵群落植物种间联结性及物种分布与环境的关系的研究仍相对缺乏(刘海等,2017),尤其针对哀牢山地区紫茎泽兰群落尚无相关的研究报道。本研究以哀牢山紫茎泽兰群落为研究对象,利用χ2检验、方差比率法、种间联结系数、Spearman秩相关系数检验等数量分析方法,对研究区紫茎泽兰入侵群落主要植物的种间联结性进行定量分析。采用冗余分析(RDA),方差分解,随机森林模型和结构方程模型共同探究环境因子对主要物种分布及入侵的影响。旨在探究以下3个科学问题:(1)紫茎泽兰与伴生物种的种间关系和相互影响如何?(2)影响群落物种分布的主要环境因子是什么?(3)影响入侵植物入侵强度指数、群落可入侵性指数和群落稳定性指数的主要环境因子是什么?这些科学问题的合理解答将为该区域紫茎泽兰入侵后植物群落的管理以及本土生物多样性保护提供理论依据。
1 研究区概况和研究方法
1.1 研究区域概况
双柏县处于滇中干旱地区,属环境敏感区域和生态环境脆弱地区,同时双柏县亦是哀牢山国家级自然保护区的核心区域。本研究区位于哀牢山北段东麓的双柏县爱尼山乡安龙哨森林管护点所辖的林区,地理坐标为 101°56′—101°57′E、24°44′—24°45′N(图1)。该区域属北亚热带高原季风气候,年平均降雨量927 mm,年平均气温15 ℃。土壤类型以红壤为主。
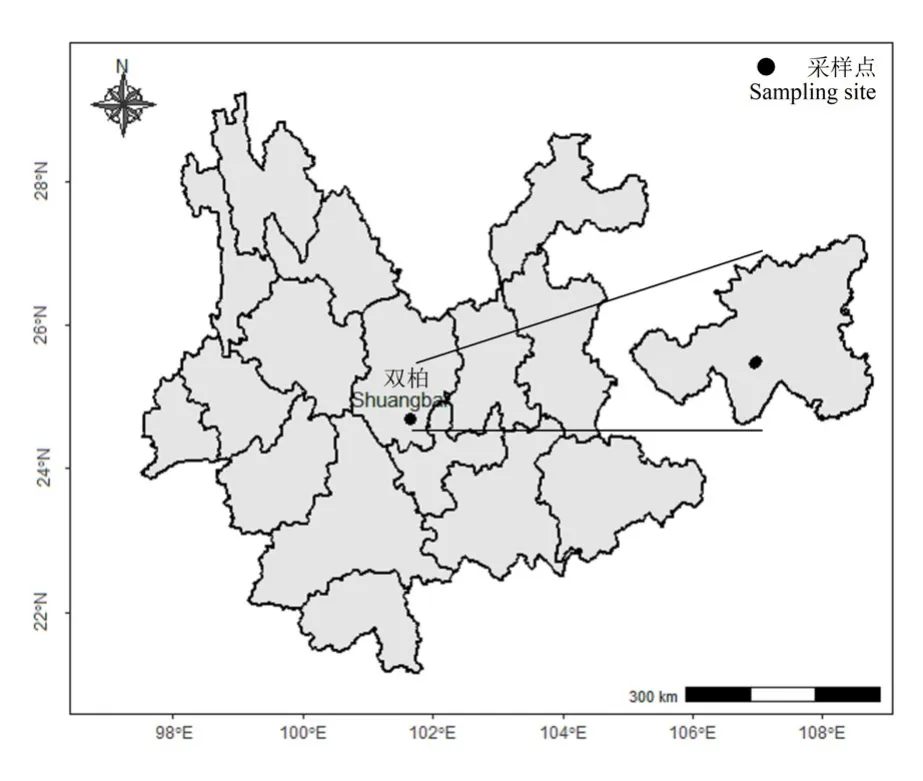
图1 研究区位置Figure 1 Location of study area
研究区域的乔木层以云南松(Pinus yunnanensis)为主,混生少量滇木荷(Schimanoronhae)和麻栎(Quercusacutissima)。该区域植被长期维持自然生长发育状态,对紫茎泽兰入侵也未采取任何防控措施,紫茎泽兰呈现蔓延的趋势。
1.2 研究方法
1.2.1 样地设置与调查
2020年7月,在紫茎泽兰典型分布区域内(相对丰度>50%),设置垂直于群落边缘的3条垂直样带,每条样带内设置10个20 m×20 m的标准样地,测定每个标准样地内胸径大于1 cm的立木的种类、数量、基径、胸径、树高等因子,记录郁闭度、海拔等群落和环境因子信息。同时在每个样地内分别沿对角线设置3个1 m×1 m的样方,在90个样方内调查紫茎泽兰及其他灌草层物种的株数、株高和盖度等特征。坡向的原始记录是以朝东为起点(即为0),顺时针旋转的角度表示。坡向数据处理时,采取每45°为1个区间的划分等级制的方法,数字越大,表示越向阳、越干热(张峰等,2003)。
1.2.2 土壤理化性状测定
采集每个小样方中心0—20 cm土层的土壤样品,将每个样地中3个小样方土壤混合,土样过0.25 mm筛后保存,土壤理化性质分析均为常规分析方法(黄庆阳等,2020)。土壤含水量采用烘干法。土壤容重采用环刀法。采用电位法(水土比为2.5∶1)测量土壤pH值。电导率由手持电导率仪测定。有机质含量测定用重铬酸钾容量法-外加热法测定。全氮测定采用半微量开氏法。全磷测定采用钼锑抗分光光度法。全钾测定采用原子吸收分光光度法。土壤中有效氮含量测定采用碱解扩散法。有效磷测定采用紫外/可见分光光度计。有效钾测定采用 1 mol·L-1乙酸铵浸提法。
1.2.3 重要值及生态位特征测定
采用重要值反映物种在群落中的优势程度,剔除偶见种后,基于相对频度、相对多度、相对密度和相对高度的相关数据计算重要值,取相对重要值大于 1.0且出现频率最高的 10个物种进行后续分析。重要值计算公式(张金屯,2018)如下:

式中:
B(sw)i——物种i的Shannon-Wiener生态位宽度指数,值域为[0, lnr];
Oik——物种i和k的生态位重叠指数;
Cik——物种i与物种k的生态位相似比例,Cik值域为[0, 1];
Pij——物种i在第j资源位上的重要值;
Pkj——物种k在第j资源位上的重要值。
1.2.4 总体联结性检验
采用零联结模型导出方差比率(Rv)法检验多物种间的总体关联性(Schluter,1984;张金屯,2018)。Rv>1表示物种间总体上表现为正关联,Rv<1表示物种间总体上表现为负关联。采用统计量(W)来检验多物种间的关联程度,χ20.95<W<χ20.05表示关联不显著,反之则表示关联显著。计算公式为:
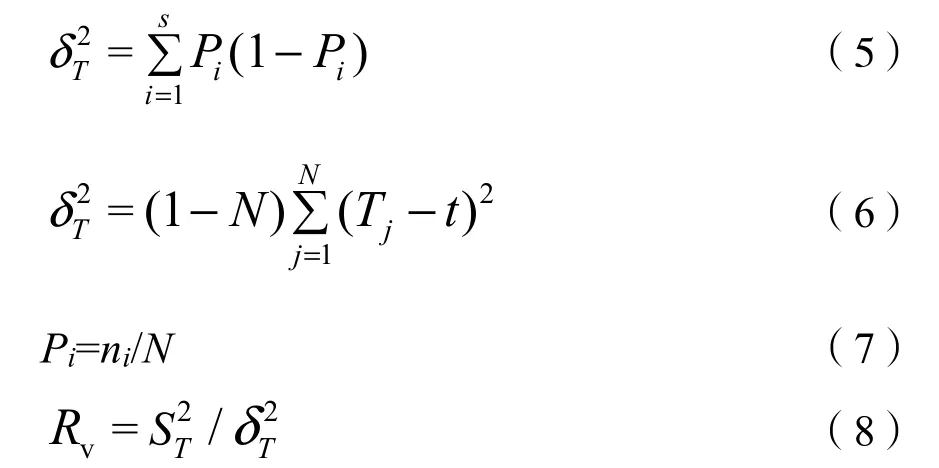
式中:
Pi——物种i出现的频率;
S——物种总数;
N——总样方数;
Tj——样方j内出现的物种数;
t——各样方内物种数的平均值;
ni——物种i出现的样方数。以Rv值作为群落内主要物种间的总体联结指数,在独立性零假设条件下,Rv的期望值为1。Rv>1表示物种间总体上表现为正关联,Rv<1表示物种间总体上表现为负关联。采用统计量(W)来检验多物种间的关联程度,W=N×Rv;χ20.95<W<χ20.05表示关联不显著,反之则表示关联显著。
1.2.5 种间联结性检验
采用χ2统计量检验对种间联结性进行定性研究,应用SPSS 19.0计算Yates连续性校正χ2值。Yates的连续性校正公式如下(张金屯,2018):

式中:
a——2个物种共同出现的样方数;
b、c——仅有1个物种出现的样方数;
d——2个物种均出现的样方数。当χ2<3.841,即P>0.05,种间联结性不显著;当 3.841<χ2<6.635,即0.01<P<0.05,种间联结性显著;当χ2>6.635时,即P<0.01,认为种间联结性极显著。χ2值本身没有负值,本研究使用V比值判断种间关联性。V=(a+b)-(b+c)/(a+b+c+d),当V>0时,种间关联性为正联结;当V<0时,种间关联性为负联结。
1.2.6 种间关联程度测定
采用联结系数Ca对χ2统计量检验结果进行进一步检验。计算公式如下(张金屯等,2018):当ad≥bc时,Ca=(ad-bc)/[(a+b)(b+c)];当ad<bc时,且d≥a时,Ca=(ad-bc)/[(a+b)(a+c)];当ad<bc时,且d<a时,Ca=(ad-bc)/[(b+d)(d+c)];Ca值域为[-1,1],Ca值越趋向1,表明种间正联结性越强;Ca值越趋近-1,表明种间负联结性越强;Ca值为0,表明种间相对独立。
1.2.7 种间关联程度测定
采用优势种的重要值作为 Spearman秩相关分析的数量指标。Spearman秩相关系数计算公式(张金屯,2018):

式中:
n——样方数;
xik和xjk——种i和种j在样方k中的秩。
rs(i,j)——值域为[-1, 1],正值表示正相关,负值表示负相关。
1.2.8 入侵植物入侵强度指数及群落可入侵性指数
采用入侵植物入侵强度指数(Invasion intensity index of alien invasive plants,Iii)表征入侵植物入侵强度,Iii值越大表示入侵植物的入侵强度越高(Wang et al.,2020)。采用群落可入侵性指数(Community invasibility index,Cii)表征群落可入侵性水平,Cii值越大表示群落可入侵性越高(Wang et al.,2020)。
入侵植物入侵强度指数(Iii),计算公式如下:

群落可入侵性指数(Cii),计算公式如下:

式中:
Pimax——所有调查样方内入侵植物相对丰度最大值;
Pi——调查样方内入侵植物的相对丰度。Cii值越大表示群落可入侵性越高。
1.2.9 群落稳定性
群落稳定性采用以下两种计算方法:
(1)群落稳定性指数(community stability index)以物种种群密度变异系数(coefficient of variation,CV)的倒数ICV表示,计算公式如下(Wang et al.,2020):

式中:
μ——调查样方内各植物种类的平均密度;
σ——调查样方内各植物种类密度的标准差(SD)。ICV值越大表示群落稳定性越高。
(2)使用郑元润(2000)改进后的M.Godron稳定性测定方法测定紫茎泽兰入侵群落的稳定性。先计算出群落中主要物种的频度,按相对频度的大小顺序逐步累积,与主要物种总物种数的倒数累积一一对应,建立模糊散点平滑曲线模型。绘制经过(0, 100)、(100, 0)的直线,该线段与平滑曲线的交点即为所求解。交点坐标越接近(20, 80),表示群落越稳定。
1.2.10 统计分析
以优势植物相对重要值为基础,利用 Canoco 5.0软件对物种重要值矩阵进行去趋势对应分析(detrended correspondence analysis,DCA),DCA排序前 4个轴中最大值为 2.7。然后进行冗余分析(RDA),通过前向选择(forward selection)法和蒙特卡洛检验(Monte Carlo test,循环次数499)筛选影响显著(P<0.05)的环境因子,探讨环境因子对物种分布的影响。基于约束性排序结果,通过多元线性逐步回归方法分析环境因子对群落稳定性、群落可入侵性及入侵植物入侵强度的相对影响,影响程度以标准化的偏回归系数确定。
基于R(4.1.2)软件,运用“Vegan”数据包里的“Varpart”功能进行方差分解分析。为了验证逐步回归分析结果,利用随机森林模型分析环境因子对群落稳定性、群落可入侵性及入侵植物入侵强度的相对重要性,为了判断随机森林模型的可靠性,对每个模型进行十折交叉验证。
入侵植物与环境因子间的关系较复杂,为厘清各环境因子的贡献,引入结构方程模型分析各环境因子对紫茎泽兰入侵的影响。根据已知的土壤因子与紫茎泽兰入侵及群落稳定性之间的因果关系,借助Amos 7.0软件构建初始模型。选用拟合指数(GFI>0.9)、渐进残差均方和平方根(RMSEA<0.08)、显著性概率值(P>0.05)等指标评价模型优度(王酉石等,2011)。最终选取全磷、有效钾、土壤pH值、土壤温度作为土壤因子,构建出最优结构方程模型。利用模型中各路径标准化系数,定量表示不同因素对的相对群落稳定性指数、群落可入侵性指数及入侵植物入侵强度指数的相对作用大小。
2 结果与分析
2.1 紫茎泽兰与伴生物种的生态位分析
根据 90个样方统计资料,紫茎泽兰入侵群落共有29种植物。其中,乔木17种,灌木4种,草本植物6种,蕨类植物2种,隶属21科27属。本研究选取了群落中重要值大于1.0且出现频率最高的10个物种作为主要物种(表1)。重要值排在前3位的物种依次为紫茎泽兰(Ageratinaadenophora)(28.90%)、里白(Diplopterygiumglaucum)(22.31%)和虎杖(Reynoutriajaponica)(7.89%)。生态位宽度较大的物种依次为紫茎泽兰(0.79)、里白(0.76)和芒萁(Dicranopterisdichotoma)(0.59)。
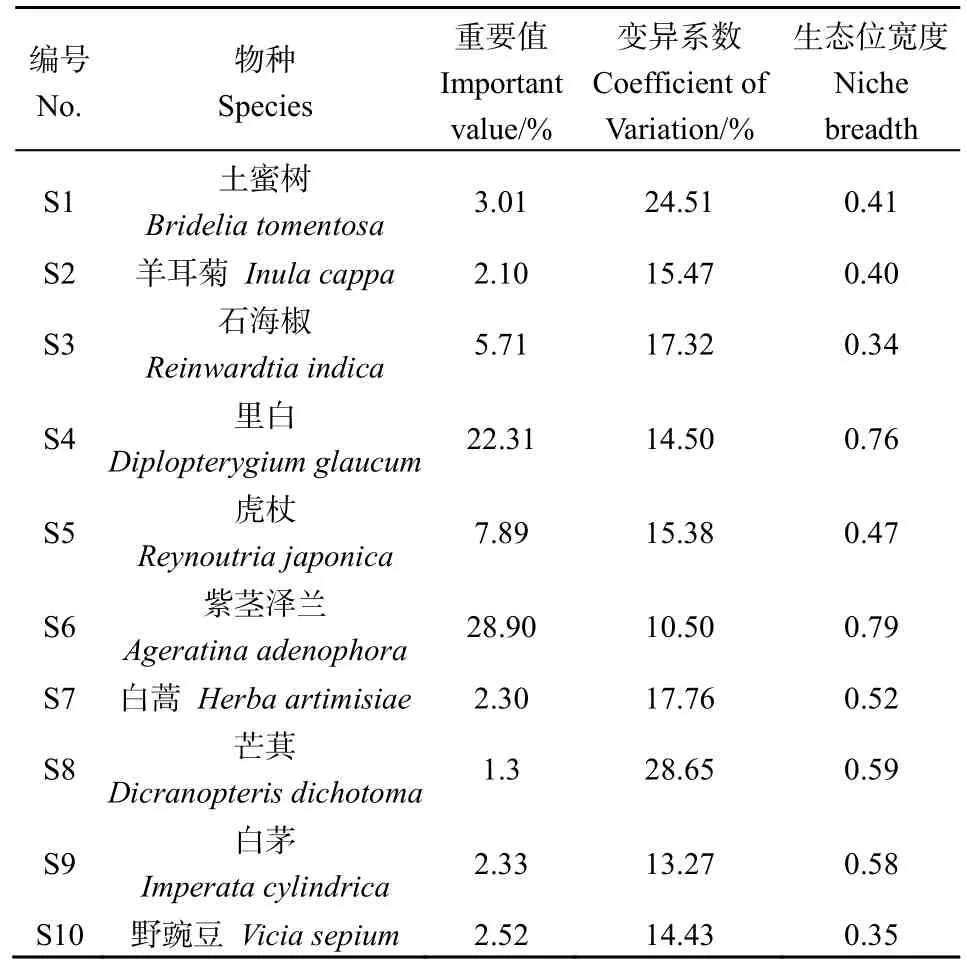
表1 草本层优势种重要值及其生态位宽度Table 1 Importance value and niche breadth of dominant species in herbaceous layer
生态位相似比例能够反映同一群落的不同种群对环境资源利用的相似性和物种生物学特性。紫茎泽兰群落主要物种的生态位相似性系数平均值为 0.312,与紫茎泽兰生态位相似性最高的为里白(Cik=0.642)。生态位相似性系数为0的种对有19个(42.22%),生态位相似性系数在 (0, 0.5]区间的种对共11个(24.44%)(表2),表明大部分物种对环境资源的需求有较大差异。
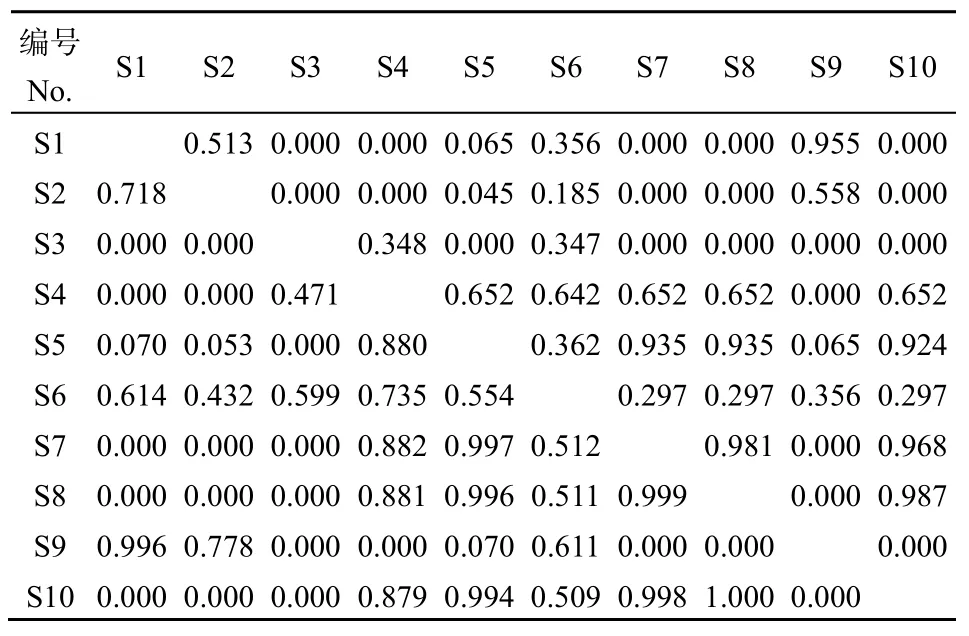
表2 紫茎泽兰群落主要优势种间的生态位相似性比例(对角线上)和生态位重叠指数(对角线下)Table 2 Niche similarity (above the diagonal) and niche overlap (below the diagonal) of dominant plant species in Ageratina adenophora community
紫茎泽兰群落主要物种的生态位重叠指数的范围在 (0, 1]区间,生态位重叠指数平均值为0.394。与紫茎泽兰生态位重叠最高的为里白(Oik=0.735)。生态位重叠指数在0.5以上的种对有21对,占总数的46.67%(表2),且其中8对发生在紫茎泽兰与伴生植物间,这些种对在环境资源不足时会产生激烈的竞争。
2.2 群落总体联结性和种间联结分析
紫茎泽兰群落主要物种间的总体联结性计算结果如表3所示,总体联结性的方差比率Rv=0.181<1,表明主要物种间总体呈负联结状态。而检验统计量(W)未落入界限χ20.95<W<χ20.05,表明Rv显著偏离1,即多物种间整体负联结具有统计学意义。研究表明,哀牢山紫茎泽兰群落主要物种间的总体联结性表现为显著负联结。
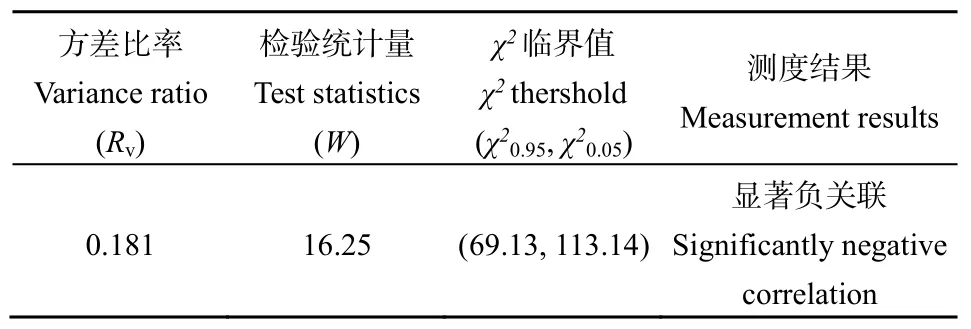
表3 主要物种间的总体联结性Table 3 Overall interspecific associations among dominant species
χ2检验结果表明(图2A),在10个主要物种构成45个种对,呈不显著正联结的种对有7对,占总种对数的 15.56%;11个种对呈极显著或显著正联结,占总种对数的24.44%;呈不显著负联结的种对有15对,占总种对数的33.33%;呈极显著或显著负联结的种对有12对,占总种对数的26.67%。正负联结种对的比值为0.67,负联结占优势,这与群落整体关联性呈负关联的结果相一致。联结系数Ca(图2B)和Spearman秩相关分析(图2C)结果的正负联结比分别为0.67和0.73,表明种对间负联结占据相对优势地位,优势种间联结比较松散,各自趋向于独立分布。
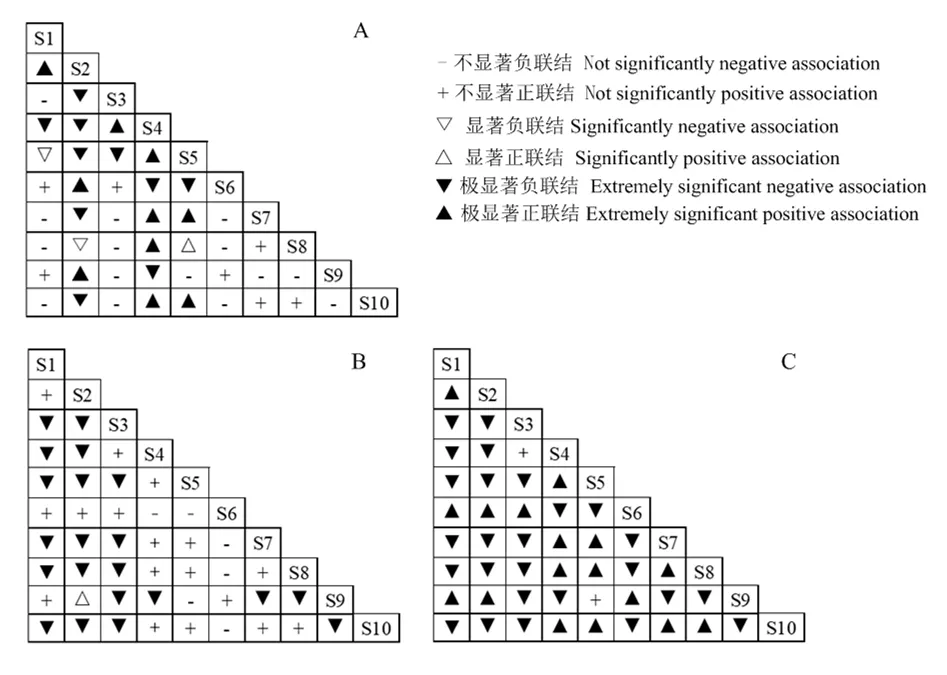
图2 主要物种的χ2检验(A)、联结系数(Cr)(B)和Spearman秩相关分析(C)半矩阵图Figure 2 Semi-matrix diagram of χ2-test coefficient (a),association coefficient (b) and Spearman’s rank correlation coefficients of interspecific association among main species
综上所述,本研究调查区域内的紫茎泽兰与土蜜树(Brideliatomentosa)、羊耳菊(Inulacappa)、石海椒(Reinwardtiaindica)及白茅(Imperata cylindrica)之间具有一定的正联结,而紫茎泽兰与里白和虎杖的种间联结均呈极显著负联结。
2.3 群落稳定性分析
M.Godron稳定性计算结果见表 4,群落稳定性坐标为(40.25, 59.75),与理想群落稳定点(20,80)相比向下移动了28.63欧氏距离,说明群落处于不稳定状态。

表4 群落稳定性分析结果(M.Godron法)Table 4 Results of community stability(M.Godron’s method)
2.4 环境因子与物种分布的关系
RDA排序结果显示,前2个排序轴累积解释了物种环境关系总方差的78.65%,第1排序轴所含的生态信息丰富,对变异的解释率较高(76.40%)(表5)。前2轴的特征根之和占总特征根值的78.65%,说明RDA前2轴在解释物种组成变异中起主要作用。对入侵群落主要物种组成影响显著的环境因子为有效钾、土壤温度、土壤pH值(表6)。其中,有效钾与第1轴呈极显著正相关,土壤温度与第2轴呈显著正相关,土壤pH值与第2轴呈极显著负相关(图3A),这 3个环境因子分别解释了群落组成 47.00%、19.50%和 13.70%的变异(表 6)。紫茎泽兰(S6)重要值与全磷、全钾和土壤温度均呈较大负相关,而与有效磷、有效钾和有效氮呈较大正相关。

表5 物种分布与入侵相关指数沿环境因子的RDA排序结果Table 5 RDA calculation of species distribution and invasion-related indexes along environmental gradients
方差分解结果表明(图4A),土壤因子与地形与生物因子之间有不同程度的协同作用,共同解释了 13.90%的群落物种组成变异。土壤因子是群落物种组成变异最主要的解释因子,能够解释22.30%的变异。其中,土壤因子对群落物种组成变异的单独解释力最大(22.30%);其次为地形与生物因子,解释 5.60%的变异,另有 58.20%的变异未能被解释。
2.5 紫茎泽兰入侵强度、群落可入侵性及群落稳定性与环境因子的关系
RAD前两轴累计包含了80.69%的解释率(表5),其中,第1排序轴所含的生态信息丰富,对入侵强度指数、群落可入侵性指数、群落稳定性指数的变异的解释率较高(79.18%)。决定RDA第1轴的环境因子为总磷(r= -0.911,P=0.002),解释率为65.7%(表6),沿着RDA第1轴从左往右,全磷含量逐渐下降。入侵强度指数、群落可入侵性指数与全磷呈显著负相关关系。群落稳定性指数则与总磷呈一定的正相关,而与有效钾呈一定的负相关(图3B)。
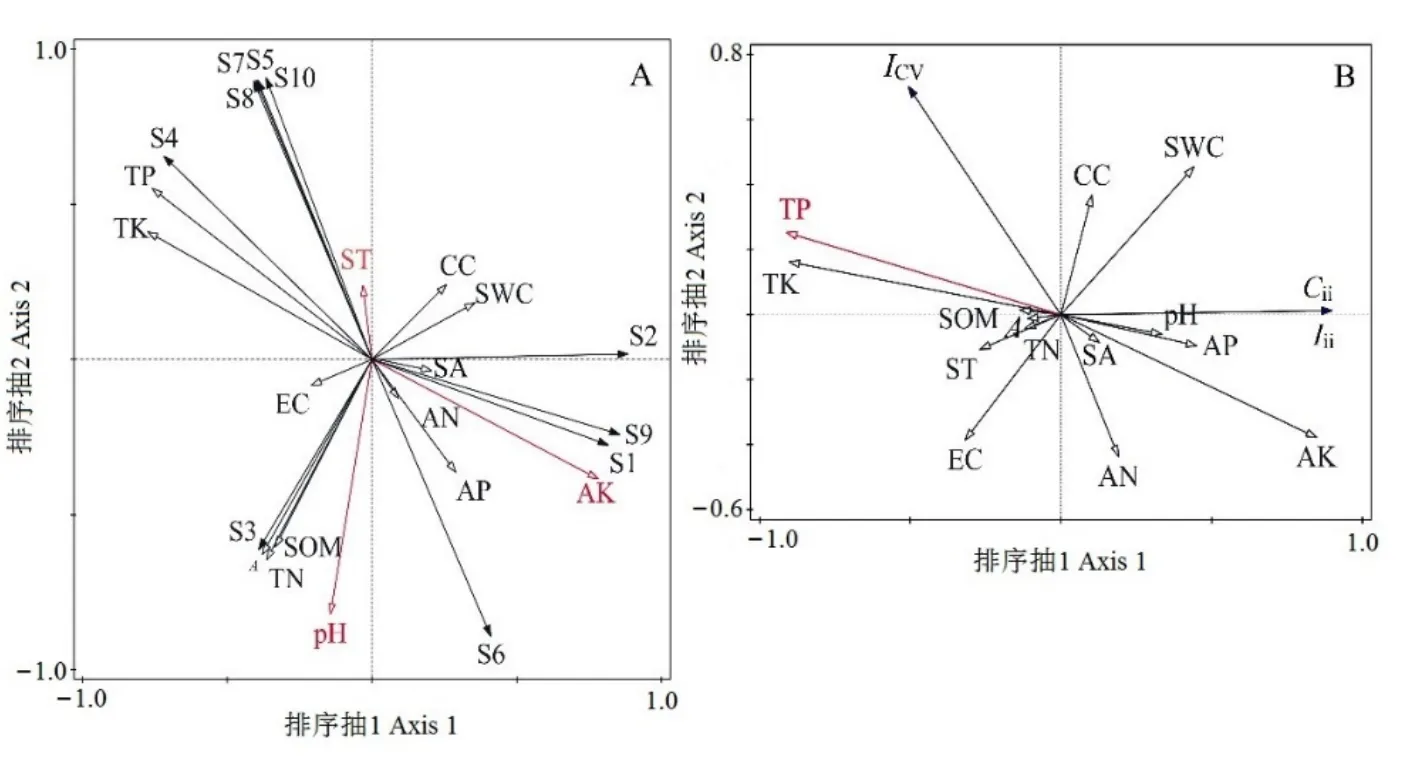
图3 物种分布(A)和入侵相关指数(B)沿环境因子的RDA二维排序图Figure 3 Two-dimensional RDA ordination diagram of species (A) and invasion-related indexes (B) along environmental gradients
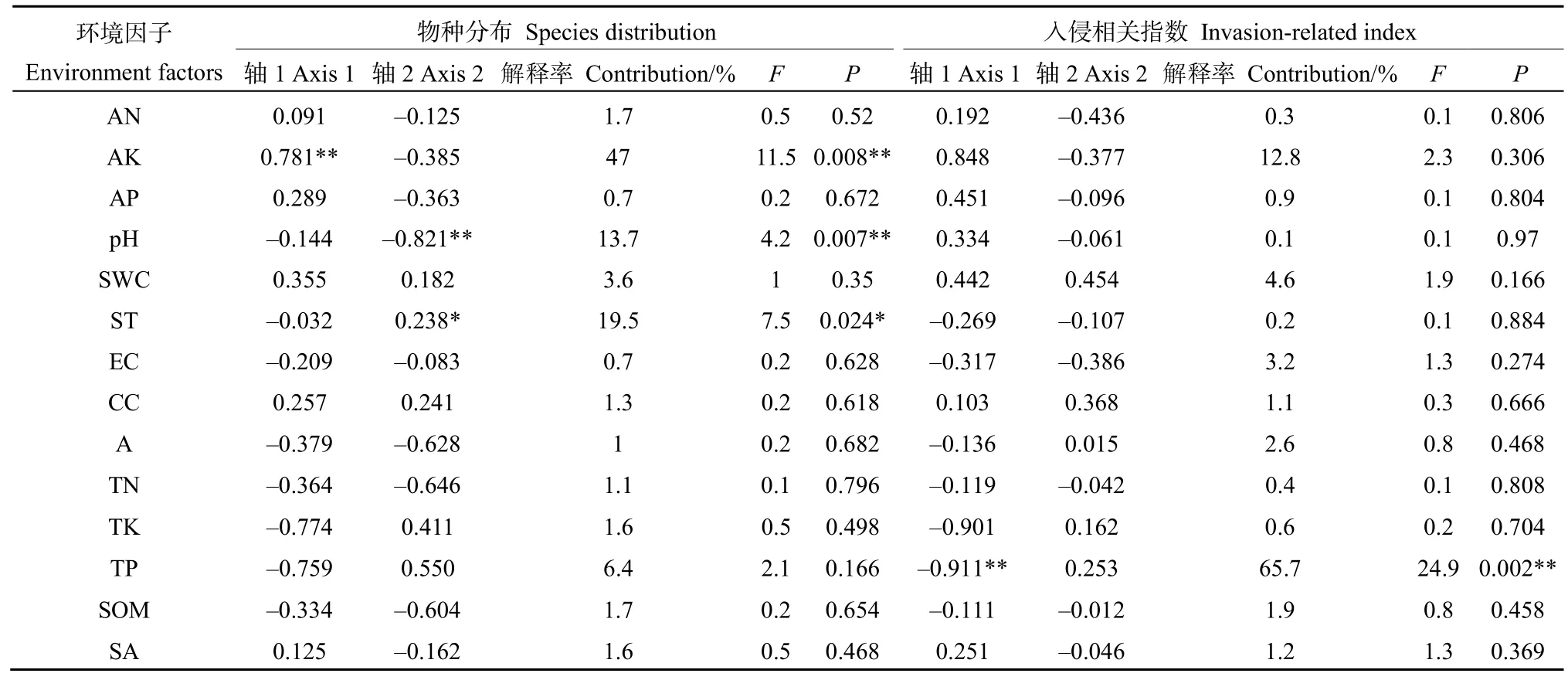
表6 环境因子与RDA排序轴之间的相关系数Table 6 Correlation coefficients between RDA axis and environment factors
方差分解分析结果表明(图4B),土壤因子和地形与生物因子对入侵相关指数变异的单独解释率分别为17.00%和8.90%,两者交互作用解释率为4.10%。另有 70%的变异未得到解释,表明存在较多未知因素影响入侵相关指数。
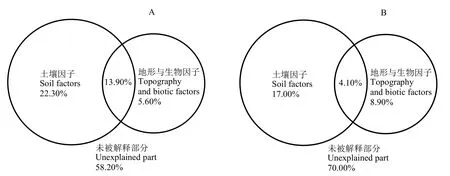
图4 环境因子对物种分布(A)和入侵相关指数(B)的解释率Figure 4 Explanatory power of different environmental factors for species distribution (A)and invasion-related indexes (B)
逐步回归模型分析结果显示(表 7),全磷与入侵植物入侵强度指数呈显著负相关,决定系数r2值表明全磷含量能解释入侵植物入侵强度指数63.90%的变化。全磷与群落可入侵性指数呈显著负相关,全磷对群落可入侵性指数的解释率为66.50%。有效钾与群落稳定性指数呈显著负相关,对群落稳定性指数的解释率为44.20%。

表7 入侵相关指数与环境因子的逐步回归分析Table 7 Stepwise regression analysis of intrusion-related indexes and environmental factors
随机森林模型结果表明,在所有变量中,全磷对入侵强度指数(图5A)和群落可入侵性指数(图5B)的相对重要性最高,而有效钾对群落稳定性指数的相对重要性最高(图5C),这些结果与回归模型所得结果一致。
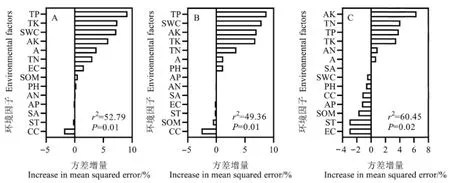
图5 环境因子对入侵植物入侵强度指数(A)、群落可入侵性指数(B)、群落稳定性指数(C)的重要性Figure 5 Importance of environmental factors to invasion intensity index of alien invasive plants(A), community invasibility index (B) and community stability index (C), respectively
2.6 结构方程分析
结构方程结果表明,影响入侵植物入侵强度指数、群落可入侵性指数及群落稳定性指数的土壤因子相同,但相对作用大小存在差异。对入侵植物入侵强度指数有显著影响的土壤因子是土壤全磷(P<0.05),其直接路径系数为-0.833(图 6A)。土壤全磷对群落可入侵性指数的影响显著(P<0.05),其直接路径系数为-0.836(图 6B)。土壤有效钾对群落稳定性指数存在直接效应,路径系数为-0.669(图6C)。此外,土壤全磷对有效钾有显著影响(P<0.01),路径系数为-0.858(图6)。

图6 入侵植物入侵强度指数(A)、群落可入侵性指数(B)、群落稳定性指数(C)与环境因子结构方程模型Figure 6 Structural equation model for invasion intensity index of alien invasive plants (A), community invasibility index (B), community stability index (C) and environmental factors
3 讨论
3.1 紫茎泽兰群落主要物种生态位和种间联结
在本研究中,主要物种的生态位宽度与重要值排序基本一致。紫茎泽兰占据最大的重要值和生态位宽度。另外,紫茎泽兰重要值的变异系数最小(10.50%),说明其在不同样地中的分布相对均匀。在调查区域内,紫茎泽兰在群落中占主导地位,具有较强的竞争力以及适应环境、利用资源的能力,这也是紫茎泽兰快速稳定占领新生境、入侵成功的重要原因(邓丹丹等,2015;李霞霞等,2017)。紫茎泽兰群落总体生态位重叠程度不高,而生态位相似性分析结果表明大部分物种对环境资源的利用差异较大,因此,当前群落内大部分物种间的竞争尚不激烈(郑晓阳等,2018;黄庆阳等,2020),在环境资源充裕时尚能共存。伴生种中里白和虎杖的重要值较大,同时二者与紫茎泽兰生态位重叠指数均大于 0.5。有研究表明,里白对南方红壤环境具有独特的适应机制,且该物种与芒萁一样都属于南方红壤侵蚀区优良的水土保持植物(熊平生等,2012;李小飞等,2013);虎杖为中国传统中药材,具有广泛的药用价值(Fabian et al.,2021),因其具有较强的生长繁殖能力,虎杖在欧洲多国被认定为入侵植物(Stefanowicz et al.,2017)。本研究中,里白和虎杖在紫茎泽兰群落中保持较强的竞争力,这与二者具有较强的生长和繁殖能力及较强的生境适应性有关。
通常,处于演替初期的群落,物种间的关联性较弱,甚至表现出较强的负关联,而正联结的种对越多,物种间关联性越强,群落越稳定(郭忠玲等,2004;刘润红等,2020)。本研究中,主要物种间的总体联结性表现为显著负联结,且χ2检验、联结系数AC测定以及Spearman秩相关系数检验结果均表明紫茎泽兰群落中负相关的种对数远大于正相关的种对数,表明群落尚未达到稳定。种间正联结有2种情况:(1)一个物种对另一物种产生依赖;(2)生态学特征和生存环境的差异和互补性,使各物种相互兼容。本研究中,紫茎泽兰与土蜜树、羊耳菊、石海椒等优势灌木之间呈现出一定的正联结。另外,里白和虎杖之间呈现出一定的正联结,二者与草本层的白蒿(Herbaartimisiae)、芒萁及野豌豆(Viciasepium)等本土草本之间亦呈现一定的正联结。推测本研究中大部分种对间的正联结关系属于第二种情况。物种之间存在空间或资源的排斥争夺造成种间负关联(郭佳琦等,2021),本研究中里白和虎杖与紫茎泽兰的种间联结均呈极显著负联结,二者与紫茎泽兰之间存在着较大的排斥性,表明二者与紫茎泽兰之间存在空间、环境资源等的竞争。通常认为,种间联结度与生态位重叠指数呈正相关(吴佳梦等,2019),即种间正联结越强,生态位重叠越大,反之亦然。亦有研究认为,种间关联程度与生态位重叠值并不具有一致性(吴佳梦等,2019;姜倪皓等,2021),由资源竞争引起的负关联生态位重叠值较高(陈旭,2008),本研究中亦得到类似结果,这也表明从生态位理论来解释入侵植物与本土植物优势种种间关联性存在一定的局限性。
竞争替代控制是入侵植物主要的生态控制方法,亦是目前普遍认可的控制方法(Li et al.,2015)。在兼顾生态效益和经济效益的前提下,综合群落可入侵性-物种功能群多样性假说(Naeem et al.,2000)、替代控制植物选择标准(Li et al.,2015)及本文结果,本研究建议将具有较强生长能力、适应性较强、兼具生态或经济效益作为本研究区域选择替代控制植物的重要标准。未来或可考虑在研究区域内利用本土植物里白和虎杖对哀牢山地区紫茎泽兰进行替代控制。在紫茎泽兰已入侵的群落中优先栽培里白和虎杖,既可以抵抗紫茎泽兰的入侵,又能在资源匮乏时与其形成利用性竞争,遏制紫茎泽兰的蔓延。同时,里白还能发挥水土保持功能,而虎杖作为一种药用价值很高的中药药材,或可成为林区经济发展新的增长点。此外,尽管虎杖作为在当地自然生态系统中自然定居的本土植物,亦有研究表明在欧洲多地河岸区,虎杖的落叶分解产生了植物毒素,进而对河岸和溪流不同植物群落产生正向和负向双方面的影响(Cybill et al.,2020),因此,亟待开展相关的生态风险监测体系及替代控制植物配置模型的应用研究。
3.2 环境因子对物种分布及紫茎泽兰入侵的影响
入侵植物可改变入侵地的生态环境,从而利于自身生长或抑制其他植物生长(Holmgrem et al.,1997;万方浩等,2011)。土壤养分在紫茎泽兰植物入侵过程中起着重要作用,研究表明紫茎泽兰入侵群落的土壤有机质、全氮、有效磷、有效钾含量显著提高,紫茎泽兰入侵显著提高了土壤养分,且有效养分对紫茎泽兰入侵较敏感(Hu et al.,2019;刘潮等,2007;吴天马等,2007;邓丹丹等,2015)。另外,亦有研究发现,紫茎泽兰入侵群落的土壤全磷、有效磷、有效钾含量均显著下降(Sun et al.,2013;吴天马等,2007)。本研究中,紫茎泽兰重要值与全磷和全钾均呈较强的负相关,而与有效钾呈较强的正相关。紫茎泽兰可直接利用的速效元素的含量增加,对紫茎泽兰生长发育有促进作用,紫茎泽兰这种改变土壤营养环境的能力为其在贫瘠生境的顺利入侵提供了有利条件(Hu et al.,2019;刘潮等,2007;邓丹丹等,2015)。另一方面,本研究结果亦表明,在多数情况下,紫茎泽兰入侵对土壤养分的影响较复杂,没有表现出一致的规律性。
本研究中,对紫茎泽兰群落主要物种组成影响显著的环境因子为有效钾、土壤温度、土壤pH值。强大入侵力源于入侵植物的强大的养分竞争特性,而这将导致土壤养分被大量消耗,从而影响本地植物的生长(Stefanowicz et al.,2017;邓丹丹等,2015)。有研究表明,紫茎泽兰植株的钾含量较高(刘潮等,2007),同时紫茎泽兰在生长过程中对土壤中的含磷和含钾的化合物具有很强的活化作用,并且对磷、钾具有较强的吸收能力和较大的需求量(Hu et al.,2019;牛红榜等,2007)。本研究发现,紫茎泽兰的入侵强度指数和群落可入侵性指数均与有效钾呈较强的正相关。因此,推测紫茎泽兰将土壤中大量的全钾转换成有效钾,然后被其吸收利用,促使其在与本地植物群落的竞争中取胜,从而利于其成功入侵(Hu et al.,2019;邓丹丹等,2015)。本研究中,逐步回归分析、随机森林模型及结构方程模型的结果均表明,群落稳定性指数与土壤有效钾含量呈极显著负相关,紫茎泽兰入侵地的物种多样性随入侵程度加重而降低(张修玉等,2010),以致植物功能群单一化,进而导致群落稳定性下降。
南方土壤酸性强,活性铁、铝含量高,土壤对磷固定作用强,有效磷含量低(Yan et al.,2020;李杰等,2011)。本研究样地土壤全磷含量均值为1.708 g·kg-1,远高于中国表层土壤全磷含量均值0.78 g·kg-1(Tian et al.,2010),但是可能由于样地所处区域属于酸性红壤地区(李杰等,2011),土壤的固磷作用较强,导致土壤磷有效性降低,磷难以被植物利用而成为植物生长的主要限制因子。本研究中,全磷与紫茎泽兰入侵强度指数和群落可入侵性指数均呈极显著负相关关系。此外,本研究发现,土壤全磷与有效钾呈较强的负相关,有研究表明在耕作土中土壤有效钾含量随着磷施用量的增加而降低(郑昭佩等,2004),但是在自然土壤条件下,尚无法对此作出很好的解释。基于本研究结果,推测紫茎泽兰入侵促进土壤全钾向植物可利用的钾素形态转化,而有效钾含量提高则促进紫茎泽兰生长,导致土壤pH提高(刘潮等,2007),进而提高磷素的有效性(李杰等,2011),最终导致土壤全磷含量降低。
本研究中,紫茎泽兰重要值与土壤pH呈较强的正相关,而紫茎泽兰的入侵强度指数和群落可入侵性指数均与土壤pH呈一定的正相关。研究表明,紫茎泽兰凋落物分解产生的酸性物质较少,其群落下土壤pH较高,这有利于土壤酶发挥作用,利于其对养分的吸收(刘潮等,2007)。土壤过度酸化,将会使土壤理化性质变劣,不利于土壤养分的保存和积累(Mccoll et al.,1991)。本研究区主要的乔木树种为云南松(Pinusyunnanensis),有研究表明云南松通过根际酸化来适应低磷环境(戴开结等,2005)。另外,研究表明,虎杖群落能显著降低土壤 pH 值(Dassonville et al.,2011;Stefanowicz et al.,2017),在本研究中亦观察到了类似的结果,而土壤pH值降低将进一步降低磷等元素的有效性(文亦芾等,2005),进而可能限制紫茎泽兰的蔓延。
本研究样地均处于海拔1600 m以上的高山地区,气温低,昼夜温差大,而紫茎泽兰重要值与土壤温度呈一定的负相关。研究表明,紫茎泽兰种子萌发温度范围较广,在亚适宜的低温下,萌发率和萌发指数均高于本地植物(张丽坤等,2014)。寒冷冬季,在本地植物叶片凋落、处于休眠和半休眠状态时,紫茎泽兰仍保持大面积的叶片与活跃的光合作用(Wang et al.,2013),另外紫茎泽兰表现较强的耐低温逆境能力(Gong et al.,2010),这些生物学特性将促进紫茎泽兰利用其他物种不能利用的资源,进而有利于其向更高海拔区域扩展。
植被郁闭度在70%以上,紫茎泽兰几乎无法入侵(何永福等,2005)。本研究中,紫茎泽兰重要值和郁闭度几乎无相关关系,本研究样地主要乔木为云南松,且郁闭度均值为73%,针叶林特殊的叶形使得针叶林林下光照强度仍显著高于阔叶林,因此光照未成为紫茎泽兰入侵的主要限制因子(朱文达等,2013;宋紫玲等,2019)。
4 结论
(1)紫茎泽兰入侵群落中,紫茎泽兰的重要值和生态位宽度均最大。伴生种中里白和虎杖的重要值较大,同时二者与紫茎泽兰的生态位重叠指数均大于0.5。
(2)入侵群落总体呈现显著负关联,群落处于非稳定状态。紫茎泽兰与里白和虎杖均具有极显著的负联结关系。未来或可考虑利用里白和虎杖对哀牢山地区的紫茎泽兰进行替代控制。
(3)对紫茎泽兰入侵群落主要物种组成影响显著的环境因子为有效钾、土壤温度、土壤pH值。
(4)土壤全磷与入侵植物入侵强度指数及群落可入侵性指数呈显著负相关,有效钾与群落稳定性指数呈显著负相关。

