参枣健脑口服液促进神经干细胞向神经元分化的作用机制研究
李 贺,肖洪贺,陈吉聪,赵宇萌,田 雨,田晋明,杨静娴
(辽宁中医药大学 药学院,辽宁 大连 116600)
阿尔茨海默病(AD)是一种以淀粉样蛋白沉积形成的老年斑和Tau 蛋白过度磷酸化形成的神经纤维缠结为主要病理特征,以进行性记忆力减退和认知功能障碍为主要临床表现的中枢神经系统退行性疾病[1]。
根据美国《World Alzheimer Report 2019》报告显示,全球目前AD 患者人数超过5 000 万,2019年全球用于治疗AD 的总支出达1 万亿美元,预计2050 年患者人数将会高达1.52 亿[2]。
AD 在中医学中属痴呆范畴[3],其病位在脑,与肾关系密切。病机为髓减脑消,神机失用[4]。干细胞与“肾精”在生命起源和生理功能上有较多共性[5],认为两者具有同一性。NSCs 分化形成的各类神经细胞组成脑髓,肾中精气化生为髓,上充于脑,是脑髓形成的物质基础,因此中枢神经再生可认为是精气化生为髓在细胞层次的反映。脑为髓海,髓海的充盈有赖于肾中精气的化生与充养,AD 患者脑内神经细胞缺失的根本原因在于肾精不足,髓海亏虚,因此通过补益肾精,充盈脑髓,即激活并促进体内干细胞增殖与分化,或能起到修复再生受损组织、恢复功能的作用。
参枣健脑口服液(SZJN)具有益气健脾、养心安神之功效,临床常用于治疗神经衰弱引起的心悸气短、失眠多梦、神疲乏力、腰腿酸软等症。流行病学调查结果显示[6],AD 患者中睡眠障碍发生率高达44%,以睡眠量不正常、睡眠中出现异常行为、睡眠和觉醒正常节律性交替紊乱为表现。睡眠障碍可加速淀粉样蛋白沉积,加重认知功能紊乱,影响患者生活质量;睡眠障碍还直接影响海马神经干细胞增殖、分化和存活,间接影响脑内微环境从而加重神经损伤[7]。实验室前期研究发现[8],SZJN 连续灌胃4 周能明显改善AD 模型小鼠学习记忆功能,促进体内神经元存活和神经干细胞的分化,但具体机制尚未清楚,因此本研究以离体培养的海马NSCs 为研究对象,进一步探究SZJN 促进NSCs 向神经元分化的潜在机制,为SZJN 临床用于AD 的治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 试剂 参枣健脑口服液(批号:B20020138)购于通化仁民药业股份有限公司;青-链双抗(批号:J190007)购 于 美 国Hyclone 公 司;CCK-8 细胞增殖检测试剂盒(G021-1-1)、LDH 乳酸脱氢酶试剂盒(A020-2-2)均购于南京建成生物工程研究所;兔抗GSK-3β 蛋白抗体(批号:WL01456)、兔抗P-GSK-3β 蛋白抗体(批号:WL03518)、兔抗β-catenin 蛋白抗体(批号:WL0962a)、HRP 标记山羊抗兔lgG(批号:WLA023)均购于沈阳万类生物技术有限公司;兔抗β-actin 蛋白抗体(批号:bs-0061R)、抗小鼠Nestin(批号:bs-20607R)、抗小鼠Sox-2(批号:bs-0523R)抗体、兔抗小鼠CyTM3标记二抗(批号:bs-0368R-Cy3)均购于北京博奥森生物技术有限公司;B27 Supplement(17054-044)购于美国Gibco 公司;Human FGF-basic(100-18B)、EGF(315-09)均购于美国Pepro Tech 公司。
1.1.2 实验仪器 Ti-S 型荧光显微镜(日本尼康株式会社);C00I01HW 型CO2培养箱(北京东联哈尔仪器制造有限公司);MR-96A 型酶标仪(深圳迈瑞生物医疗电子股份有限公司);PowerPacTMHC 型半干式蛋白转膜仪(美国Bio-Rad 公司);SH-510 型凝胶成像系统(杭州申花科技有限公司)。
1.1.3 实验动物 SPF 级C57BL/6 小鼠购于辽宁长生生物有限公司,合格证号为 SCXK(辽) 2017-0001。将一雄一雌两只小鼠合笼,饲养于20 ~ 25 ℃环境,相对湿度为40% ~ 60%,自由饮食饮水,每日12 h 自然光照维持,昼夜交替。将孕鼠单独一笼饲养直至分娩,取48 h 内新生乳鼠用于实验。研究中所有实验动物及相关操作都经过辽宁中医药大学伦理审查委员会批准[编号:SYXK(辽) 2019-0004],并严格按照国际实验伦理行为准则实行。
1.2 实验方法
1.2.1 NSCs的培养和鉴定 取48 h内新生C57BL/6乳鼠,剥离海马组织,除去脑膜和血管,打散后,加入含有0.125%EDTA 的胰酶,37 ℃消化3 min,经70 μm 滤网过滤,滤液在4 ℃条件下1 500 rpm离心5 min,离心完成后加入NSCs 增殖培养基(DMEM/F12 + 2%B27 + 20 ng/L bFGF + 20 ng/L EGF +1%P/S)重悬细胞,于37 ℃,5%CO2的培养箱培养,每隔3 d 半量换液。培养7 ~ 10 d 获得悬浮生长的神经球,进行传代,至第3 代开始后续试验。
取第3 代神经球,以1 × 105个/mL 细胞密度铺于96 孔板中,在增殖培养基下培养7 ~ 10 d,选择Nestin 和Sox-2 一抗进行双标记免疫荧光染色,倒置显微镜下观察。另取神经球打散后以相同密度铺于96 孔中,在NSCs 分化培养基(DMEM/F12 +10%FBS + 1%P/S)中培养7 ~ 10 d,免疫荧光染色法鉴定细胞中GFAP(星形胶质细胞)、NF-M(神经元)和NG-2(少突胶质细胞)特异性蛋白的表达。
1.2.2 AD 细胞模型的制备 根据实验室已建立的方法[7],第3 代NSCs 机械性打散后用于转染。取GFP或GFP-APP595/596 质粒15 μg,和辅助质粒(pLP1 6.5 μg、pLP2 2.5 μg 和pLP/VSV-G 3.5 μg)混合后,将脂质体2000 介导转染293T 细胞。转染24 h 后,倒置荧光显微镜下观察,可见绿色荧光。转染72 h后,收集含有病毒的细胞上清液,进行离心浓缩,用浓缩的病毒上清液感染打散的NSCs,感染72 h 后,荧光显微镜下观察荧光情况。
1.2.3 CCK-8 检测细胞活力 取打散的NSCs 和APP-NSCs 以1×105个/mL 细 胞 密 度 接 种 于96 孔板,在37 ℃,5%CO2的培养箱中孵育24 h 后给药,NSCs 和APP-NSCs 组给予10 μL PBS,给药组加入10 μL 不同浓度的SZJN,每组设置6 个复孔。24 h后,每孔加入10 μL CCK-8,孵育2 h,并用酶标仪在450 nm 处检测各组细胞的吸光度,计算细胞活力。
1.2.4 免疫荧光法检测NSCs 的分化情况 实验分为NSCs + PBS 组、NSCs + SZJN 组、APP-NSCs +PBS 组和APP-NSCs + SZJN 组。各组细胞在分化培养基下培养,NSCs + SZJN 组和APP-NSCs + SZJN组给予SZJN(终浓度为32 mg/mL);7 d 后弃去培养基,PBS 清洗1 次,4%多聚甲醛固定30 min,PBS清洗1 次,0.5%Triton-100 透化15 min,PBS 清洗1 次,5%BSA 封闭1 h,加入兔抗GFAP 一抗、兔抗NF-M一抗和兔抗NG2 一抗(1 ∶200),4 ℃孵育过夜。PBS 清洗2 次,加入Cy3 标记二抗(1 ∶300)避光孵育1.5 ~ 2 h。PBS 清洗1 次,DAPI 复染细胞核5 min,滴加抗荧光淬灭剂,倒置荧光显微镜下拍照。
1.2.5 神经干细胞迁移实验 将NSCs 接种于24孔板上,在分化培养基中培养,在37 ℃,5%CO2的培养箱中孵育3 d 后,倒置显微镜下拍照。应用Image J软件测量神经细胞从神经球边缘的迁移距离。
1.2.6 Western blot 检测Wnt/β-catenin 通路蛋白表达
各组细胞处理方式同“1.2.4”,处理后,用预冷的PBS 洗涤3 次,根据全蛋白试剂盒说明书提取蛋白,按照BCA 蛋白定量试剂盒说明书检测蛋白浓度。加入5 × Loading Buffer 制备上样缓冲液,随后使用SDS-PAGE 凝胶配制试剂盒制胶,122 V 恒压电泳90 min,指示剂到达底部后转膜。5%的脱脂奶粉常温封闭2 h,加入兔抗Wnt-3a、GSK-3β、p-GSK-3β、β-catenin 和β-actin 蛋白抗体,4 ℃孵化过夜;次日加入山羊抗兔二抗孵育PVDF 膜。按试剂盒说明书配制ECL 工作液,滴加超敏ECL 化学发光液,并置于凝胶成像仪中显影。用Image J 分析条带并计算相对灰度值。
1.2.7 统计学方法 用SPSS 22.0 软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用方差分析。以P< 0.05为差异具有统计学意义。
2 实验结果
2.1 SZJN 对APP-NSCs 细胞活力的影响
给 予16 mg/mL 和32 mg/mLSZJN 后APP-NSCs细胞活力明显升高(P< 0.05 或P< 0.01),并呈现剂量依赖性关系,说明SZJN 能够提高APP-NSCs 细胞活力,见图1A。16 mg/mL 和32 mg/mL SZJN 组的APP-NCSs 细胞LDH 释放量降低(P< 0.05 或P<0.01),说明SZJN 能够减轻APP-NSCs 损伤,见图1B。以上结果说明,SZJN 能够有效提高APP-NSCs细胞活力,减轻APP-NSCs 损伤。最终选择32 mg/mL作为后续实验给药浓度。
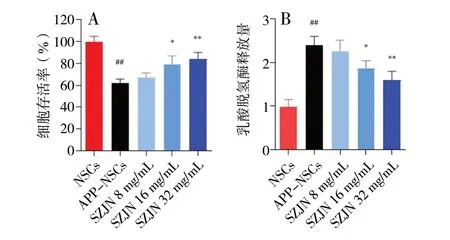
图1 SZJN 对细胞存活率和乳酸脱氢酶释放量的影响(n = 6)Fig. 1 Effects of SZJN on cell viability and lactate dehydrogenase release(n = 6)
2.2 SZJN 对APP-NSCs 增殖的影响
经过5 ~ 7 d 的培养,单个NSCs 可以形成多个细胞聚合的神经球,悬浮于培养基中,神经球的直径和数量能够反映NSCs 的增殖能力,检测培养7 d 后的神经球直径和数量,探究SZJN 对APP-NSCs 增殖的影响。与NSCs + PBS 组比较,NSCs + SZJN 组神经球的数量和直径明显增加(P< 0.05 或P< 0.01);与APP-NSCs + PBS 组比,APP-NSCs + SZJN 组神经球的数量和直径显著增大(P< 0.05 或P< 0.01),见图2、3。以上结果说明,32 mg/mL 的SZJN 连续作用7 d对NSCs和APP - NSCs的增殖具有促进作用。

图2 SZJN 对APP-NSCs 增殖的影响Fig. 2 Effects of SZJN on APP-NSCs proliferation
2.3 SZJN 对APP-NSCs 分化的影响
在分化条件下培养7 d 后,大多数NSCs 分化为星形胶质细胞,少部分分化为神经元和少突胶质细胞。与NSCs + PBS 组比较,NSCs + SZJN 组NSCs分化为星形胶质细胞的比例减少(P< 0.01),分化为神经元的比例增加(P< 0.05),而分化为少突胶质细胞的比例没有明显变化。同样的,在APP-NSCs 细胞上观察到类似的结果,SZJN 给药组的APP-NSCs向星形胶质细胞分化减少(P< 0.01),而向神经元分化增加(P< 0.05),少突胶质细胞的分化比例没有明显变化,见图4、5。这些结果说明,SZJN 能够促进NSCs 和APP-NSCs 向神经元方向分化。

图3 SZJN 对神经球直径和数量影响的统计图(n = 3)Fig. 3 Statistical diagram of the effect of SZJN on the diameter and number of neurospheres(n = 3)

图4 免疫荧光实验检测GFAP、NF-M 和NG2 的表达Fig. 4 Immunofluorescence experiments detect the expression of GFAP,NF-M and NG2

图5 各类型神经细胞比例统计图(n = 3)Fig. 5 Statistical diagram of proportion of various types of neural cells(n = 3)
2.4 SZJN 对NSCs 和APP-NSCs 神经元迁移距离的影响
与NSCs+PBS 组相比,NSCs + SZJN 组的神经元迁移距离增加(P< 0.01);与APP-NSCs + PBS 组相比,APP-NSCs + SZJN 组的神经元迁移距离增加(P<0.01),见图6、7。以上结果说明,SZJN 能够促进NSCs 和APP-NSCs 神经元的迁移。

图6 SZJN 对神经元迁移的影响Fig. 6 Effects of SZJN on neuronal migration
2.5 SZJN 通 过 激 活Wnt/β-catenin 通 路 促 进APP-NSCs 向神经元分化
与NSCs 组比较,APP-NSCs 组细胞中的Wnt-3a,p-GSK-3β/GSK-3β 和β-catenin 的蛋白表达明显降低(P< 0.01),而APP-NSCs + SZJN 组Wnt-3a、p-GSK-3β/GSK-3β 和β-catenin 蛋白表达明显升高(P< 0.01)。给予阻断剂XAV-939 孵育后发现,XAV-939 可 以 阻 断SZJN 提 高p-GSK-3β/GSK-3β和β-catenin 蛋白表达的作用,但不影响Wnt-3a 的表达水平,见图8、9。以上结果充分说明,SZJN 通过激活Wnt/β-catenin 信号通路来促进APP-NSCs 向神经元分化。

图7 神经元迁移距离的统计图(n = 3)Fig. 7 Statistical diagram of neuronal migration distances(n = 3)

图8 Western blot 条带图Fig. 8 Western blot strip plot
3 讨论
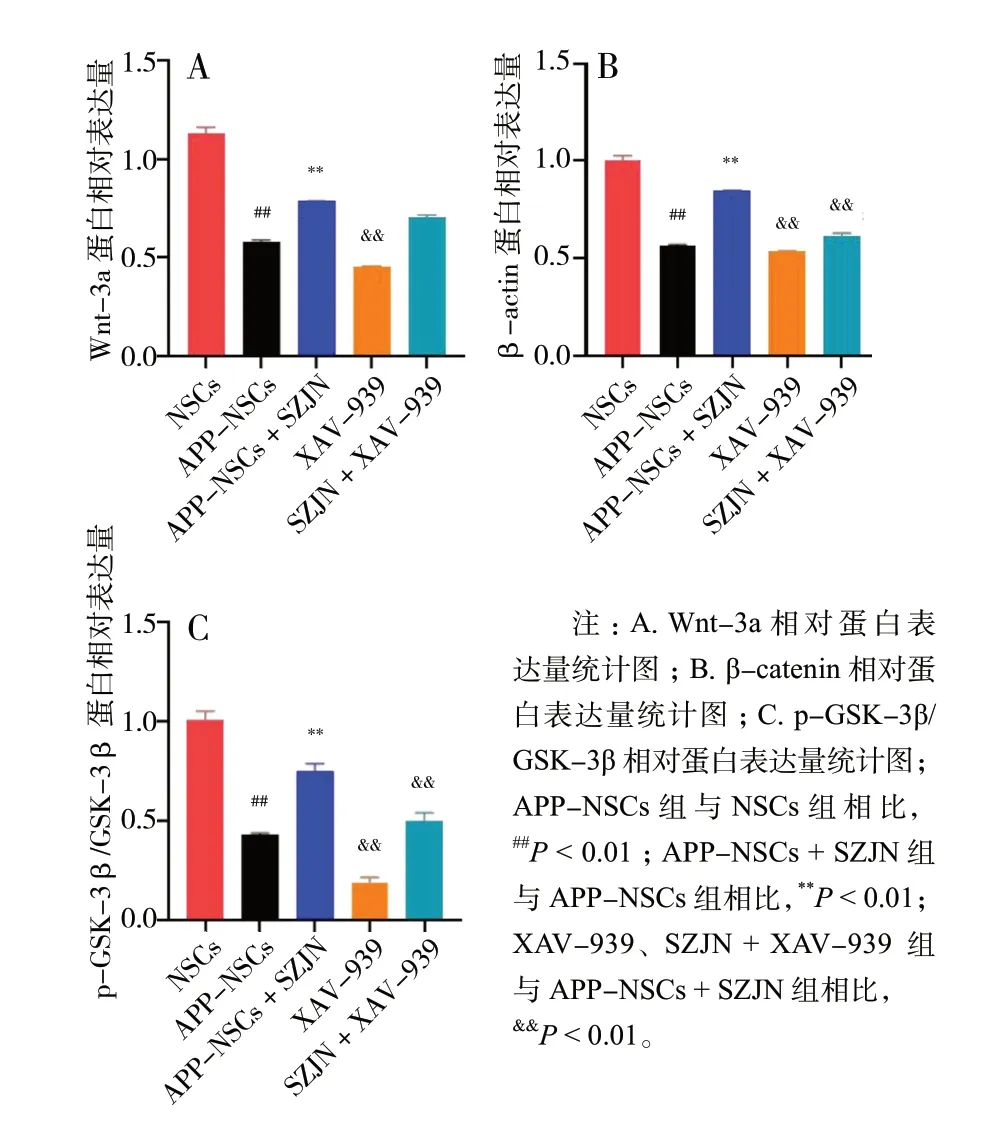
图9 Wnt-3a、β-catenin、p-GSK-3β/GSK-3β 相对表达量统计图(n = 3)Fig. 9 Statistical chart of the relative expression of Wnt-3a, β-catenin,p-GSK-3β/GSK-3β(n = 3)
《灵枢·经脉》云:“人始生,先成精,精成而生脑髓。”肾藏精,受五脏六腑之精藏之。肾精能够生气养神、生髓充骨、填补脑髓、激发各脏腑的功能活动,维持正常的生命活动[9]。根据“肾藏精”理论,SZJN 中人参大补元气,主补五脏,能够补益肾中精气;配伍淫羊藿、地黄、干姜,益精填髓、温补肾阳,使髓海化生有源,得以充养脑髓,激活内源神经干细胞,促进内源性神经再生[10],修复受损脑组织。
NSCs 具有多向分化和自我更新潜能,有可能成为治疗神经系统的损伤修复和退行性病变的有效手段[11]。实验室前期研究结果发现[8],SZJN 能够抑制神经元凋亡,并促进内源性神经发生,从而改善Aβ42联合东莨菪碱诱导的AD 样小鼠的认知能力。
通过构建一种模拟AD 病理特点的体外AD 细胞模型,来研究SZJN 对转染APP 的神经干细胞的增殖和分化能力的影响。经实验发现由APP 产生的Aβ寡聚体会抑制神经干细胞的增殖和分化。SZJN 能提升APP-NSCs 细胞的存活率并降低其LDH 的释放量,具有显著的神经保护作用。神经球形成性实验和免疫荧光染色结果显示,与APP 组相比,SZJN 组的神经球数目和直径明显提高;SZJN 组神经干细胞可分化为更多神经元,但分化为少突胶质细胞的能力与APP 组差异无统计学意义。
Wnt/β-catenin 信号通路参与调节NSCs 的增殖、分化、突触发生及轴突的形成,激活Wnt 信号通路可有效促进NSCs 向神经元分化,增加新生和成熟海马神经元数量。为了探索SZJN 的作用机制,我们采用Western blot 法检测Wnt/β-catenin 信号通路关键蛋白的表达情况。发现XAV-939 可以阻断SZJN 提高p-GSK-3β/GSK-3β 和β-catenin 蛋白表达的作用,同时不影响Wnt-3a 的表达水平。以上结果说明SZJN是通过激活Wnt/β-catenin 信号通路,抑制GSK-3β活性,并激活β-catenin 活性,在体外发挥促进神经干细胞向神经元分化的作用。从现有结果来看,SZJN具有治疗AD或者其它神经退行性疾病的潜能。
4 结论
本研究从激活内源神经再生角度探讨了SZJN 对AD 细胞模型的影响,初步证明SZJN 通过激活Wnt/β-catenin 信号通路促进神经干细胞向神经元分化,从神经再生角度出发,为SZJN 用于AD 的治疗提供了实验依据。但作为体外实验,本实验结果可能具有一定的局限性,SZJN 通过激活Wnt/β-catenin 信号通路促进神经再生的作用有待于通过体内实验进一步验证。

